Bevezetés
A múlt század hatvanas éveire a szerves kémia hatalmas mennyiségű, magyarázatot igénylő tényanyagot halmozott fel. A kísérleti tények folyamatos felhalmozódása mellett a szerves kémia elméleti koncepcióinak elégtelensége különösen kiélezett. Az elmélet lemaradt a gyakorlat és a kísérlet mögött. Ez az elmaradás fájdalmasan tükröződött a laboratóriumi kísérleti kutatások során; a vegyészek kutatásaikat nagyrészt véletlenszerűen, vakon végezték, gyakran anélkül, hogy megértették volna az általuk szintetizált anyagok természetét és a kialakulásukhoz vezető reakciók lényegét. Például az idősebb angol V. Perkin, aki 1856-ban szennyezett anilin oxidációjával szintetizálta a mauveine festéket, egyáltalán nem volt fogalma az általa felfedezett reakció mechanizmusáról; emellett egyáltalán nem a festék szintetizálását tűzte ki maga elé, hanem kinint próbált szerezni. A szerves kémia, Wöhler találó kifejezésével, egy sűrű erdőhöz hasonlított, tele csodálatos dolgokkal, egy hatalmas bozóthoz, amelynek nincs kijárata, nincs vége.
A szerves kémia sürgető problémái megkövetelték az alapkérdés megoldását: a molekulák véletlenszerű atomkupacok-e, amelyeket vonzó erők tartanak össze, vagy a molekulák bizonyos szerkezetű részecskék, amelyek egy anyag tulajdonságainak vizsgálatával megállapíthatók. Gerard típuselmélete, amelyet az akkori kémikusok többsége bizonyos fenntartásokkal elismert, nem volt hajlandó megoldani a molekulák szerkezetének problémáját a kémiai tulajdonságok tanulmányozása alapján. Eközben a szerves kémiában addigra már felhalmozódtak azok a tények, általánosítások, amelyek a probléma megoldásának alapjául szolgálhattak. Így például a gyökök elmélete rendkívül fontos általánosítást adott a szerves kémiának, ami abból állt, hogy a kémiai reakciók során bizonyos atomcsoportok változatlan formában jutnak át a kiindulási anyagok molekuláiból az ezekben a reakciókban képződött molekulákba. A típusok elmélete a maga részéről nagyban hozzájárult a molekulák legváltozatosabb részeinek és e változékonyság okainak vizsgálatához.
1. fejezet
1.1. Az elemek vegyértékének felfedezése
Frankland (1853) a fémorganikus vegyületek összetételét vizsgálva azt találta, hogy minden fém szigorúan meghatározott számú gyököt tartalmazó vegyületeket ad; ez a szám a fém vegyértéke. Az alábbiakban az egy-, két-, három- és négy vegyértékű fémek legegyszerűbb fémorganikus vegyületeit mutatjuk be:
Frankland felfedezése után világossá vált, hogy az atomok csak az atomok vegyértéke által meghatározott kapcsolatokban egyesülhetnek molekulákká. Különösen azt találták, hogy a szén négy vegyértékű (Kekule, Kolbe).
A vegyérték felfedezése közvetlenül ahhoz az elképzeléshez vezetett, hogy a molekuláknak határozott szerkezetük van. A molekulák szerkezetének megállapításának módjaival, valamint egy anyag tulajdonságainak molekulái szerkezetétől való függésével kapcsolatos kérdések azonban nyitva maradtak.
A szerves kémiában egy új korszak jött el a kémiai szerkezet elméletének megjelenésével. A szerkezetelmélet megalkotásában, megalapozásában és megerősítésében a főszerep a híres orosz tudósé, Alekszandr Mihajlovics Butlerové., bár rajta kívül ennek az elméletnek az elemeit A. Cooper (1831-1892) Angliában és A. Kekule (1829-1896) Németországban kezdte kidolgozni.
1.2. A. Cooper fejlesztései
1858-ban Cooper három nyelven (angol, francia és német) publikált egy cikket "Az új kémiai elméletről", amelyben elutasítja a típuselméletet, és kifejezi azt az álláspontot, amely szerint a szerves anyagok összes jellemzője akkor magyarázható, ha az atomoknak csak két tulajdonságát vesszük figyelembe: a "szelektív affinitást" (az atomok kapcsolódása) és az "affinitás fokát" (az atomok vegyértékét).
Cooper ezt írta: „Az én nézőpontomból ez a két tulajdonság elegendő ahhoz, hogy megmagyarázza mindazt, ami a szerves kémiára jellemző: ezt alább bebizonyítom... Egy molekulában, amely három, négy, öt stb. szénatomból áll. és ekvivalens mennyiségű hidrogén, oxigén stb., ez utóbbi helyettesíthető más elemekkel, míg a szén kölcsönösen összefüggő csomót alkot. Ez azt jelenti az egyik szén egy másik szénhez kapcsolódik. Ez a tulajdonság a szénnek úgymond sajátos fiziognómiát ad, és lehetővé teszi a szénatomok szerves vegyületekben való rétegződésének korábban érthetetlen tényének megértését.
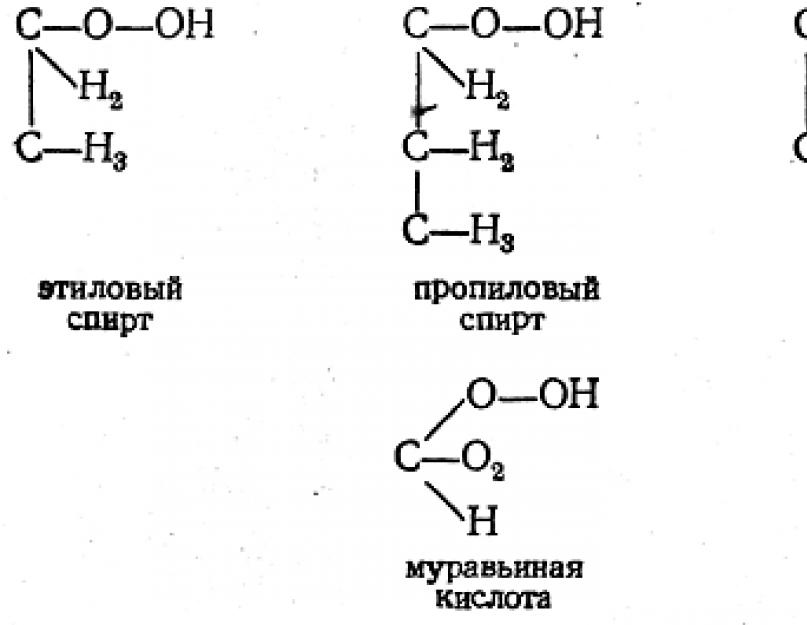
Miután így eljutott egy fontos gondolathoz a szénatomok láncáról, Cooper tovább fejti ki nézeteit olyan képletekben, amelyeknek terve szerint képet kell adniuk a vegyületek szerkezetéről. Példaként az ő képleteire, amelyek az első alkotmányos formulák voltak, a következőket hozhatjuk fel:

Ezekből a példákból látható, hogy Cooper elképesztően helyesen tudta átadni ezeknek a vegyületeknek, valamint néhány bonyolultabb és akkoriban kevéssé tanulmányozott (borkősav és borkősav) összetételét.
Mindezen képleteket azonban megfosztották a kísérleti alátámasztástól. Cooper egyáltalán nem vetette fel kísérleti igazolásuk lehetőségét. Képletei, mint jól látható, az atomok vegyértéke és kötése fogalmának formális értelmezésén, részben pedig intuíción alapultak. Természetesen ezzel a megközelítéssel lehetetlen elkerülni a hibákat. Így például a glicerin, glicerinsav és oxálsav Cooper által megadott képlete már hibás:

Így Cooper nézetei, amelyeket tehetséges, érdekes munkáiban dolgozott ki, nem rendelkeznek egy szigorú elmélet jellegével.
1.3. Loschmidt alkotmányos képletei
Egyéb Loschmidt 1861-ben kísérletet tett a szerves vegyületek szerkezeti képletekkel való ábrázolására . Loschmidt képletei megalkotásakor az atomokat a legkisebb anyagi részecskéknek tekintette, amelyek vonzási és taszító erők hatásának vannak kitéve. Ezek az erők kiegyenlítődnek, amikor az atomok közelednek egymáshoz, és a különböző atomok egymás közelében vannak egy bizonyos egyensúlyi helyzetben. Loschmidt önkényesen körökkel jelölte az atomi erők hatáskörét (például szén- és hidrogénatomok - egyszerű körök, oxigén - kettős, nitrogén - hármas).
Loschmidt képlete a következő volt:

Anélkül, hogy megpróbált volna fogalmat alkotni arról, hogy a benzolmolekulában lévő hat szénatom hogyan kapcsolódik egymáshoz, Loschmidt a benzolt a szimbólummal jelölte.

Cooperrel ellentétben a képletek kiválasztásakor Loschmidt a vegyérték (az ő kifejezésében „pollentitás”) mellett néha a kémiai tulajdonságok is vezérelték. Általában azonban a Loschmidt-képletek levezetésének módszere elvont volt, és gyakran egyszerűen ésszerűtlen. Tehát anélkül, hogy kémiai adatokra támaszkodna, Loschmidt megpróbált képleteket származtatni olyan összetett anyagokra, mint az indigó, a húgysav stb.
Természetesen ezek a képletek hibásnak bizonyultak. Annak ellenére, hogy a Loschmidt által javasolt szerves vegyületek számos képlete sikeresnek bizonyult, munkája szinte észrevétlen maradt az akkori kémikusok számára, és nem volt jelentős befolyása a szerves kémia elméletének fejlődésére.
1.4. Hozzájárulás a szerkezetelmélet megalkotásához Kekule
A szerkezetelmélet megalkotásához nagyban hozzájárult a híres német kémikus Kekule. Megállapította a szén tetravalenciáját, bevezette a metán típusát, javasolta a benzol jól ismert képletét, és ami a legfontosabb, helyesen fogalmazta meg az akkori szerves kémia egyik fő problémáját.
Kekule 1858-ban "A kémiai vegyületek keletkezéséről és átalakulásáról, valamint a szén kémiai természetéről" című cikkében írta.: „Úgy gondolom, hogy jelenleg a kémia fő feladata nem az atomcsoportok feltárása, amelyek bizonyos tulajdonságaik miatt gyököknek tekinthetők, és olyan vegyületek hozzárendelése bizonyos típusokhoz, amelyeknek aligha van más jelentése. mint mintaképletként. Ellenkezőleg, úgy gondolom, hogy ki kell terjeszteni a reflexiót magukra a gyökök szerkezetére; az elemek természetéből mind a gyökök, mind vegyületeik természetére le kell vezetni. Ennek kiindulópontjának Kekule az "elem bázikusságát" (valenciáját), a szerves vegyületekkel kapcsolatban pedig mindenekelőtt a szén természetét tekintette. Kekule számos más helyes gondolatot is megfogalmazott az atomok kapcsolatáról, grafikus képletekkel fejezte ki azt. Kekule azonban képleteiben nem tulajdonított jelentőséget a szerkezet képleteinek, csak a reaktivitást igyekezett kifejezni velük. Tehát ezt írta: „A racionális képletek célja, hogy határozott elképzelést adjanak a vegyület kémiai természetéről, tehát metamorfózisairól és a más testekhez való viszonyáról... Ugyanakkor természetesen szem előtt kell tartani, hogy a racionális formulák - ezek csak az átalakulások képletei, nem pedig alkotmányos formulák, hogy csak kifejezési eszközök a testek metamorfózisaihoz és a különféle anyagok egymáshoz való viszonyításának eredményeihez; hogy semmi esetre se fejezzék ki a szerkezetet, azaz az atomok elrendezését a megfelelő vegyületben.
A molekulák valódi szerkezetének megállapítását Kekule a kémia feladatának is tekintette, de ezt véleménye szerint nem a kémiai átalakulások tanulmányozásával, hanem csak a vegyületek fizikai tulajdonságainak összehasonlító vizsgálatával lehet elérni. Így ebben a kérdésben is Kekule Gérard pozíciójára állt.
Más típusú teoretikusokhoz hasonlóan Kekule is több tipikus képlettel ábrázolta az anyagot. Így például az ecetsav akkor ismert kémiai tulajdonságainak közvetítése érdekében Kekule azt javasolta, hogy nyolc képlettel ábrázolják. Így bár Kekule nézetei közel álltak az új szerkezeti nézetekhez, bár Kekule jelentős mértékben hozzájárult a kémiai szerkezetelmélet fejlődéséhez, nem tudott teljesen megszabadulni a típuselmélet gondolataitól.
2. fejezet A. M. Butlerov kémiai szerkezetének elmélete
2.1. Butlerov ötletei
A. M. Butlerov ellenezte a típuselmélet azon álláspontját, amely szerint a molekulák szerkezetét kémiai úton nem lehet megállapítani; ezt mutatta meg egy molekulában az atomok kémiai kötéseinek bizonyos sorrendje van (kémiai szerkezet). Butlerov tovább bizonyította ezt egy molekula szerkezete egy anyag kémiai tulajdonságainak vizsgálatával megállapítható, és fordítva, a szerkezet ismeretében egy vegyület számos tulajdonsága előrelátható. Butlerov nemcsak alátámasztotta ezt az álláspontot a már rendelkezésre álló tényanyaggal, hanem annak alapján megjósolta új anyagok létezésének lehetőségét is, amelyeket később ő és más vegyészek fedeztek fel.
A. M. Butlerov elméletének fő gondolatát 1861-ben fogalmazta meg „Az anyagok kémiai szerkezetéről” című cikkében. Ezt írta: „Abból az elképzelésből kiindulva, hogy minden egyes kémiai atom, amely a test része, részt vesz ennek kialakulásában, és itt egy bizonyos mértékű kémiai erővel (affinitással) hat hozzá, a kémiai szerkezetet eloszlásnak nevezem. ennek az erőnek a hatásáról, amelynek következtében az egymást közvetve vagy közvetlenül befolyásoló kémiai atomok kémiai részecskévé egyesülnek.
Butlerov elméletének alapja az atomok kémiai kölcsönhatásának sorrendje egy molekulában . A kémiai kölcsönhatások ezen sorrendje nem tartalmazza a kémiai kötés mechanizmusára és az atomok fizikai elrendezésére vonatkozó elképzeléseket. A kémiai szerkezet elméletének ez a fontos jellemzője lehetővé teszi, hogy a molekula fizikai modelljének megalkotásakor mindig erre támaszkodjunk.
A kémiai szerkezet fogalmának megállapítása után A. M. Butlerov új definíciót ad az anyag természete : « az összetett részecske kémiai természetét az elemi alkotóelemek jellege, mennyisége és kémiai szerkezete határozza meg ».
Így A. M. Butlerov volt az első, aki megállapította minden molekulának van egy bizonyos kémiai szerkezete, hogy a szerkezet határozza meg az anyag tulajdonságait, és az anyag kémiai átalakulásait tanulmányozva megállapítható a szerkezete. .
2.2. Kémiai szerkezeti képletek
A. M. Butlerov nézetei a kémiai szerkezeti képletek jelentőségéről elméletének főbb rendelkezéseiből következnek. Butlerov úgy vélte, hogy ezeknek a formuláknak nem „tipikusnak”, „reakciósnak”, hanem alkotmányosnak kell lenniük. Ebben az értelemben minden anyagra csak egy racionális képlet lehetséges, amely alapján megítélhető a kémiai tulajdonságok.
Ami a szerkezeti képletek írásmódját illeti, Butlerov joggal tartotta ezt a kérdést másodlagos jelentőségűnek: „Emlékezve arra, hogy a lényeg nem a formában, hanem a lényegben, a koncepcióban, az ötletben van, és figyelembe véve, hogy az izomériát jelző képletek , logikailag szükséges kifejezni a jelen részecskét, azaz bizonyos benne létező kémiai összefüggéseket, nem nehéz arra a következtetésre jutni, hogy bármelyik írásmód lehet jó, ha csak kényelmesen kifejezi ezeket az összefüggéseket. Még az is természetes, hogy különböző módokat használunk, előnyben részesítve azt, amelyik adott esetben kifejezőbb. Például a C2H6 etán szinte közömbösen ábrázolható:
Nem kellően definiált megértés esetén azonban egy eltérő írásmód zavartsághoz vezethet.
2.3. A kémiai szerkezetelmélet értéke, szerepe
A kémiai szerkezet elméletének megjelenésével a szerves kémia a tipikus képletek labirintusából emelkedett ki; utakat mutattak be a molekulák belső szerkezetének megismeréséhez; elméleti alapok jelentek meg a kémiai folyamatok megértéséhez, a szerves vegyületek új szintézisének előrejelzéséhez. A kémiai szerkezetelmélet a kezdetektől fogva lehetővé tette a kémikusok számára, hogy irányítottan, céltudatosan végezzenek kísérleti kutatásokat.
A kémiai szerkezetelméletben figyelemreméltó siker volt az izoméria jelenségének magyarázata, amelyet a múlt század első negyedében fedeztek fel.
Tudniillik a 18. század végén kialakult az összetétel-állandóság törvénye, amely szerint minden adott anyagnak meghatározott, állandó összetétele van. Ez a törvény több évtizeden át ellenkező jelentést is kapott, vagyis azt hitték, hogy csak egy adott anyagnak van adott meghatározott összetétele. Ez utóbbi álláspont helytelensége számos szerves anyag vizsgálata eredményeként mutatkozott meg. 1823-ban Liebig, miután tanulmányozta a fulminsav ezüstsóját, megállapította, hogy összetétele (AgCNO) megegyezik a Wöhler által 1822-ben nyert ezüst-izocianát összetételével, amely élesen különbözik attól.
Ez a figyelemre méltó tény nem maradt sokáig elszigetelten; Hamarosan sok más anyagot fedeztek fel azonos összetétellel, de eltérő tulajdonságokkal. 1830 óta a felfedezett jelenséget izomerizmusnak (a görögből - azonos részekből álló) és az azonos összetételű anyagokat - izomereknek nevezték. Az izomériát a gyökök elméletével és a típuselmélettel magyarázó kísérletek egyoldalúak voltak (mint maguk ezek az elméletek), ezért nem adtak kielégítő eredményt. Valójában csaknem négy évtizeden keresztül az izoméria jelensége nem talált elméleti magyarázatot.
Egy ilyen magyarázat csak a kémiai szerkezet elméletének megalkotása után vált lehetségessé, amely szerint egy anyag természetét nemcsak a molekulát alkotó atomok természete és száma határozza meg, hanem a szerkezete, kémiai szerkezete is. Ebből kétségtelenül nyilvánvalóan következik az azonos összetételű és molekulatömegű, de az egyenlőtlen kémiai szerkezet miatt teljesen eltérő anyagok létezésének lehetősége. Így a kémiai szerkezet különbsége természetes és egyszerű magyarázata volt az izoméria jelenségének.
2.4. Butlerov felfedezése a dinamikus izoméria jelenségére
Megjegyzendő A. M. Butlerov fedezte fel és először magyarázta meg a dinamikus izoméria jelenségét , abból áll, hogy két vagy több izomer bizonyos körülmények között könnyen átmegy egymásba (ezt a jelenséget jelenleg tautomerizmusnak nevezik). Az izoméria problémája összességében komoly próbatétel volt Butler elmélete számára, és remekül megoldotta.
A. M. Butlerov tanításainak fontos jellemzője, hogy a molekulát semmiképpen sem tartotta valamiféle mozdíthatatlan képződménynek, amelyben az egyes atomok holt, élettelen szerkezetté kapcsolódnak. . Ebben a témában ezt írta:
„... jelen időben egy kémiai vegyületre nem úgy tekintünk, mint valami halottra, mozdulatlanra; ellenkezőleg, elfogadjuk, hogy a legkisebb részecskéiben rejlő állandó mozgással van felruházva, amelynek sajátos kölcsönös kapcsolatai állandó változásoknak vannak kitéve, ebben az esetben egy bizonyos állandó átlageredményben összegezve. Itt is előfordulhatnak állandó változások az anyagok tömegét alkotó kémiai részecskékben, de mindez magának a tömegnek egy bizonyos átlagos állapotára redukálódik. Egyszóval általában mindig egy bizonyos mobil egyensúlyi állapot áll előttünk. Ebből a kémiai vegyület természetének és a kémiai reakciók dinamikus nézőpontjából világosan megmagyarázzuk azokat a jelenségeket, amelyek az előző szempontból teljesen érthetetlenek voltak. Érdemes rámutatni például a disszociációra, arra, hogy milyen könnyen magyarázzuk ma már a visszareakciókat stb.
2.5. Butlerov prioritásainak védelme. D. I. Mengyelejev szerepe
Az A. M. Butlerov által rövid időn belül megfogalmazott kémiai szerkezetelmélet világos, megdönthetetlen rendelkezései biztosították egyetemes elismerését. Ugyanakkor megvolt az a tendencia, hogy A. M. Butlerov érdemeit elhallgatták, és csak Kekulét és Coopert mutatták be a szerkezetelmélet megalkotóiként.
Néhány évvel a szerkezetelmélet megalkotása után A. M. Butlerovnak meg kellett védenie prioritását, mivel néhány külföldi kémikus, akik először nem ismerték fel, és nem is értették elméletét, később megpróbálták a fő rendelkezések megalkotásának megtiszteltetését tulajdonítani. ezt az elméletet maguknak.
A. M. Butlerov döntő szerepét a kémiai szerkezet elméletének megalkotásában 1868-ban egyértelműen hangsúlyozta a nagy orosz tudós, D. I. Mengyelejev. , ajánlva A. M. Butlerovot a szentpétervári egyetemnek. Mengyelejev azt írta, hogy Butlerov „... a kémiai átalakulások tanulmányozásával ismét a heterogén elemeket összetartó kötések legmélyére törekszik behatolni, és mindegyiküknek veleszületett képességet ad arra, hogy ismert számú vegyületbe lépjen be, és a tulajdonságok különbsége az elemek másfajta összekapcsolásának módjához . Senki sem folytatta ezeket a gondolatokat olyan következetesen, mint ő, bár korábban átnézték... A szerves vegyületek minden osztályának azonos áttekintése érdekében Butlerov 1864-ben kiadott egy könyvet: "Bevezetés a szerves kémia teljes tanulmányozásába ", amelyet tavaly Butlerov fordított németre, olvasmányaival és az ötletek lenyűgözésével Kazanyban az ő irányzatában dolgozó vegyésziskolát alakított ki maga körül. Markovnikov, Myasnikov, Popov, két Zajcev, Morgunov és néhány más névnek sikerült hírnevet szereznie számos felfedezésnek köszönhetően, amelyeket elsősorban a Butleroz mozgalom függetlensége miatt tettek. Személyesen tanúsíthatom, hogy olyan francia és német tudósok, mint Wurtz és Kolbe, Butlerovot tartják korunk egyik legbefolyásosabb mozgatójának a kémia elméleti irányzatában.
A. M. Butlerov helyesen hitte, hogy a kémiai szerkezet elmélete fejlődni fog, ahogy új tényanyag gyűlik össze. Ezt írta: „... Nem tudom figyelmen kívül hagyni, hogy a következtetések, amelyekre a kémiai szerkezet elve vezet, több ezer esetben a tényekkel összhangban állnak. Mint minden elméletben, és természetesen itt is vannak hiányosságok, tökéletlenségek - vannak tények, amelyek nem felelnek meg szigorúan a kémiai szerkezet fogalmának. Természetesen különösen vágyni kell az ilyen tények reprodukálására; a létező elméletekkel meg nem magyarázott tények a legdrágábbak a tudomány számára, kidolgozásuktól elsősorban a közeljövőben várható fejlődését kell várni.
Következtetés
A kémiai szerkezet elméletét A. M. Butlerov alkotta meg a 19. század közepén, abban az időben, amikor Oroszországban új polgári társadalmi-gazdasági viszonyok fejlődtek, és a termelőerők növekedése a természettudomány erőteljes fejlődéséhez vezetett. Ebben az időszakban I. M. Sechenov, majd I. P. Pavlov megalkotta az ember és az állatok magasabb idegi aktivitásának materialista tanát, K. A. Timirjazev és valamivel később I. V. Micsurin alapozták meg a biológia fejlődésének új szakaszát, D. I. Mengyelejev felfedezi a legfontosabbakat. a természet törvénye - a periodikus törvény, amely általánosította a kémiai elemekről akkoriban rendelkezésre álló ismereteket. N. I. Lobacsevszkij a matematika új területét nyitja meg.
A kémiai szerkezet elmélete megteremtette a szerves kémia tényanyagának tudományos rendszerezésének lehetőségét, kifejtette legfontosabb törvényszerűségeit, és megadta a kulcsot az új tények előrejelzéséhez. Ez volt a tudományos alapja a modern szerves kémia létrehozásának. Ez képezte a szerves kémia modern elméleti koncepcióinak alapját. Ma ennek az elméletnek a lényege a következőképpen fejezhető ki: a szerves vegyületek fizikai és kémiai tulajdonságait molekuláik összetétele, valamint kémiai, térbeli és elektronszerkezete határozza meg.
Bibliográfia
1. A.I. Artemenko "Szerves kémia": Tankönyv az építkezéshez. szakember. egyetemek. – 4. kiadás, átdolgozva. és további - M .: Felsőiskola; 2000. - 559 p.: ill.
2. A.E. Chichibabin "Szerves kémia": Tankönyv egyetemek számára. - T. 1-2. Szerk. 3, isp. és további 1963. - 910 p.
Hidrogén típus:
Az ilyen képletek némileg hasonlóak a modernekhez. A típuselmélet támogatói azonban nem tartották az anyagok valódi szerkezetét tükrözőnek, és sok különböző képletet írtak egy vegyületre, attól függően, hogy milyen kémiai reakciókat próbáltak leírni ezekkel a képletekkel. Alapvetően kiismerhetetlennek tartották a molekulák szerkezetét, ami ártott a tudomány fejlődésének.
3. J. Berzelius 1830-ban bevezette az "izoméria" kifejezést az azonos összetételű, eltérő tulajdonságú anyagok létezésének jelenségére.
4. A szerves vegyületek szintézisében elért sikerek, amelyek eredményeként eloszlott a vitalizmus tana, vagyis az "életerő", amelynek hatására állítólag szerves anyagok képződnek az élőlények testében:
1828-ban F. Wehler karbamidot szintetizált egy szervetlen anyagból (ammónium-cianát);
1842-ben N. N. Zinin orosz kémikus anilint kapott;
1845-ben A. Kolbe német kémikus ecetsavat állított elő;
1854-ben M. Berthelot francia kémikus zsírokat szintetizált, és végül
1861-ben A. M. Butlerov maga szintetizált egy cukorszerű anyagot.
5. A XVIII. század közepén. a kémia szigorúbb tudomány lesz. E. Frankland és A. Kekule munkája eredményeként kialakult a kémiai elemek atomjainak vegyértékének fogalma. Kekule kidolgozta a szén tetravalenciájának fogalmát. Cannizzaro munkáinak köszönhetően az atom- és molekulatömeg fogalma világosabbá vált, jelentésük, meghatározási módszereik finomodtak.
1860-ban több mint 140 vezető vegyész gyűlt össze Európa különböző országaiból egy nemzetközi kongresszusra Karlsruhéban. A kongresszus nagyon fontos esemény lett a kémia történetében: összefoglalták a tudomány sikereit, és előkészítették a feltételeket a szerves kémia fejlődésének új szakaszához - A. M. Butlerov által a szerves anyagok kémiai szerkezetére vonatkozó elmélet megjelenéséhez ( 1861), valamint D. I. Mengyelejev – A periodikus törvény és a kémiai elemek rendszere (1869) alapvető felfedezéséért.
1861-ben A. M. Butlerov felszólalt az orvosok és természettudósok kongresszusán Speyer városában „A testek kémiai szerkezetéről” című jelentésével. Ebben felvázolta a szerves vegyületek kémiai szerkezetére vonatkozó elméletének alapjait. A kémiai szerkezet alatt a tudós megértette az atomok kapcsolódási sorrendjét a molekulákban.
A. M. Butlerov személyes tulajdonságai
A. M. Butlerovot a kémiai ismeretek enciklopédikus jellege, a tények elemzésének és általánosításának, valamint az előrejelzésnek a képessége jellemezte. Megjósolta a bután izomerjének létezését, majd megkapta, valamint a butilén - izobutilén izomerjét.
Butlerov Alekszandr Mihajlovics (1828-1886)
Orosz kémikus, a Szentpétervári Tudományos Akadémia akadémikusa (1874-től). A kazanyi egyetemen végzett (1849). Ott dolgozott (1857-től - professzor, 1860-ban és 1863-ban - rektor). A modern kémia alapjául szolgáló szerves vegyületek kémiai szerkezetének elméletének megalkotója. Megerősítette az atomok kölcsönös hatásának gondolatát egy molekulában. Megjósolta és megmagyarázta számos szerves vegyület izomériáját. Megírta "Bevezetés a szerves kémia teljes tanulmányozásába" (1864) - az első kézikönyv a tudománytörténetben, amely a kémiai szerkezet elméletén alapul. Az Orosz Fizikai és Kémiai Társaság Kémiai Tanszékének elnöke (1878-1882).
A. M. Butlerov létrehozta az első szerves kémikus iskolát Oroszországban, amelyből briliáns tudósok emelkedtek ki: V. V. Markovnikov, D. P. Konovalov, A. E. Favorsky és mások.
Nem csoda, hogy D. I. Mengyelejev ezt írta: „A. M. Butlerov az egyik legnagyobb orosz tudós, mind tudományos műveltségét, mind munkáinak eredetiségét tekintve orosz.”
A kémiai vegyületek szerkezetének elméletének főbb rendelkezései
A szerves vegyületek kémiai szerkezetének elméletét, amelyet A. M. Butlerov terjesztett elő a múlt század második felében (1861), számos tudós, köztük Butlerov tanítványai és ő maga is megerősítette. Ennek alapján sok olyan jelenség megmagyarázhatónak bizonyult, amelyeknek addig nem volt értelmezése: izoméria, homológia, a szénatomok négyértékű megnyilvánulása szerves anyagokban. Az elmélet betöltötte prognosztikai funkcióját is: ennek alapján a tudósok megjósolták a még ismeretlen vegyületek létezését, leírták a tulajdonságokat és fedezték fel azokat.
Tehát 1862-1864-ben. A. M. Butlerov megvizsgálta a propil-, butil- és amil-alkoholok izomériáját, meghatározta a lehetséges izomerek számát és levezette ezen anyagok képleteit. Létezésüket később kísérletileg bebizonyították, és az izomerek egy részét maga Butlerov szintetizálta.
A XX század folyamán. a kémiai vegyületek kémiai szerkezetére vonatkozó elmélet rendelkezéseit a tudományban elterjedt új nézetek alapján dolgozták ki: az atom szerkezetének elmélete, a kémiai kötés elmélete, a kémiai reakciók mechanizmusairól alkotott elképzelések. Jelenleg ez az elmélet univerzális jellegű, vagyis nemcsak szerves, hanem szervetlen anyagokra is érvényes.
Első pozíció. A molekulák atomjai vegyértéküknek megfelelően meghatározott sorrendben kapcsolódnak egymáshoz. A szén minden szerves és legtöbb szervetlen vegyületben négy vegyértékű.
Nyilvánvaló, hogy az elmélet első rendelkezésének utolsó része könnyen magyarázható azzal, hogy a vegyületek szénatomjai gerjesztett állapotban vannak: 
a) a négy vegyértékű szénatomok összekapcsolódhatnak egymással, és különféle láncokat alkothatnak:
nyitott elágazó
- elágazás nélkül nyílik
- zárva
b) a szénatomok kapcsolódási sorrendje a molekulákban eltérő lehet, és a szénatomok közötti kovalens kémiai kötés típusától függ - egyszeres vagy többszörös (kettős és hármas).
Második pozíció. Az anyagok tulajdonságai nemcsak minőségi és mennyiségi összetételüktől függnek, hanem molekuláik szerkezetétől is.
Ez az álláspont magyarázza az izoméria jelenségét. Az azonos összetételű, de eltérő kémiai vagy térbeli szerkezetű, és ezért eltérő tulajdonságú anyagokat izomereknek nevezzük. Az izoméria fő típusai:
Strukturális izoméria, amelyben az anyagok különböznek a molekulák atomjainak kötési sorrendjében:
1) a szénváz izomériája 
3) homológ sorozatok izomériája (interclass) 
Téri izoméria, amelyben az anyagok molekulái nem az atomok kötési sorrendjében, hanem térbeli helyzetükben térnek el egymástól: cisz-transz-izoméria (geometriai).
Ez az izoméria azokra az anyagokra jellemző, amelyek molekulái sík szerkezetűek: alkének, cikloalkánok stb.
Az optikai (tükör) izomerizmus is a térbeli izoméria közé tartozik.
A szénatom körüli négy egyes kötés, amint azt már tudja, tetraéderes elrendezésű. Ha egy szénatom négy különböző atomhoz vagy csoporthoz kötődik, akkor ezeknek a csoportoknak a térben eltérő elrendezése lehetséges, azaz két térbeli izomer forma.
Az alanin (2-aminopropánsav) aminosav két tükörformáját mutatja a 17. ábra.
Képzeljük el, hogy egy alanin molekulát helyezünk a tükör elé. Az -NH2 csoport közelebb van a tükörhöz, így elöl lesz a tükrözésben, a -COOH csoport pedig a háttérben stb. (lásd a jobb oldali képet). Alanya két térbeli formában létezik, amelyek egymásra helyezve nem egyesülnek egymással.
A kémiai vegyületek szerkezetére vonatkozó elmélet második álláspontjának egyetemessége megerősíti a szervetlen izomerek létezését.
Tehát a szerves anyagok első szintézise - a karbamid szintézise, amelyet Wehler (1828) végzett - azt mutatta, hogy egy szervetlen anyag - az ammónium-cianát és egy szerves anyag - a karbamid izomerek: 
Ha a karbamid oxigénatomját kénatomra cseréljük, tiokarbamidot kapunk, amely az ammónium-tiocianát izomerje, amely a Fe 3+ ionok jól ismert reagense. Nyilvánvaló, hogy a tiokarbamid nem adja ezt a minőségi reakciót.
Harmadik pozíció. Az anyagok tulajdonságai a molekulákban lévő atomok kölcsönös hatásától függenek.
Például az ecetsavban a négy hidrogénatom közül csak egy reagál lúggal. Ez alapján feltételezhető, hogy csak egy hidrogénatom kapcsolódik az oxigénhez:
Másrészt az ecetsav szerkezeti képletéből arra lehet következtetni, hogy egy mozgó hidrogénatomot tartalmaz, azaz egybázisú.
A szerkezetelmélet álláspontjának egyetemességének igazolására az anyagok tulajdonságainak a molekulákban lévő atomok kölcsönös befolyásától való függésére vonatkozóan, amely nemcsak a szerves, hanem a szervetlen vegyületekben is létezik, összehasonlítjuk a hidrogénatomok tulajdonságait. nem fémek hidrogénvegyületei. Molekuláris szerkezettel rendelkeznek, és normál körülmények között gázok vagy illékony folyadékok. Attól függően, hogy a nemfém hol helyezkedik el D. I. Mengyelejev periodikus rendszerében, az ilyen vegyületek tulajdonságainak változásában egy minta azonosítható: 
A metán nem lép kölcsönhatásba vízzel. A metán alapvető tulajdonságainak hiányát a szénatom vegyértékképességének telítettsége magyarázza.
Az ammónia alapvető tulajdonságokkal rendelkezik. Molekulája a nitrogénatom magányos elektronpárjához való vonzódásának köszönhetően hidrogéniont képes magához kötni (donor-akceptor kötésképző mechanizmus).
A foszfin PH3-ban az alapvető tulajdonságok gyengén kifejeződnek, ami a foszforatom sugarához kapcsolódik. Sokkal nagyobb, mint a nitrogénatom sugara, ezért a foszforatom gyengébben vonzza magához a hidrogénatomot.
A balról jobbra haladó periódusokban az atommagok töltései nőnek, az atomok sugarai csökkennek, a G + részleges pozitív töltésű hidrogénatom taszító ereje nő, és ezáltal a nemfémek hidrogénvegyületeinek savas tulajdonságai. fokozódnak. 
A fő alcsoportokban az elemek atomi sugarai felülről lefelé növekszenek, az 5-es nemfém atomok az 5+ gyengébb hidrogénatomokat vonzzák, a hidrogénvegyületek erőssége csökken, könnyen disszociálnak, ezért savas tulajdonságaik erősödnek.
A nemfémek hidrogénvegyületeinek eltérő képessége hidrogénkationok eltávolítására vagy hozzáadására az oldatokban azzal magyarázható, hogy a nemfém atomok nem egyenlő hatással vannak a hidrogénatomokra.
Az azonos korú elemek által alkotott hidroxidok molekuláiban az atomok eltérő hatása is magyarázza azok sav-bázis tulajdonságainak változását.
A központi atom oxidációs fokának növekedésével a hidroxidok bázikus tulajdonságai csökkennek, míg a savasoké nőnek, ezért az oxigénatommal való kötésének energiája (8-) és a hidrogénatom taszítása (8+) növeli.
Nátrium-hidroxid NaOH. Mivel a hidrogénatom sugara nagyon kicsi, erősebben vonzza magához az oxigénatomot, és a hidrogén- és oxigénatomok közötti kötés erősebb lesz, mint a nátrium- és oxigénatomok között. Az alumínium-hidroxid Al(OH)3 amfoter tulajdonságokat mutat.
A perklórsav HclO 4-ben a viszonylag nagy pozitív töltésű klóratom erősebben kötődik az oxigénatomhoz, és erősebben taszítja a hidrogénatomot 6+-mal. A disszociáció a sav típusának megfelelően megy végbe.
A kémiai vegyületek szerkezete elméletének fejlesztésének fő irányai és jelentősége
A. M. Butlerov idejében az empirikus (molekuláris) és szerkezeti képleteket széles körben használták a szerves kémiában. Ez utóbbiak a molekulában lévő atomok kapcsolódási sorrendjét tükrözik vegyértékük szerint, amit kötőjelek jelölnek.
A rögzítés megkönnyítése érdekében gyakran használnak rövidített szerkezeti képleteket, amelyekben csak a szén- vagy szén- és oxigénatomok közötti kötéseket jelölik kötőjelekkel.
Rövidített szerkezeti képletek
Majd a kémiai kötés természetére vonatkozó ismeretek fejlődésével és a szerves anyagok molekuláinak elektronszerkezetének tulajdonságaira gyakorolt hatásával elkezdtek olyan elektronikus képleteket alkalmazni, amelyekben a kovalens kötést hagyományosan két ponttal jelölik. Az ilyen képletekben gyakran feltüntetik az elektronpárok elmozdulásának irányát egy molekulában.
Az anyagok elektronikus szerkezete magyarázza a mezomer és az indukciós hatásokat.
Az induktív hatás a gamma kötések elektronpárjainak eltolódása egyik atomról a másikra az eltérő elektronegativitásuk miatt. Jelölve (->).
Egy atom (vagy atomcsoport) indukciós hatása negatív (-/), ha ez az atom nagy elektronegativitású (halogének, oxigén, nitrogén), vonzza a gamma kötés elektronjait és részleges negatív töltést kap. Egy atomnak (vagy atomcsoportnak) pozitív induktív hatása van (+/), ha taszítja a gamma kötések elektronjait. Ezzel a tulajdonsággal rendelkezik néhány korlátozó gyök, C2H5). Emlékezzen Markovnikov szabályára arról, hogy hogyan adnak hidrogént és hidrogén-halogenid halogénjét az alkénekhez (propénhez), és meg fogja érteni, hogy ez a szabály sajátos természetű. Hasonlítsa össze ezt a két példát a reakcióegyenletekre:
[[A kémiai_vegyületek_elmélete_A._M._Butlerov|  ]]
]]
Az egyes anyagok molekuláiban egyszerre mutatkoznak meg az indukciós és a mezomer hatások. Ebben az esetben vagy erősítik egymást (aldehidekben, karbonsavakban), vagy kölcsönösen gyengítik (vinil-kloridban).
A molekulákban lévő atomok kölcsönös befolyásának eredménye az elektronsűrűség újraeloszlása.
A kémiai kötések térbeli irányának gondolatát először J. A. Le Bel francia kémikus és J. X. Van't Hoff holland kémikus fogalmazta meg 1874-ben. A tudósok feltételezéseit a kvantumkémia teljes mértékben megerősítette. Az anyagok tulajdonságait jelentősen befolyásolja molekuláik térbeli szerkezete. Például már megadtuk a butén-2 cisz- és transz-izomereinek képleteit, amelyek tulajdonságaikban különböznek egymástól (lásd 16. ábra).
Az átlagos kötési energia, amelyet az egyik formából a másikba való átmenet során fel kell szakítani, körülbelül 270 kJ/mol; szobahőmérsékleten nincs annyi energia. A butén-2 formák kölcsönös átmenetéhez az egyik kovalens kötést meg kell szakítani, és helyette egy másikat kell létrehozni. Más szavakkal, ez a folyamat egy kémiai reakció példa, és a butén-2 mindkét formája különböző kémiai vegyületek.
Nyilván emlékszel arra, hogy a gumi szintézisének legfontosabb problémája a sztereoreguláris gumi beszerzése volt. Olyan polimert kellett létrehozni, amelyben a szerkezeti egységek szigorú sorrendben helyezkednek el (a természetes gumi például csak cisz-egységekből áll), mert ettől függ a gumi olyan fontos tulajdonsága, mint a rugalmassága.
A modern szerves kémia az izoméria két fő típusát különbözteti meg: szerkezeti (láncizoméria, többszörös kötések helyzetének izomériája, homológ sorozatok izomériája, funkciós csoportok helyzetének izomériája) és sztereoizoméria (geometriai, vagy cisz-transz-izoméria, optikai, vagy tükör, izoméria).
Tehát meggyőződhetett arról, hogy a kémiai szerkezet elméletének második álláspontja, amelyet egyértelműen A. M. Butlerov fogalmazott meg, hiányos volt. Modern szempontból ez a rendelkezés kiegészítést igényel:
az anyagok tulajdonságai nem csak minőségi és mennyiségi összetételüktől függenek, hanem attól is, hogy:
Kémiai,
elektronikus,
Térszerkezet.
A szerves kémia fejlődésében fontos szerepet játszott az anyagok szerkezetének elméletének megalkotása. A túlnyomórészt leíró tudományból kreatív, szintetizáló tudománnyá válik, lehetővé vált az atomok kölcsönös hatásának megítélése a különböző anyagok molekuláiban (lásd 10. táblázat). A szerkezetelmélet megteremtette az előfeltételeket a szerves molekulák különféle izomériáinak, valamint a kémiai reakciók irányainak és mechanizmusainak magyarázatához és előrejelzéséhez.
Ezen elmélet alapján a szerves vegyészek olyan anyagokat hoznak létre, amelyek nemcsak helyettesítik a természeteseket, hanem tulajdonságaikban is jelentősen felülmúlják azokat. Tehát a szintetikus festékek sokkal jobbak és olcsóbbak, mint sok természetes festék, például az ókorban ismert alizarin és indigó. A szintetikus gumikat nagy mennyiségben állítják elő, sokféle tulajdonsággal. A műanyagokat és a rostokat széles körben használják, amelyekből készült termékeket a mérnöki iparban, a mindennapi életben, az orvostudományban és a mezőgazdaságban használják.
A. M. Butlerov kémiai szerkezetelméletének értéke a szerves kémiában összevethető a Periodikus törvény és D. I. Mengyelejev kémiai elemek periódusos rendszerének értékével a szervetlen kémiában. Nem véletlenül van annyi közös mindkét elméletben kialakulásuk módjaiban, fejlődési irányaiban és általános tudományos jelentőségében. Azonban bármely más vezető tudományos elmélet történetében (Ch. Darwin elmélete, genetika, kvantumelmélet stb.) találkozhatunk ilyen közös szakaszokkal.
1. Állítson fel párhuzamot a két vezető kémiaelmélet - a periódusos törvény és a kémiai elemek periódusos rendszere (D. I. Mengyelejev), valamint A. M. Butlerov szerves vegyületek kémiai szerkezetének elmélete között a következő alapokon: általános az előfeltételekben, gyakori a fejlődésük irányai, gyakoriak a prognosztikai szerepekben.
2. Milyen szerepet játszott a kémiai vegyületek szerkezetének elmélete a periódusos törvény kialakulásában?
3. Milyen szervetlen kémia példák igazolják a kémiai vegyületek szerkezetelméletének egyes rendelkezéseinek egyetemességét?
4. A H3PO3 foszforsav kétbázisú savakra utal. Javasolja szerkezeti képletét, és vegye figyelembe az atomok kölcsönös hatását ennek a savnak a molekulájában!
5. Írja fel a С3Н8O összetételű izomereket! Nevezze meg őket a szisztematikus nómenklatúra szerint! Határozza meg az izoméria típusait!
6. A króm(III)-klorid kristályos hidrátjainak a következő képletei ismertek: [Cr(H20)6]Cl3; [Cr(H20)5Cl]Cl2H20; [Cr(H20)4*C12]Cl 2H2O. Hogyan neveznéd ezt a jelenséget?
A szerves vegyületek kémiai szerkezetére vonatkozó elmélet főbb rendelkezéseit A. M. Butlerov kazanyi egyetem professzora fogalmazta meg 1861-ben.
- A molekulák atomjai szigorúan meghatározott sorrendben kapcsolódnak egymáshoz, az elemek vegyértékének megfelelően.
- Az anyagok tulajdonságai nem csak mennyiségi és minőségi összetételüktől függenek, hanem attól is, hogy a molekulákban milyen sorrendben kapcsolódnak egymáshoz az atomok, pl. a kémiai szerkezettől.
- A molekulák atomjai kölcsönösen befolyásolják egymást.
- Az anyagok tulajdonságait a szerkezetük határozza meg, és fordítva, a szerkezet ismeretében meg lehet jósolni a tulajdonságokat.
- Az anyagok kémiai szerkezete kémiai módszerekkel megállapítható.
Az A.M. kémiai szerkezetének elmélete. Butlerov evolúción ment keresztül, melynek legfontosabb irányai a következők:
- Elektronikus elméletek megjelenése a szerves kémiában, amelyek lehetővé tették a szerves anyagok kémiai viselkedésének az elektronszerkezettől való függésének megfogalmazását.
- Sztereokémiai reprezentációk, amelyek meghatározták az anyagok kémiai tulajdonságai és a térszerkezet közötti kapcsolatot.
A szerves vegyületek jellemzőit, sokféleségét elsősorban a szénatom elektronszerkezete határozza meg, amely szerves vegyületekben négy vegyértéket mutat, és lehet sp 3 -, sp 2 - és sp-hibrid állapotú. Ezért az atomok közötti kötést egy, két és három elektronpár végezheti, azaz. lehet egyszeres (σ - kötés), kettős (1σ - kötés és 1π - kötés), hármas (1σ - kötés és 2 π - kötés). A szén kivételes tulajdonsága, hogy képes különböző hosszúságú és ciklikus szerkezetű atomokból láncokat alkotni.
A szerkezetelmélet második pozíciójából következik a homológia és az izoméria jelenléte a szerves anyagokban. Homológ sorozat Szerves vegyületek halmazának nevezzük, amelyek hasonló szerkezettel és tulajdonságokkal rendelkeznek, és összetételükben egy vagy több -CH 2 - csoporttal különböznek egymástól. Ugyanazon homológ sorozat képviselőit ún homológok.
Izomerek- olyan anyagok, amelyek mennyiségi és minőségi összetétele azonos, de a molekulák szerkezetében, és ebből következően tulajdonságaiban is különböznek. Léteznek szerkezeti és térbeli (sztereo-) izoméria. Az első típus az
- a szénváz izomériája (például n-bután és izobután);
- a többszörös kötés helyzetének izomériája a molekulában (például 2-metil-1-butén és 2-metil-2-butén);
- funkciós csoport helyzeti izoméria (pl. 1-klórpropán és 2-klórpropán);
- osztályok közötti izoméria vagy metamerizmus (például butin-1 és butadién-1,3) stb.
A térbeli izomerekben az atomok kötési sorrendje a molekulákban azonos, de térbeli elhelyezkedésük eltérő, ami tulajdonságbeli eltérést okoz. A térbeli geometriai izoméria. Például alkénekben lehetséges.
A szerves vegyületek kémiai szerkezetére vonatkozó elmélet megalkotásának alapja A.M. Butlerov volt az atom- és molekuláris elmélet (A. Avagadro és S. Cannizzaro munkái). Téves lenne azt feltételezni, hogy a világ teremtése előtt semmit sem tudott a szerves anyagokról, és nem történtek kísérletek a szerves vegyületek szerkezetének alátámasztására. 1861-re (amikor A. M. Butlerov megalkotta a szerves vegyületek kémiai szerkezetének elméletét) az ismert szerves vegyületek száma elérte a százezreket, és a szerves kémia, mint önálló tudomány szétválása már 1807-ben megtörtént (J. Berzelius) .
A szerves vegyületek szerkezetének elméletének háttere
A szerves vegyületek széles körű tanulmányozása a 18. században kezdődött A. Lavoisier munkásságával, aki kimutatta, hogy az élő szervezetekből nyert anyagok több elemből állnak - szénből, hidrogénből, oxigénből, nitrogénből, kénből és foszforból. Nagy jelentőséggel bírt a "radikális" és az "izoméria" kifejezések bevezetése, valamint a gyökök elméletének kialakulása (L. Giton de Morvo, A. Lavoisier, J. Liebig, J. Dumas, J. Berzelius) , siker a szerves vegyületek (karbamid, anilin, ecetsav, zsírok, cukorszerű anyagok stb.) szintézisében.
A „kémiai szerkezet” kifejezést, valamint a kémiai szerkezet klasszikus elméletének alapjait először A.M. Butlerov 1861. szeptember 19-én a német természetkutatók és orvosok speyeri kongresszusán tartott jelentésében.
A szerves vegyületek szerkezetének elméletének főbb rendelkezései A.M. Butlerov
1. A szerves anyag molekuláját alkotó atomok meghatározott sorrendben kapcsolódnak egymáshoz, és minden atomból egy vagy több vegyértéket fordítanak az egymáshoz való kötésre. Nincsenek szabad vegyértékek.
Butlerov az atomok kapcsolódási sorrendjét "kémiai szerkezetnek" nevezte. Grafikusan az atomok közötti kötéseket vonal vagy pont jelzi (1. ábra).
Rizs. 1. A metánmolekula kémiai szerkezete: A - szerkezeti képlet, B - elektronképlet
2. A szerves vegyületek tulajdonságai a molekulák kémiai szerkezetétől függenek, azaz. a szerves vegyületek tulajdonságai attól függnek, hogy az atomok milyen sorrendben kapcsolódnak a molekulában. A tulajdonságok tanulmányozásával ábrázolhatja az anyagot.
Vegyünk egy példát: egy anyag bruttó képlete C 2 H 6 O. Ismeretes, hogy amikor ez az anyag kölcsönhatásba lép nátriummal, hidrogén szabadul fel, és ha sav hat rá, víz képződik.
C 2 H 6 O + Na = C 2 H 5 ONa + H 2
C 2 H 6 O + HCl \u003d C 2 H 5 Cl + H 2 O
Ez az anyag két szerkezeti képletnek felelhet meg:
CH3-O-CH3-aceton (dimetil-keton) és CH3-CH2-OH-etil-alkohol (etanol),
az erre az anyagra jellemző kémiai tulajdonságok alapján arra a következtetésre jutottunk, hogy etanol.
Az izomerek olyan anyagok, amelyek minőségi és mennyiségi összetétele azonos, de kémiai szerkezetük eltérő. Az izoméria többféle típusa létezik: szerkezeti (lineáris, elágazó, szénvázas), geometriai (cisz- és transz-izoméria, többszörös kettős kötéssel rendelkező vegyületekre jellemző (2. ábra)), optikai (tükör), sztereó (térbeli, anyagokra jellemző, amelyek különböző módon helyezkedhetnek el a térben (3. ábra)).

Rizs. 2. Példa a geometriai izomériára
3. A szerves vegyületek kémiai tulajdonságait a molekulában található egyéb atomok is befolyásolják. Az ilyen atomcsoportokat funkcionális csoportoknak nevezzük, mivel jelenlétük az anyag molekulájában különleges kémiai tulajdonságokat ad. Például: -OH (hidroxocsoport), -SH (tiocsoport), -CO (karbonilcsoport), -COOH (karboxilcsoport). Ráadásul a szerves anyagok kémiai tulajdonságai kevésbé függnek a szénhidrogén váztól, mint a funkciós csoporttól. A funkciós csoportok adják a szerves vegyületek sokféleségét, amelyek alapján osztályozzák őket (alkoholok, aldehidek, karbonsavak stb. A funkciós csoportok néha szén-szén kötéseket tartalmaznak (több kettős és hármas). Ha több egyforma van funkciós csoportok, akkor homopolifunkcionálisnak (CH 2 (OH) -CH (OH) -CH 2 (OH) - glicerinnek nevezzük), ha több, de eltérő - heteropolifunkcionális (NH 2 -CH (R) -COOH - aminosavak) .

3. ábra. Példa a sztereoizomériára: a - ciklohexán, "szék" forma, b - ciklohexán, "fürdő" forma
4. A szerves vegyületek szén vegyértéke mindig négy.
Az első a 19. század elején jelent meg. a radikálisok elmélete (J. Gay-Lussac, F. Wehler, J. Liebig). A gyököket atomcsoportoknak nevezték, amelyek a kémiai reakciók során változatlan formában jutnak át egyik vegyületből a másikba. Ez a gyökfogalom megmaradt, de a gyökök elméletének legtöbb egyéb rendelkezése tévesnek bizonyult.
A típuselmélet (C. Gerard) szerint minden szerves anyag bizonyos szervetlen anyagoknak megfelelő típusokra osztható. Például az R-OH alkoholokat és az R-O-R étereket a H-OH típusú víz képviselőinek tekintették, amelyekben a hidrogénatomokat gyökök helyettesítik. A típuselmélet létrehozta a szerves anyagok osztályozását, amelynek néhány alapelvét jelenleg is alkalmazzák.
A szerves vegyületek szerkezetének modern elméletét a kiváló orosz tudós, A.M. Butlerov.
1. Egy molekulában az atomok vegyértékük szerint meghatározott sorrendbe rendeződnek. A szerves vegyületek szénatomjának vegyértéke négy.
2. Az anyagok tulajdonságai nemcsak attól függnek, hogy mely atomok és milyen mennyiségben vannak a molekulában, hanem attól is, hogy milyen sorrendben kapcsolódnak egymáshoz.
3. A molekulát alkotó atomok vagy atomcsoportok kölcsönösen befolyásolják egymást, ettől függ a molekulák kémiai aktivitása és reakciókészsége.
4. Az anyagok tulajdonságainak tanulmányozása lehetővé teszi kémiai szerkezetük meghatározását.
A molekulákban lévő szomszédos atomok kölcsönös hatása a szerves vegyületek legfontosabb tulajdonsága. Ez a hatás vagy egyszeres kötések láncán, vagy konjugált (váltakozó) egyszeres és kettős kötések láncán keresztül közvetítődik.
A szerves vegyületek osztályozása a molekulák szerkezetének két aspektusának – a szénváz szerkezetének és a funkciós csoportok jelenlétének – elemzésén alapul.