- (їдке калі, КОН), біла тверда речовина, що отримується в промисловості шляхом ЕЛЕКТРОЛІЗУ ХЛОРИДУ КАЛІЮ. Гідроксид калію є сильно лужною речовиною, що використовується у виробництві мила та миючих засобів. див. також луг … Науково-технічний енциклопедичний словник
Сущ., Кількість синонімів: 1 калі (8) Словник синонімів ASIS. В.М. Тришин. 2013 … Словник синонімів
гідроксид калію- їдке калі - [А.С.Гольдберг. Англо-російський енергетичний словник. 2006 р.] Тематики енергетика в цілому Синоніми їдке калі EN potassium hydroxide … Довідник технічного перекладача
ГІДРОКСІД КАЛІЮ- їдке калі, КОН безбарвні кристали; щільністю 2120 кг/м3; tпл = 380 ° С; розчинність у воді 52,8% при 20 ° С. Сильна луг, що викликає опіки на шкірі людини. Застосовують у вигляді киплячого 30 50% ного водного розчину для очищення від ... Металургійний словник
Гідроксид калію (їдке калі)- Гідроксид калію зазвичай одержують електролізом розчинів природного хлориду калію (товарна позиція 3104), але він може бути отриманий також каустифікацією карбонату калію вапняним молоком (утворюючим вапняний поташ). Чистий гідроксид калію. Офіційна термінологія
Гідроксид калію Загальні Систематичне найменування Гідроксид калію Традиційні назви … Вікіпедія
Гідроксид алюмінію, речовина з формулою (а також … Вікіпедія
Загальні Систематичне найменування Гідроксид рубідія Традиційні назви їдка луг їдкий рубає Хімічна формула RbOH Фізичні властивості Молярна маса 102,407 … Вікіпедія
Хімічні властивості
- Взаємодія з кислотами з утворенням солі та води (Реакція нейтралізації):
texvcНЕ знайдений; Math/README - довідку з налаштування.): \mathsf(KOH + HCl \longrightarrow KCl + H_2O)
Неможливо розібрати вираз (виконуваний файл texvcНЕ знайдений; Math/README - довідку з налаштування.): \mathsf(2KOH + H_2SO_4 \longrightarrow \ K_2SO_4 + 2H_2O)
- Взаємодія з кислотними оксидами з утворенням солі та води:
texvcНЕ знайдений; Math/README - довідку з налаштування.): \mathsf(2KOH + CO_2 \longrightarrow \ K_2CO_3 + H_2O)
Неможливо розібрати вираз (виконуваний файл texvcНЕ знайдений; Math/README - довідку з налаштування.): \mathsf(2KOH + SO_3 \longrightarrow \ K_2SO_4 + H_2O)
- Взаємодія з деякими неперехідними металами в розчині з утворенням комплексної солі та водню:
texvcНЕ знайдений; Math/README - довідку з налаштування.): \mathsf(2Al + 2KOH + 6H_2O \longrightarrow 2K + 3H_2 \uparrow)
Також гідроксид калію отримують електролізом розчинів KCl, зазвичай із застосуванням, що дає продукт високої чистоти, що не містить домішки хлоридів:
Неможливо розібрати вираз (виконуваний файлtexvcНЕ знайдений; Math/README - довідку з налаштування.): \mathsf(2KCl + 2H_2O \longrightarrow 2KOH + H_2 \uparrow + Cl_2 \uparrow )
Застосування
Гідроксид калію є практично універсальною хімічною сполукою. Нижче наведено приклади матеріалів та процеси в яких він використовується:
Також використовується для отримання метану, поглинання кислотних газів та виявлення деяких катіонів у розчинах.
Популярний засіб у виробництві косметичної продукції, вступаючи в реакцію з жирними оліями, розщеплюється і омилює при цьому масла.
У цирконієвому виробництві використовується для отримання обесфторенного гідроксиду цирконію.
Виробництво
У промисловому масштабі гідроксид калію одержують електролізом хлористого калію.
Можливі три варіанти проведення електролізу:
- електроліз з твердим азбестовим катодом (діафрагмовий метод виробництва),
- електроліз з полімерним катодом (мембранний метод виробництва),
- електроліз із рідким ртутним катодом (ртутний метод виробництва).
У ряді електрохімічних методів виробництва найлегшим та зручним способом є електроліз з ртутним катодом, але цей метод завдає значної шкоди навколишньому середовищу внаслідок випаровування та витоків металевої ртуті. Мембранний метод виробництва найефективніший, але найскладніший.
У той час як діафрагмовий та ртутний методи були відомі відповідно з 1885 та 1892 рр., мембранний метод з'явився порівняно недавно – у 1970 р.р.
Основною тенденцією у світовому виробництві гідроксиду калію в останні 10 років є перехід виробників на мембранний метод електролізу. Ртутний електроліз є застарілою, економічно невигідною технологією, що негативно діє на навколишнє середовище. Мембранний електроліз повністю виключає використання. Екологічна безпека мембранного методу полягає в тому, що стічні води після очищення знову подаються в технологічний цикл, а не скидаються в каналізацію.
З використанням цього методу вирішуються такі задачи:
- виключається стадія зрідження та випаровування хлору,
- водень використовується для технологічної пари, виключаються газові викиди хлору та його сполук.
Світовим лідером у галузі мембранних технологій є японська компанія «Асахі Касей».
У Росії виробництво гідроксиду калію здійснюється ртутним (ЗП КЧХК) та діафрагмовим (Сода-Хлорат) методами.
Особливістю технологічного оформлення виробництва гідроксиду калію є той факт, що на аналогічних установках електролізу можна випускати як їдке калі, так і каустичну соду. Це дозволяє виробникам без істотних капіталовкладень переходити виробництва гідроксиду калію замість каустичної соди, виробництво якої менш рентабельно, а збут останніми роками ускладнюється. При цьому у разі змін на ринку можливий безболісний переведення електролізерів на виробництво продукту, що раніше випускався.
Прикладом переведення частини потужностей із виробництва гідроксиду натрію на гідроксид калію може бути ВАТ «Завод полімерів КЧХК», який розпочав промисловий випуск їдкого калію на п'яти електролізерах у 2007 році.
Небезпека
Уривок, що характеризує гідроксид калію
Пролунав стукіт у двері - на порозі стояв Караффа...— Як вам здавалося, люба Ізидоро? Сподіваюся, близькість вашої дочки не завдала клопоту вашому сну?
– Дякую за турботу, ваша святість! Я спала напрочуд чудово! Мабуть, саме близькість Анни мене заспокоїла. Чи зможу сьогодні поспілкуватися зі своєю дочкою?
Він був сяючим і свіжим, ніби мене вже зламав, ніби вже втілилася в життя його найбільша мрія... Я ненавиділа його впевненість у собі та своїй перемозі! Навіть якщо він мав для цього всі підстави… Навіть якщо я знала, що дуже скоро, з волі цього божевільного Папи, піду назавжди… Я не збиралася йому так просто здаватися – я хотіла боротися. До останнього мого зітхання, до останньої хвилини, відпущеної мені на Землі...
- То що ж ви вирішили, Ізідоро? – весело спитав Папа. - Як я вже казав вам раніше, саме від цього залежить, коли ви побачите Ганну. Я сподіваюся, ви не змусите мене вживати найжорстокіших заходів? Ваша дочка варта того, щоб її життя не обірвалося так рано, чи не так? Вона і справді дуже талановита, Ізідоро. І мені щиро не хотілося б завдавати їй зла.
- Я думала, ви знаєте мене досить давно, ваша святість, щоб зрозуміти - погрози не змінять мого рішення... Навіть найстрашніші. Я можу померти, не витримавши болю. Але я ніколи не зраджу те, для чого живу. Вибачте мені, святе.
Караффа дивився на мене на всі очі, ніби почув щось не зовсім розумне, що дуже здивувало його.
- І ви не пошкодуєте свою прекрасну дочку?! Та ви більш фанатичні, ніж я, мадонно!
Вигукнувши це, Караффа різко підвівся і пішов. А я сиділа, зовсім оніміла. Не відчуваючи свого серця, і не в змозі втримати думки, що розбігалися, ніби всі мої сили, що залишилися, пішли на цю коротку негативну відповідь.
Я знала, що то кінець... Що тепер він візьметься за Ганну. І не була впевнена, чи зможу вижити, щоби все це перенести. Не було сил думати про помсту... Не було сил думати взагалі ні про що... Моє тіло втомилося, і не хотіло більше чинити опір. Мабуть, це і була межа, після якої вже наступало «інше» життя.
Я шалено хотіла побачити Ганну!.. Обійняти її хоча б раз на прощання!
І тут, обернувшись на шум біля дверей, я її побачила! Моя дівчинка стояла пряма й горда, як негнучка тростинка, яку намагається зламати ураган, що насувається.
– Що ж, поговоріть із дочкою, Ізидоро. Може, вона зможе внести хоч якийсь здоровий глузд у вашу свідомість, що заблукала! Я даю вам на зустріч одну годину. І постарайтеся взятися за розум, Ізидоро. Інакше ця зустріч буде для вас останньою.
Караффа не хотів більше грати. На терези було поставлено його життя. Так само, як і життя моєї милої Анни. І якщо друга для нього не мала жодного значення, то за першу (за свою) він був готовий піти на все.
- Мамочко!.. - Ганна стояла біля дверей, не в змозі поворухнутися. - Мамо, люба, як же ми його знищимо?.. Не зуміємо ж, матусю!
Схопившись зі стільця, я підбігла до мого єдиного скарбу, моєї дівчинки і, схопивши обійми, стиснула що було сил...
– Ой, мамо, ти мене так задушиш!.. – дзвінко засміялася Ганна.
А моя душа вбирала цей сміх, як засуджений до смерті вбирає тепле прощальне проміння вже сонця, що вже заходить...
— Ну що ти, матусю, ми ж ще живі!.. Ми ще можемо боротися!.. Ти ж мені сама казала, що боротимешся, поки жива... От і давай думати, чи можемо ми щось зробити. . Чи можемо ми позбавити світ цього Зла.
Вона знову мене підтримувала своєю відвагою!.. Знову знаходила правильні слова...
Ця мила хоробри дівчинка, майже дитина, не могла навіть уявити собі, яким тортурам міг піддати її Караффа! У якому звірячому болю могла потонути її душа... Але я знала... Я знала все, що її чекало, якщо я не піду йому назустріч. Якщо не погоджуся дати Папі те єдине, що він хотів.
- Добра моя, серце моє... Я не зможу дивитися на твої муки... Я тебе не віддам йому, моя дівчинко! Півночі і йому подібних, не хвилює, хто залишиться в цьому ЖИТТІ... То чому ж ми маємо бути іншими?.. Чому нас з тобою має хвилювати чиясь інша, чужа доля?!.
Я сама злякалася своїх слів... хоча в душі чудово розуміла, що вони викликані лише безвихіддю нашого становища. І, звичайно, я не збиралася зраджувати те, заради чого жила... Заради чого загинув мій батько і бідний мій Джироламо. Просто всього на мить захотілося повірити, що ми можемо ось так взяти і піти з цього страшного, «чорного» караффського світу, забувши про все... забувши про інших, незнайомих нам людей. Забувши про зло...
Це була хвилинна слабкість втомленої людини, але я розуміла, що не мала права допускати її навіть. І тут, в довершенні всього, мабуть, не витримавши більше насильства, пекучі злі сльози струмком полилися по моєму обличчю... А я ж так намагалася цього не допускати! змучена болем душа...
Ганна сумно дивилася на мене своїми величезними сірими очима, в яких жила глибока, зовсім не дитяча печаль... Вона тихо гладила мої руки, ніби бажаючи заспокоїти. А моє серце криком кричало, не бажаючи упокорюватися... Не бажаючи її втрачати. Вона була єдиним сенсом мого невдалого життя. І я не могла дозволити нелюди, який звався римським Папою, її в мене відібрати!
- Мамо, не хвилюйся за мене - як би прочитавши мої думки, прошепотіла Ганна. – Я не боюся болю. Але навіть якщо це буде дуже боляче, дідусь обіцяв мене забрати. Я розмовляла з ним учора. Він чекатиме на мене, якщо нам з тобою не вдасться... І тато теж. Вони обоє чекатимуть мене там. Ось тільки тебе залишати буде дуже боляче ... Я так люблю тебе, матусю!
Ганна сховалась у моїх обіймах, ніби шукаючи захисту... А я не могла її захистити... Не могла врятувати. Я не знайшла «ключа» до Караффи...
- Вибач мені, сонечко моє, я підвела тебе. Я підвела нас обох... Я не знайшла шляху, щоб знищити його. Пробач мені, Ганнусю...
Година пройшла непомітно. Ми говорили про різне, не повертаючись більше до вбивства Папи, бо обидві чудово знали – на сьогоднішній день ми програли... І не мало значення, чого ми бажали... Караффа жив, і це було найстрашніше і найголовніше. Нам не вдалося звільнити наш світ. Не вдалося врятувати добрих людей. Він жив, незважаючи на жодні спроби, ні на які бажання. Незважаючи ні на що...
- Тільки не здавайся йому, мамо!.. Прошу тебе, тільки не здавайся! Я знаю, як тобі тяжко. Але ми всі будемо з тобою. Він не має права жити довго! Він убивця! І навіть якщо ти погодишся дати йому те, що він хоче – він все одно знищить нас. Не погоджуйся, мамо!
Двері відчинилися, на порозі знову стояв Караффа. Але тепер він здавався чимось незадоволеним. І я приблизно могла припустити - чим... Караффа більше не був упевнений у своїй перемозі. Це турбувало його, оскільки залишався в нього тільки цей останній шанс.
- Отже, що ж ви вирішили, мадонно?
Я зібрала всю свою мужність, щоб не показати, як тремтить мій голос, і зовсім спокійно промовила:
– Я вже стільки разів відповідала вам на це запитання, святе! Що ж могло змінитись за такий короткий час?
Приходило відчуття непритомності, але, подивившись у сяючі гордістю очі Анни, все погане раптом кудись зникло ... Яка ж світла і красива була в цей страшний момент моя дочка!
- Ви збожеволіли, мадонно! Невже ви зможете так просто послати свою дочку в підвал?.. Адже ви чудово знаєте, що її там чекає! Схаменіться, Ізидоро!..
Раптом, Ганна впритул підійшла до Караффи і дзвінким ясним голосом промовила:
- Ти не суддя і не Бог!.. Ти всього лише - грішник! Тому й палить Перстень грішників твої брудні пальці! Ти не злякаєш мене, Карафе. І моя мати ніколи не підкориться тобі!
Анна випросталась і... плюнула Папі в обличчя. Караффа смертельно зблід. Я ніколи не бачила, щоб хтось бліднув так швидко! Його обличчя буквально в секунду стало попелясто-сірим... а в його пекучих темних очах спалахнула смерть. Все ще стоячи в «правці» від несподіваної поведінки Ганни, я раптом все зрозуміла – вона навмисне провокувала Караффу, щоб не тягнути!.. Щоб швидше щось вирішити і не мучити мене. Щоб самій піти на смерть... Мою душу скрутило болем - Ганна нагадала мені дівчинку Даміану... Вона вирішувала свою долю... а я нічим не могла допомогти. Не могла втрутитися.
Калію гідроксид (якщо їдке, харчова добавка Е525, гідроксид калію, калію гідрат окису, каустичний поташ)- їдкий луг широкого спектра застосування.
Фізико-хімічні властивості.
Гідроксид калію KOH – безбарвна кристалічна речовина без запаху. Температура плавлення 380 °С. Температура кипіння становить 1320°С. Щільність 2,12 г/см3. Сильно гігроскопічний, на повітрі кристали розпливаються внаслідок поглинання вологи. Розкладає матеріали органічного походження, водні розчини кородують скло, розплави – порцеляну, платину; концентровані розчини викликають важкі опіки шкіри та слизових оболонок.

Застосування.
Гідроксид калію є практично універсальною хімічною сполукою. Нижче наведено приклади матеріалів та процеси в яких він використовується:
- нейтралізація кислот,
- алкалінові батареї,
- Каталіз,
- миючі засоби,
- бурові розчини,
- барвники,
- Добрива,
- Виробництво харчових продуктів,
- газоочищення,
- металургійне виробництво,
- перегонка нафти,
- різні органічні та неорганічні речовини,
- Виробництво паперу,
- пестициди,
- фармацевтика,
- Регулювання pH,
- карбонат калію та інші калійні сполуки,
- Мила,
- Синтетичний каучук.
Одна з найважливіших областей застосування гідроксиду калію – виробництво м'якого мила. Суміші калієвих та натрієвих мил використовуються для отримання рідких мил, миючих засобів, шампунів, кремів для гоління, відбілювачів та деяких фармацевтичних препаратів. Інша важлива сфера застосування - виробництво різних солей калію. Наприклад, перманганат калію отримують шляхом сплавлення діоксиду марганцю з каустичним поташом і подальшого окислення манганату калію, що утворився, в електролізній камері. Дихромат калію можна отримати аналогічним способом, хоча частіше його виготовляють сплавленням тонко подрібненої хромітної руди з карбонатом або гідроксидом калію і впливом на хромат отриманий кислотою з утворенням дихромату калію. Гідроксид калію також застосовують разом з каустичною содою у виробництві багатьох барвників та інших органічних сполук, а також як адсорбент газів, дегідратуючий агент, осаджувач нерозчинних гідроксидів металів у лужних акумуляторах для отримання різних сполук калію.
Крім того, гідроксид калію використовується для знезараження стічних вод, азотної промисловості для осушення газів, гумовотехнічної промисловості в якості «калійного мила», що запобігає злипання крихти каучуку та ін.
Рідкий технічний гідроксид калію застосовується при виробництві добрив, синтетичного каучуку, електролітів, реактивів у медичній промисловості.
Лускований гідроксид калію використовується у виробництві добрив та синтетичного каучуку, у фармацевтичній промисловості та в інших галузях.
Гідроокис калію технічний застосовується для вилуговування виливків сталевого лиття, підтримки в заданих межах лужності бурових розчинів, виробництва добрив, синтетичного каучуку та інших галузях.
Регулятор кислотності Е525 дозволений у продуктах з какао та шоколаду в кількості до 70 г/кг від сухої знежиреної речовини, також Е525 використовується як каталізатор переретерифікації гліцерином рафінованих жирів та саломасів з бавовняної чи соняшникової олії: дозування каталізатора 0,3% від маси жиру.

Рідкі комплексні гумінові добрива містять легкорозчинні солі гумінових кислот – гумати натрію, калію та амонію. Вони є фізіологічно активними формами гумінових кислот, дія яких полягає у підвищенні активності ферментів, швидкості фізіологічних та біохімічних процесів, а також у стимулюванні процесів дихання, синтезу білків та вуглеводів у рослин.
Поряд з цим, вони активізують розвиток кореневої системи рослин, покращують надходження поживних речовин та мікроелементів із ґрунтового розчину в рослину. Це сприяє підвищенню коефіцієнта використання мінеральних добрив, що дозволяє скоротити дози азотних добрив на 30–50% та заощадити значні кошти.
Нині такі добрива отримують переважно з торфу.
Гумінові кислоти практично не розчиняються у воді та мінеральних кислотах. Для отримання рідкого комплексного добрива використовують обробку торфу в 0,1 моль/л розчині калію гідрокису при температурі 100 °З інтенсивному механічному перемішуванні. Потім розчин гуматів відокремлюють від твердої фази фільтруванням із застосуванням металевої сітки та капронової тканини.

Пектин (харчова добавка Е440) - очищений полісахарид, який використовується у виробництві начинок кондитерських виробів (цукерок, зефір, пастила, мармелад, морозиво) та багатьох інших продуктів: спредів, майонезу, кетчупу, соків.
У нашій країні поширений буряковий пектин.
Як гідролізуючих агентів у виробництві пектину можуть використовуватися азотна, сірчана, соляні кислоти або калію гідроксид. З усіх можливих гідролізуючих агентів калію гідроксиду має найбільш м'яку дію - найменше знижує ступінь етерифікації та деструкції молекул пектину.
При використанні 0,1 моль/л гідроксиду калію ступінь етерифікації знижується з 93,8 до 85,2%. При збільшенні концентрації гідроксиду калію до 0,5 та 1,0 моль/л ступінь етерифікації знижується до 40,6 та 11,9 % відповідно.

Стеаринові емульсії входять до складу різноманітних косметичних продуктів. Основну масу косметичних засобів складають емульсійні системи.
Емульсії складаються з трьох компонентів:
1) дистильована вода;
2) стеарин, який є сумішшю пальмітинової і стеаринової кислот при співвідношенні 60: 40. Ці кислоти входять до складу практично всіх тригліцеридів рослинних олій і тваринних жирів.
3) емульгатор.
Механізм емульгування зводиться до наступного. Великі сферичні краплі при механічному впливі деформуються в краплі-циліндрики або частинки іншої форми залежно від співвідношення в'язкості дисперсної фази та дисперсійного середовища. Краплі-циліндрики мимоволі (при певному співвідношенні довжини та діаметру) дробляться при перемішуванні системи на дрібніші краплі. Процес дроблення повторюється доти, доки розміри крапель не становитимуть 10–100 мкм. Такий розмір крапель не забезпечує стійкість системи, тому в систему необхідно вводити третій компонент - емульгатор, який гарантує стабільність емульсії та підвищує ефективність процесу емульгування.
При використанні емульгатора калію гідроксиду спосіб механічного диспергування передбачає окреме нагрівання як водної, так і масляної фаз до певної температури, при якій здійснюється їх змішування.
Приготування емульсії виробляють наступної послідовності. Необхідну кількість стеарину розплавляють за температури 70–75°С. Окремо підігрівають до цієї температури водний розчин гідроксиду калію. Масляну фазу поміщають на водяну баню з мішалкою і при перемішуванні додають повільно водну фазу (швидкість обертання мішалки 250-300 об/хв). Потім емульсію охолоджують до 60°З здійснюють її емульгування протягом 5 хв при швидкості обертання мішалки 1200 об/хв. Після цього емульсію охолоджують до температури 35-40 ° С при перемішуванні зі швидкістю обертання 250-300 об/хв.
Найбільш стійкими та однорідними є емульсії з витратою гідроксиду калію від 0,08 до 0,12 г/г стеарину. Такі емульсії добре розподіляються по шкірі та вбираються у неї. Мають значення рН, близьке до нейтрального.
При витраті гідроксиду калію менше 0,06 г/г стеарину спостерігається значна кількість твердоподібних включень, а емульсії з витратою калію гідроксиду більше 1,6 г/г стеарину - є мало однорідними і мильними на дотик.
Застосування калію гідроксиду для одержання бетуліну.

Бетулін - органічна речовина, що володіє антисептичними, антивірусними (вірус Герпесу та Епштейн-Барра), протизапальними, гепатопротекторними, антиоксидантними властивостями. А також є інгібітором росту ракових клітин.
Бетулін навчають із берести берези. Використовується проти тих самих захворювань, при яких призначають берестовий дьоготь та березову кору.
Для отримання бітуліну високого ступеня чистоти (96,7-99,0%) та високим виходом (близько 38%) у бак із зворотним холодильником, об'ємом 2000 л завантажують 50 кг повітряно-сухої берести берези, додають 1500 л етилового спирту (конц. 96-%) та розчин гідрокісу калію (90 кг гідрокісу калію розчинені у 350 л води). Після кип'ятіння протягом 8 годин масу відфільтровують. Дають розчину відстояться 12 годин. Бетулін опускається в осад. Цей осад відокремлюють та висушують при температурі 20 °С.
Етиловий спирт регенерують способом перегонки при атмосферному тиску.

Калію перманганат KMnO4 (марганцівка) - сильний окислювач, який використовується у фармакології та піротехніці.
Існує безліч способів отримання калію перманганату, але промисловий спосіб один - двостадійний електрохімічний. У цьому технологічному способі використовується гідроксид калію.
На першій стадії піролюзит змішують з гідроксидом калію і піддають сплаву в прокатувальних котлах, реакція протікає за рівнянням 2MnO 2 + O 2 + 4KOH = 2K 2 MnO 4 + 2H 2 O.
Тонко розмелений у кульовому млині високосортний піролюзит і 50%-й розчин KОН сплавляють при 473…543 К. При більш високих температурах (748…1233 К) манганат (VI) руйнується до манганату (V) калію з виділенням кисню K2 4 = 2K 3 MnO 4 + MnO 2 + O 2
і частина реакції 2K 2 MnO 4 = 2K 2 MnO 3 + O 2 .
Вихід манганату вбирається у 60 %. Склад плава: 30–35 % До 2 МnО 4 , 25 % KОН, багато МnО 2 , крім того є карбонат калію та інші домішки.
На другій стадії плав вилуговують і отриманий розчин електролізу.
Сумарне рівняння 2K 2 MnO 4 + 2H 2 O = 2KMnO 4 + 2KOH + H2.
Електроліз лужного розчину манганату виробляється у ваннах, що являють собою залізні циліндри з конічним днищем, яким укладений змійовик (для обігріву та охолодження). У ванні є мішалка та спускний кран. Залізні аноди як концентричних циліндрів розташовані з відривом 100 мм друг від друга (застосовують також нікелеві аноди). Між анодами розміщуються залізні катоди – стрижні діаметром 20...25 мм. Сумарна поверхня катодів у 10 разів менша за поверхню анодів. При електролізі струм підтримується так, щоб анодна щільність струму становила 60-70 А/м 2 ; катодна щільність струму 700 А/м2. Анодні та катодні пластини спираються на скляні та порцелянові ізолятори.
Діаметр ванни 1,3…1,4 м, висота циліндричної частини 0,7…0,8 м, конічної – 0,5 м. У ванну міститься 900…1000 дм 3 розчину електроліту. Електроліз проводять при 333 К. На початку електролізу напруга 2,7, струм 1400 ... 1600 А; в кінці електролізу 3В, а струм падає. Ванни працюють серіями по кілька штук. Число ванн визначається характеристикою джерела (генератора) постійного струму, що живить їх. Витрата енергії на 1 т KМnО 4 становить 700 кВт · год.
Отримання.
У промисловому масштабі гідроксид калію одержують електролізом хлористого калію. Можливі три варіанти проведення електролізу: електроліз із твердим азбестовим або полімерним катодом (діафрагмовий та мембранний методи виробництва), електроліз із рідким ртутним катодом (ртутний метод виробництва). У ряді електрохімічних методів виробництва найлегшим та зручним способом є електроліз з ртутним катодом, але цей метод завдає значної шкоди навколишньому середовищу внаслідок випаровування та витоків металевої ртуті. Мембранний метод виробництва найефективніший, але найскладніший. У той час як діафрагмовий та ртутний методи були відомі відповідно з 1885 та 1892 рр., мембранний метод з'явився порівняно недавно – у 1970 р.р.
Основною тенденцією у світовому виробництві гідроксиду калію в останні 10 років є перехід виробників на мембранний метод електролізу. Ртутний електроліз є застарілою, економічно невигідною технологією, що негативно діє на навколишнє середовище. Мембранний електроліз повністю виключає застосування ртуті. Екологічна безпека мембранного методу полягає в тому, що стічні води після очищення знову подаються до технологічного циклу, а не скидаються в каналізацію. При використанні цього методу вирішуються такі завдання: виключається стадія зрідження та випаровування хлору, водень використовується для технологічної пари, виключаються газові викиди хлору та його сполук. Світовим лідером у галузі мембранних технологій є японська компанія «Асахі Касей».
У Росії виробництво гідроксиду калію здійснюється ртутним (ЗП КЧХК) та діафрагмовим (Сода-Хлорат) методами.
Особливістю технологічного оформлення виробництва гідроксиду калію є той факт, що на аналогічних установках електролізу можна випускати як їдкий калій, так і соду каустичну. Це дозволяє виробникам без істотних капіталовкладень переходити виробництва гідроксиду калію замість каустичної соди, виробництво якої менш рентабельно, а збут останніми роками ускладнюється. При цьому у разі змін на ринку можливий безболісний переведення електролізерів на виробництво продукту, що випускався раніше.
Прикладом переведення частини потужностей із виробництва гідроксиду натрію на гідроксид калію може бути ВАТ «Завод полімерів КЧХК», який розпочав промисловий випуск їдкого калію на п'яти електролізерах у 2007 році.
У промисловості гідроксид калію одержують електролізом хлористого калію. Особливістю технологічного оформлення виробництва гідроксиду калію є той факт, що на аналогічних установках електролізу можна випускати як їдкий калій, так і соду каустичну. Це дозволяє виробникам без істотних капіталовкладень переходити виробництва гідроксиду калію замість каустичної соди, виробництво якої менш рентабельно, а збут останніми роками ускладнюється. При цьому у разі змін на ринку можливий безболісний переведення електролізерів на виробництво продукту, що випускався раніше.
ГІДРОКСІД КАЛІЮ: властивості та застосування
Гідроксид калію (лат. Potassium hydroxide, "калієвий щілинок") - KOH. Тривіальні назви: їдке калі, каустичний поташ, а також гідрат окису калію, гідроксид калію, гідроксид калію, їдкий калі, калієвий луг.
Властивості гідроксиду калію
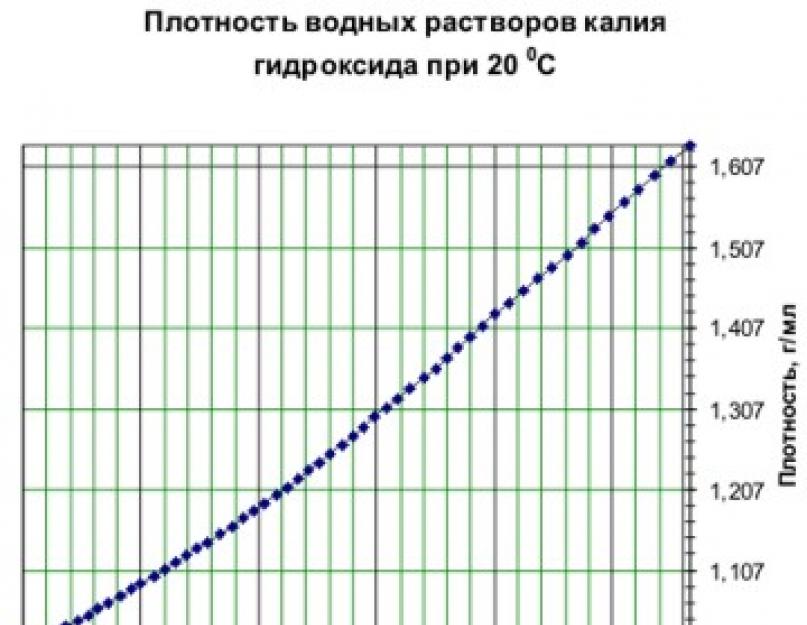
Безбарвні, дуже гігроскопічні кристали. Водні розчини КОН мають сильнолужну реакцію. Гідрат окису калію (якщо їдке) одержують діафрагмовим електролізом розчину хлористого калію. Фізичні константи: Mr = 56,11, r = 2,04 г/см3, tпл = 404 °C, tкіп = 1324 °C
Гідроксид калію продається у вигляді масивних блоків, пластівеподібної маси, гранул або невеликих шматків, а також 40-50% розчинів. Сполуки калію менш поширені і тому дорожчі, ніж відповідні сполуки натрію. Вони застосовуються лише у випадках, коли необхідний властивий їм комплекс фізико-хімічних властивостей, не забезпечується сполуками натрію.
Гідрат окису калію негорючий та вибухобезпечний, за ступенем впливу на організм відноситься до речовин 2-го класу. Їдка речовина, при попаданні на шкіру та слизові оболонки, особливо очі, викликає важкі хімічні опіки та хронічні захворювання шкірних покривів. Особливо небезпечне попадання у вічі.
Розчин гідрату окису калію заливають у чисті сталеві контейнери або бочки місткістю 100, 200 та 275 л. Твердий гідрат окису калію пакують у чисті сухі сталеві барабани місткістю 50-180 дм³. Продукт у вигляді лусочок допускається упаковувати в сталеві барабани місткістю 50-180 дм з поліетиленовими вкладишами або в поліетиленові мішки.
У Росії її технічний гідрат окису калію випускають по ГОСТ 9285-78, хімічно чистий продукт випускається згідно з ГОСТ 24363-80. Іноземному продукту відповідає CAS 1310-58-3.
Нижче наведено технічні характеристики рідкого та лускованого гідроксиду калію російського виробництва, а також характеристики імпортного продукту.
Основні галузі споживання
Гідроксид калію є практично універсальною хімічною сполукою. Нижче наведено приклади матеріалів та процеси в яких він використовується:
- нейтралізація кислот,
- алкалінові батареї,
- Каталіз,
- миючі засоби,
- бурові розчини,
- барвники,
- Добрива,
- Виробництво харчових продуктів,
- газоочищення,
- металургійне виробництво,
- перегонка нафти,
- різні органічні та неорганічні речовини,
- Виробництво паперу,
- пестициди,
- фармацевтика,
- Регулювання pH,
- карбонат калію та інші калійні сполуки,
- Мила,
- Синтетичний каучук.
Одна з найважливіших областей застосування гідроксиду калію – виробництво м'якого мила. Суміші калієвих та натрієвих мил використовуються для отримання рідких мил, миючих засобів, шампунів, кремів для гоління, відбілювачів та деяких фармацевтичних препаратів. Інша важлива сфера застосування-виробництво різних солей калію. Наприклад, перманганат калію отримують шляхом сплавлення діоксиду марганцю з каустичним поташом і подальшого окислення манганату калію, що утворився, в електролізній камері. Дихромат калію можна отримати аналогічним способом, хоча частіше його виготовляють сплавленням тонко подрібненої хромітної руди з карбонатом або гідроксидом калію і впливом на хромат отриманий кислотою з утворенням дихромату калію. Гідроксид калію також застосовують разом з каустичною содою у виробництві багатьох барвників та інших органічних сполук, а також як адсорбент газів, дегідратуючий агент, осаджувач нерозчинних гідроксидів металів у лужних акумуляторах для отримання різних сполук калію.
Крім того, гідроксид калію використовується для знезараження стічних вод, азотної промисловості для осушення газів, гумовотехнічної промисловості в якості «калійного мила», що запобігає злипання крихти каучуку та ін.
Рідкий технічний гідроксид калію застосовується при виробництві добрив, синтетичного каучуку, електролітів, реактивів у медичній промисловості.
Лускований гідроксид калію використовується у виробництві добрив та синтетичного каучуку, у фармацевтичній промисловості та в інших галузях.
Гідроокис калію технічний застосовується для вилуговування виливків сталевого лиття, підтримки в заданих межах лужності бурових розчинів, виробництва добрив, синтетичного каучуку та інших галузях.
Особливості та тенденції технологій виробництва
У промисловому масштабі гідроксид калію одержують електролізом хлористого калію. Можливі три варіанти проведення електролізу: електроліз із твердим азбестовим або полімерним катодом (діафрагмовий та мембранний методи виробництва), електроліз із рідким ртутним катодом (ртутний метод виробництва). У ряді електрохімічних методів виробництва найлегшим та зручним способом є електроліз з ртутним катодом, але цей метод завдає значної шкоди навколишньому середовищу внаслідок випаровування та витоків металевої ртуті. Мембранний метод виробництва найефективніший, але найскладніший. У той час як діафрагмовий та ртутний методи були відомі відповідно з 1885 та 1892 рр., мембранний метод з'явився порівняно недавно – у 1970 р.р.
Основною тенденцією у світовому виробництві гідроксиду калію в останні 10 років є перехід виробників на мембранний метод електролізу. Ртутний електроліз є застарілою, економічно невигідною технологією, що негативно діє на навколишнє середовище. Мембранний електроліз повністю виключає використання ртуті. Екологічна безпека мембранного методу полягає в тому, що стічні води після очищення знову подаються до технологічного циклу, а не скидаються в каналізацію. При використанні цього методу вирішуються такі завдання: виключається стадія зрідження та випаровування хлору, водень використовується для технологічної пари, виключаються газові викиди хлору та його сполук. Світовим лідером у галузі мембранних технологій є японська компанія «Асахі Касей».
У Росії виробництво гідроксиду калію здійснюється ртутним (ЗП КЧХК) та діафрагмовим (Сода-Хлорат) методами.
Особливістю технологічного оформлення виробництва гідроксиду калію є той факт, що на аналогічних установках електролізу можна випускати як їдкий калій, так і соду каустичну. Це дозволяє виробникам без істотних капіталовкладень переходити виробництва гідроксиду калію замість каустичної соди, виробництво якої менш рентабельно, а збут останніми роками ускладнюється. При цьому у разі змін на ринку можливий безболісний переведення електролізерів на виробництво продукту, що випускався раніше.
Прикладом переведення частини потужностей із виробництва гідроксиду натрію на гідроксид калію може бути ВАТ «Завод полімерів КЧХК», який розпочав промисловий випуск їдкого калію на п'яти електролізерах у 2007 році.
Гідроксид калію є речовиною у формі кристалів, що не має ні запаху, ні кольору. У сфері хімічної промисловості є кілька назв харчової добавки Е525, які вважаються рівноправними. Серед них можна виділити пару найменувань, що найбільш зустрічаються - це їдкий калій і каустичний поташ. Однією з властивостей гідроксиду калію є його високий рівень гігроскопічності. Зважаючи на поглинання вологи, кристали цієї речовини на повітрі розпливаються. Наступною властивістю є його хороший ступінь розчинності у метиловому спирті та етанолі при 28 градусах, а також у воді при 0 градусів, внаслідок чого виділяється досить багато теплоти.
За умови впливу на добавку Е525 високими температурами вона виявляє властивості, що використовуються з метою очищення матеріалів з нержавіючої сталі від забруднень різного виду, наприклад, олії та інших речовин із вмістом жиру.
Ще однією властивістю гідроксиду калію є його вибухонебезпечність та негорючість. Дане з'єднання легко здатне зруйнувати такі органічні матеріали, як шкіра, папір, скло і дерево.
Сфера застосування
Гідроксид калію як харчова добавка дозволений в Російській Федерації в кількостях, які узгоджені з технологічною інструкцією.
Своє поширення добавка знайшла у виробництві продуктів харчування завдяки таким властивостям як здатність впливати на рівень кислотності, тобто Е525 є регулятором кислотності.
Якщо безпосередньо зачіпати тільки сферу виробництва їжі, то гідроксид калію найчастіше можна виявити в какао, шоколаді та продукції з цих двох складових. Крім цього, добавка не оминула й продукти дитячого харчування. Вона бере участь у обробці замороженої картоплі. Може застосовуватися як допоміжний елемент під час виробництва фруктової та овочевої продукції: за її допомогою очищаються овочі, фрукти, коренеплоди.
Якщо не зациклюватись лише на продуктах харчування, то гідроксид калію має досить широкий спектр застосування:
- з метою короткочасної обробки деревної целюлози під час отримання віскозних ниток та волокон;
- для отримання мила в рідкому вигляді – гідроксид у ході взаємодії зі стеариновою та пальмітиновою кислотами дає на виході рідкі адукти;
- як електроліт у лужних акумуляторах;
- для обробки тканин з бавовни з метою, щоб підвищити рівень гігроскопічності;
- як осушуючий елемент для рідин у такій галузі, як органічна синтетична хімія;
- як речовина, здатна поглинати кислі гази, наприклад, діоксид сірки, сірководень, вуглекислий газ та ін;
- як осушуюча речовина для газів, які не взаємодіють з гідроксидом, наприклад, закису азоту, аміаку, фосфіну;
- входить до переліку компонентів побутових засобів для чищення посуду, виготовленого з нержавіючої сталі;
- з метою визначення рівня концентрації кислот;
- з метою анізотропного травлення кремнію у кристалах;
- як агент, який перешкоджає утворенню піни під час виробництва паперу.
Шкідливість гідроксиду калію
Судячи із застережень фахівців, надлишок гідроксиду калію призводить до дуже несприятливих впливів. Це сигналізує про те, що необхідно дотримуватись підвищених заходів безпеки під час роботи з даним з'єднанням.
Ця речовина належить до другого класу небезпеки. У разі потрапляння на покриви шкіри може спровокувати опіки хімічного характеру. А надлишок гідроксиду калію взагалі викликає появу шкірних захворювань хронічної форми. Особливо небезпечний контакт цієї сполуки з людськими очима, оскільки зафіксовано випадки втрати зору.
Популярні статтіЧитати більше статей
 02.12.2013
02.12.2013
Усі ми багато ходимо протягом дня. Навіть якщо у нас малорухливий спосіб життя, ми все одно ходимо – адже у нас не є...
611329 65 Детальніше
 10.10.2013
10.10.2013
П'ятдесят років для представниць прекрасної статі – це своєрідний рубіж, переступивши який кожна друга...
453285 117 Детальніше
 02.12.2013
02.12.2013
У наш час біг вже не викликає безліч захоплених відгуків, як це було років тридцять тому. Тоді суспільство б...