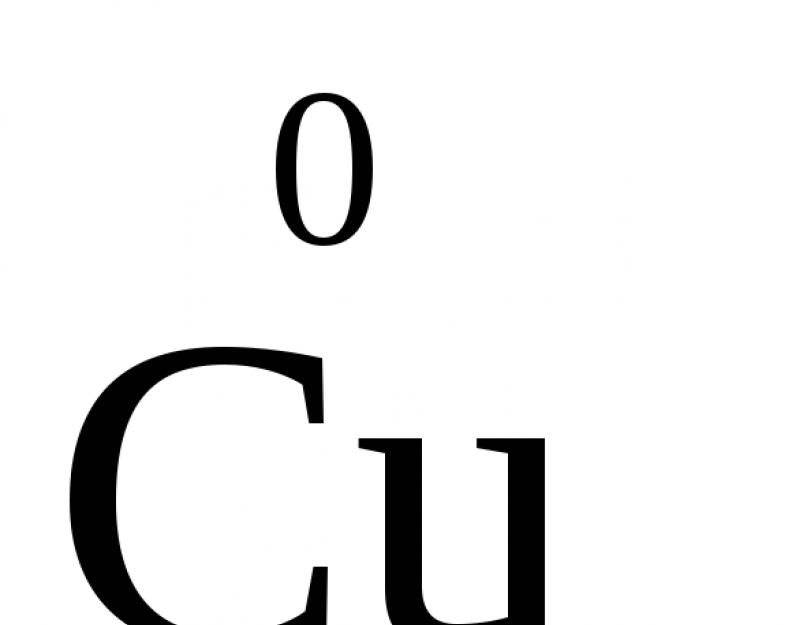لوصف قدرة الجزيئات على الأكسدة ، فإن مفهوم درجة الأكسدة مهم. حالة الأكسدة هي الشحنة التي يمكن أن تمتلكها ذرة في جزيء أو أيون إذا تم كسر جميع روابطها مع الذرات الأخرى ، وتركت أزواج الإلكترون الشائعة مع المزيد من العناصر الكهربية.
على عكس الشحنات الواقعية للأيونات ، فإن حالة الأكسدة تظهر فقط الشحنة الشرطية للذرة في الجزيء. يمكن أن تكون سالبة أو موجبة أو صفرية. على سبيل المثال ، حالة أكسدة الذرات في المواد البسيطة هي "0" (،  ,
, ,
, ). في مركبات كيميائيةيمكن أن تحتوي الذرات درجة دائمةأكسدة أو متغير. بالنسبة للمعادن من المجموعات الفرعية الرئيسية I و II و III من مجموعات النظام الدوري في المركبات الكيميائية ، تكون حالة الأكسدة عادةً ثابتة وتساوي Me +1 و Me +2 و Me +3 (Li +، Ca +2، Al +3) على التوالي. تحتوي ذرة الفلور دائمًا على -1. يحتوي الكلور في المركبات المحتوية على معادن دائمًا على -1. في الغالبية العظمى من المركبات ، للأكسجين حالة أكسدة -2 (باستثناء البيروكسيدات ، حيث تكون حالة الأكسدة -1) ، والهيدروجين +1 (باستثناء هيدرات المعادن ، حيث تكون حالة الأكسدة -1).
). في مركبات كيميائيةيمكن أن تحتوي الذرات درجة دائمةأكسدة أو متغير. بالنسبة للمعادن من المجموعات الفرعية الرئيسية I و II و III من مجموعات النظام الدوري في المركبات الكيميائية ، تكون حالة الأكسدة عادةً ثابتة وتساوي Me +1 و Me +2 و Me +3 (Li +، Ca +2، Al +3) على التوالي. تحتوي ذرة الفلور دائمًا على -1. يحتوي الكلور في المركبات المحتوية على معادن دائمًا على -1. في الغالبية العظمى من المركبات ، للأكسجين حالة أكسدة -2 (باستثناء البيروكسيدات ، حيث تكون حالة الأكسدة -1) ، والهيدروجين +1 (باستثناء هيدرات المعادن ، حيث تكون حالة الأكسدة -1).
المجموع الجبري لحالات الأكسدة لجميع الذرات في جزيء متعادل يساوي صفرًا ، وفي أيون يساوي شحنة الأيون. هذه العلاقة تجعل من الممكن حساب حالات أكسدة الذرات في المركبات المعقدة.
في جزيء حمض الكبريتيك H 2 SO 4 ، تحتوي ذرة الهيدروجين على حالة أكسدة +1 ، وذرة الأكسجين هي -2. نظرًا لوجود ذرتين من الهيدروجين وأربع ذرات أكسجين ، لدينا اثنتان "+" وثماني "-". ستة "+" مفقودة من الحياد. هذا الرقم هو حالة أكسدة الكبريت -  . يتكون جزيء ثنائي كرومات البوتاسيوم K 2 Cr 2 O 7 من ذرتين من البوتاسيوم وذرتين من الكروم وسبع ذرات أكسجين. يحتوي البوتاسيوم على حالة أكسدة تبلغ +1 ، بينما يحتوي الأكسجين على -2. إذن لدينا اثنان "+" وأربعة عشر "-". تسقط الاثني عشر علامة "+" المتبقية على ذرتين من الكروم ، ولكل منهما حالة أكسدة تبلغ +6 (
. يتكون جزيء ثنائي كرومات البوتاسيوم K 2 Cr 2 O 7 من ذرتين من البوتاسيوم وذرتين من الكروم وسبع ذرات أكسجين. يحتوي البوتاسيوم على حالة أكسدة تبلغ +1 ، بينما يحتوي الأكسجين على -2. إذن لدينا اثنان "+" وأربعة عشر "-". تسقط الاثني عشر علامة "+" المتبقية على ذرتين من الكروم ، ولكل منهما حالة أكسدة تبلغ +6 (  ).
).
عوامل مؤكسدة ومختزلة نموذجية
من تعريف عمليات الاختزال والأكسدة ، يترتب على ذلك ، من حيث المبدأ ، أن المواد البسيطة والمعقدة التي تحتوي على ذرات ليست في أدنى حالة أكسدة وبالتالي يمكن أن تخفض حالة الأكسدة الخاصة بها يمكن أن تعمل كعوامل مؤكسدة. وبالمثل ، فإن المواد البسيطة والمعقدة التي تحتوي على ذرات ليست في أعلى حالة أكسدة وبالتالي يمكن أن تزيد من حالة الأكسدة يمكن أن تعمل كعوامل اختزال.
أقوى العوامل المؤكسدة هي:
1) مواد بسيطة تتكون من ذرات لها قدرة كهربية كبيرة ، أي غير الفلزات النموذجية الموجودة في المجموعات الفرعية الرئيسية للمجموعتين السادسة والسابعة من النظام الدوري: F ، O ، Cl ، S (على التوالي F 2 ، O 2 ، Cl 2 ، S) ؛
2) المواد التي تحتوي على عناصر عالية ومتوسطة
حالات الأكسدة الموجبة ، بما في ذلك في شكل أيونات ، سواء بسيطة أو عنصرية (Fe 3+) أو أكسجين محتوية على الأكسجين (أيون برمنجنات - MnO 4 -) ؛
3) مركبات البيروكسيد.
المواد المحددة المستخدمة في الممارسة العملية كمؤكسدات هي الأكسجين والأوزون والكلور والبرومين والبرمنجنات وثنائي كرومات وأكسيدات الكلور وأملاحها (على سبيل المثال ،  ,
, ,
, )، حمض النيتريك (
)، حمض النيتريك (  ) ، حامض الكبريتيك المركز (
) ، حامض الكبريتيك المركز (  )، ثاني أكسيد المنغنيز (
)، ثاني أكسيد المنغنيز (  ) ، بيروكسيد الهيدروجين وبيروكسيدات المعادن (
) ، بيروكسيد الهيدروجين وبيروكسيدات المعادن (  ,
, ).
).
أقوى عوامل الاختزال هي:
1) مواد بسيطة ذراتها منخفضة كهرسلبية ("معادن نشطة") ؛
2) الكاتيونات المعدنية في حالات الأكسدة المنخفضة (Fe 2+) ؛
3) الأنيونات الأولية البسيطة ، على سبيل المثال ، أيون الكبريتيد S 2- ؛
4) الأنيونات المحتوية على الأكسجين (oxoanions) المقابلة لأدنى حالات الأكسدة الإيجابية للعنصر (النتريت  ، كبريتيت
، كبريتيت  ).
).
المواد المحددة المستخدمة في الممارسة العملية كعوامل اختزال هي ، على سبيل المثال ، الفلزات الأرضية القلوية والقلوية ، والكبريتيدات ، والكبريتات ، وهاليدات الهيدروجين (باستثناء HF) ، والمواد العضوية - الكحوليات ، والألدهيدات ، والفورمالدهيد ، والجلوكوز ، وحمض الأكساليك ، وكذلك الهيدروجين ، والكربون ، وأول أكسيد الكربون (  ) والألمنيوم في درجات حرارة عالية.
) والألمنيوم في درجات حرارة عالية.
من حيث المبدأ ، إذا كانت المادة تحتوي على عنصر في حالة أكسدة وسيطة ، فيمكن أن تظهر هذه المواد خصائص مؤكسدة واختزال. كل هذا يتوقف على
"شريك" في التفاعل: مع عامل مؤكسد قوي بدرجة كافية ، يمكن أن يتفاعل كعامل اختزال ، ومع عامل اختزال قوي بدرجة كافية ، كعامل مؤكسد. لذلك ، على سبيل المثال ، يعمل أيون النتريت NO 2 - في بيئة حمضية كعامل مؤكسد فيما يتعلق بالأيون I -:
2 +
2
+
2 + 4HCl →
+ 4HCl →  +
2
+
2 + 4KCl + 2H 2 O
+ 4KCl + 2H 2 O
وكعامل مختزل فيما يتعلق بأيون برمنجنات MnO 4 -
5 +
2
+
2 + 3H 2 SO 4 → 2
+ 3H 2 SO 4 → 2  +
5
+
5 + K 2 SO 4 + 3H 2 O
+ K 2 SO 4 + 3H 2 O
في المدرسة ، لا تزال الكيمياء واحدة من أصعب المواد ، والتي ، بسبب حقيقة أنها تخفي العديد من الصعوبات ، تثير لدى الطلاب (عادةً في الفترة من 8 إلى 9 فصول دراسية) الكراهية واللامبالاة للدراسة أكثر من الاهتمام. كل هذا يقلل من جودة وكمية المعرفة حول هذا الموضوع ، على الرغم من أن العديد من المجالات لا تزال تتطلب متخصصين في هذا المجال. نعم، لحظات صعبةوالقواعد غير المفهومة في الكيمياء تكون أحيانًا أكثر مما تبدو عليه. من الأسئلة التي تهم معظم الطلاب ما هي حالة الأكسدة وكيفية تحديد حالات الأكسدة للعناصر.
قاعدة مهمة هي قاعدة التنسيب ، الخوارزميات
هناك الكثير من الحديث هنا عن مركبات مثل الأكاسيد. بادئ ذي بدء ، يجب أن يتعلم كل طالب تحديد الأكاسيد- هذه مركبات معقدة من عنصرين ، تحتوي على الأكسجين. يتم تصنيف الأكاسيد على أنها مركبات ثنائية لأن الأكسجين يأتي في المرتبة الثانية في الخوارزمية. عند تحديد المؤشر ، من المهم معرفة قواعد التنسيب وحساب الخوارزمية.
خوارزميات لأكاسيد الحمض
الأكسدة -هذه تعبيرات عددية عن تكافؤ العناصر. على سبيل المثال ، تتشكل أكاسيد الحمض وفقًا لخوارزمية معينة: تأتي اللافلزات أو الفلزات أولاً (عادةً ما يكون التكافؤ من 4 إلى 7) ، ثم يأتي الأكسجين ، كما يجب أن يكون ، ثانيًا بالترتيب ، تكافؤه هو اثنان. يتم تحديده بسهولة - وفقًا للجدول الدوري العناصر الكيميائيةمندليف. من المهم أيضًا معرفة أن حالة أكسدة العناصر هي مؤشر يوحي بذلك إما إيجابية أو رقم سالب .
في بداية الخوارزمية ، كقاعدة عامة ، غير فلز ، وحالة الأكسدة موجبة. الأكسجين غير المعدني في مركبات الأكسيد له قيمة ثابتة ، وهي -2. لتحديد مدى صحة ترتيب جميع القيم ، تحتاج إلى ضرب جميع الأرقام المتاحة بمؤشرات عنصر معين واحد ، إذا كان المنتج ، مع مراعاة جميع السلبيات والإيجابيات ، هو 0 ، فإن الترتيب موثوق.
الترتيب في الأحماض التي تحتوي على الأكسجين
 الأحماض مواد معقدة، فهي مرتبطة ببعض المخلفات الحمضية وتحتوي على ذرة هيدروجين واحدة أو أكثر. هنا ، لحساب الدرجة ، المهارات في الرياضيات مطلوبة ، لأن المؤشرات اللازمة للحساب رقمية. بالنسبة للهيدروجين أو البروتون ، يكون دائمًا هو نفسه - +1. أيون الأكسجين السالب لديه حالة أكسدة سالبة -2.
الأحماض مواد معقدة، فهي مرتبطة ببعض المخلفات الحمضية وتحتوي على ذرة هيدروجين واحدة أو أكثر. هنا ، لحساب الدرجة ، المهارات في الرياضيات مطلوبة ، لأن المؤشرات اللازمة للحساب رقمية. بالنسبة للهيدروجين أو البروتون ، يكون دائمًا هو نفسه - +1. أيون الأكسجين السالب لديه حالة أكسدة سالبة -2.
بعد تنفيذ كل هذه الإجراءات ، يمكنك تحديد درجة الأكسدة والعنصر المركزي في الصيغة. التعبير الخاص بحسابها هو صيغة في شكل معادلة. على سبيل المثال ، بالنسبة لحمض الكبريتيك ، ستكون معادلة واحدة غير معروفة.
المصطلحات الأساسية في الإجمالي
ORR هو تفاعل أكسدة اختزال.
- حالة أكسدة أي ذرة - تميز قدرة هذه الذرة على ربط أو إعطاء إلكترونات لذرات أيونات أخرى (أو ذرات) ؛
- من المعتاد اعتبار الذرات المشحونة أو الأيونات غير المشحونة عوامل مؤكسدة ؛
- سيكون العامل المختزل في هذه الحالة عبارة عن أيونات مشحونة أو ، على العكس من ذلك ، ذرات غير مشحونة تفقد إلكتروناتها في عملية التفاعل الكيميائي ؛
- الأكسدة هي التبرع بالإلكترونات.
كيفية ترتيب حالة الأكسدة في الأملاح
 تتكون الأملاح من معدن واحد وواحد أو أكثر من بقايا الحمض. إجراء التحديد هو نفسه كما هو الحال في الأحماض المحتوية على حمض.
تتكون الأملاح من معدن واحد وواحد أو أكثر من بقايا الحمض. إجراء التحديد هو نفسه كما هو الحال في الأحماض المحتوية على حمض.
يقع المعدن الذي يشكل الملح مباشرة في المجموعة الفرعية الرئيسية ، وستكون درجته مساوية لعدد مجموعته ، أي أنه سيظل دائمًا مؤشرًا ثابتًا وإيجابيًا.
كمثال ، ضع في اعتبارك ترتيب حالات الأكسدة في نترات الصوديوم. يتكون الملح باستخدام عنصر من المجموعة الفرعية الرئيسية للمجموعة 1 ، على التوالي ، تكون حالة الأكسدة موجبة وتساوي واحدًا. في النترات ، الأكسجين له نفس القيمة - -2. من أجل الحصول على قيمة عددية ، يتم أولاً وضع معادلة مع واحد غير معروف ، مع مراعاة جميع السلبيات والإيجابيات للقيم: + 1 + X-6 = 0. من خلال حل المعادلة ، يمكنك الوصول إلى حقيقة أن المؤشر العددي موجب ويساوي +5. هذا هو مؤشر النيتروجين. مفتاح مهم لحساب درجة الأكسدة - الجدول.
حكم الترتيب في الأكاسيد الأساسية
- أكاسيد المعادن النموذجية في أي مركبات لها مؤشر أكسدة ثابت ، لا يزيد دائمًا عن +1 ، أو في حالات أخرى +2 ؛
- يتم حساب المؤشر الرقمي للمعدن باستخدام الجدول الدوري. إذا كان العنصر موجودًا في المجموعة الفرعية الرئيسية للمجموعة 1 ، فستكون قيمته +1 ؛
- يجب أن تكون قيمة الأكاسيد ، مع مراعاة مؤشراتها ، بعد الضرب ، مجمعة صفرًا ، لأن الجزيء فيها محايد ، جسيم خالي من الشحنة ؛
- تحتوي معادن المجموعة الفرعية الرئيسية للمجموعة 2 أيضًا على مؤشر إيجابي ثابت ، وهو +2.
درجة الأكسدة هي قيمة شرطية تستخدم لتسجيل تفاعلات الأكسدة والاختزال. لتحديد درجة الأكسدة ، يتم استخدام جدول أكسدة العناصر الكيميائية.
معنى
تعتمد حالة أكسدة العناصر الكيميائية الأساسية على كهرسلبيتها. القيمة تساوي عدد الإلكترونات النازحة في المركبات.
تعتبر حالة الأكسدة موجبة إذا تم تهجير الإلكترونات من الذرة ، أي يتبرع العنصر بالإلكترونات في المركب وهو عامل مختزل. تشمل هذه العناصر المعادن ، ودائمًا ما تكون حالة الأكسدة إيجابية.
عندما يتم إزاحة الإلكترون باتجاه الذرة ، تعتبر القيمة سالبة ، ويعتبر العنصر عامل مؤكسد. تقبل الذرة الإلكترونات حتى اكتمال مستوى الطاقة الخارجي. معظم غير المعادن هي عوامل مؤكسدة.
المواد البسيطة التي لا تتفاعل لها حالة أكسدة صفرية دائمًا.

أرز. 1. جدول حالات الأكسدة.
في المركب ، يكون للذرة غير المعدنية ذات القدرة الكهربية المنخفضة حالة أكسدة موجبة.
تعريف
يمكنك تحديد حالة الأكسدة القصوى والدنيا (كم عدد الإلكترونات التي يمكن أن تعطيها الذرة وتأخذها) باستخدام الجدول الدوري لمندليف.
القوة القصوى تساوي عدد المجموعة التي يقع فيها العنصر ، أو عدد إلكترونات التكافؤ. يتم تحديد الحد الأدنى للقيمة بواسطة الصيغة:
عدد (المجموعات) - 8.

أرز. 2. الجدول الدوري.
يقع الكربون في المجموعة الرابعة ، وبالتالي ، فإن أعلى حالة أكسدة له هي +4 ، والأقل هي -4. أقصى حالة أكسدة للكبريت هي +6 ، والحد الأدنى هو -2. تحتوي معظم اللافلزات دائمًا على حالة أكسدة متغيرة - إيجابية وسلبية -. الاستثناء هو الفلور. حالة الأكسدة الخاصة به هي دائمًا -1.
يجب أن نتذكر أن هذه القاعدة لا تنطبق على الفلزات القلوية والقلوية الترابية من المجموعتين الأولى والثانية ، على التوالي. هذه المعادن لها حالة أكسدة إيجابية ثابتة - الليثيوم Li +1 ، الصوديوم Na +1 ، البوتاسيوم K +1 ، البريليوم Be +2 ، المغنيسيوم Mg +2 ، الكالسيوم Ca +2 ، السترونتيوم Sr +2 ، الباريوم Ba +2. قد تظهر معادن أخرى درجات متفاوتهأكسدة. الاستثناء هو الألمنيوم. على الرغم من كونها في المجموعة الثالثة ، إلا أن حالة الأكسدة الخاصة بها تكون دائمًا +3.

أرز. 3. المعادن الأرضية القلوية والقلوية.
من المجموعة الثامنة ، يمكن أن يظهر الروثينيوم والأوزميوم فقط أعلى حالة أكسدة +8. يعرض الذهب والنحاس ، الموجودان في المجموعة الأولى ، حالات أكسدة +3 و +2 على التوالي.
تسجيل
لتسجيل حالة الأكسدة بشكل صحيح ، يجب أن تتذكر بعض القواعد:
- لا تتفاعل الغازات الخاملة ، لذلك تكون حالة الأكسدة صفر دائمًا ؛
- في المركبات ، تعتمد حالة الأكسدة المتغيرة على التكافؤ المتغير والتفاعل مع العناصر الأخرى ؛
- يُظهر الهيدروجين في المركبات التي تحتوي على معادن حالة أكسدة سالبة - Ca +2 H 2 −1 ، Na +1 H −1 ؛
- الأكسجين دائمًا له حالة أكسدة -2 ، باستثناء فلوريد الأكسجين والبيروكسيد - O +2 F 2-1 ، H 2 +1 O 2 -1.
ماذا تعلمنا؟
حالة الأكسدة هي قيمة شرطية توضح عدد الإلكترونات التي تلقتها ذرة عنصر أو أعطتها في مركب. تعتمد القيمة على عدد إلكترونات التكافؤ. دائمًا ما يكون للمعادن الموجودة في المركبات حالة أكسدة إيجابية ، أي هم المرممون. بالنسبة للمعادن الأرضية القلوية والقلوية ، فإن حالة الأكسدة هي نفسها دائمًا. يمكن أن تأخذ اللافلزات ، باستثناء الفلور ، حالات أكسدة موجبة وسالبة.
درجة الأكسدة. تحديد حالة أكسدة ذرة عنصر بواسطة صيغة كيميائيةروابط. تجميع صيغة المركب حسب حالات الأكسدة المعروفة لذرات العناصر
حالة الأكسدة لعنصر ما هي الشحنة المشروطة للذرة في المادة ، محسوبة بافتراض أنها تتكون من أيونات. لتحديد درجة أكسدة العناصر ، من الضروري تذكر قواعد معينة:
1. يمكن أن تكون حالة الأكسدة موجبة أو سلبية أو صفرية. يشار إليه رقم عربيبعلامة زائد أو ناقص أعلى رمز العنصر.
2. عند تحديد حالات الأكسدة ، فإنها تنطلق من كهرسلبية المادة: مجموع حالات الأكسدة لجميع الذرات في المركب هو صفر.
3. إذا كان المركب يتكون من ذرات عنصر واحد (في مادة بسيطة) ، فإن حالة أكسدة هذه الذرات هي صفر.
4. عادة ما يتم تخصيص حالات أكسدة للصلب لبعض ذرات بعض العناصر الكيميائية. على سبيل المثال ، تكون حالة أكسدة الفلور في المركبات دائمًا -1 ؛ الليثيوم والصوديوم والبوتاسيوم والروبيديوم والسيزيوم +1 ؛ المغنيسيوم والكالسيوم والسترونتيوم والباريوم والزنك +2 والألمنيوم +3.
5. حالة أكسدة الهيدروجين في معظم المركبات هي +1 ، وفقط في المركبات التي تحتوي على بعض المعادن تكون 1 (KH، BaH2).
6. حالة أكسدة الأكسجين في معظم المركبات هي -2 ، وفقط في بعض المركبات يتم تعيين حالة أكسدة لها -1 (H2O2 أو Na2O2 أو +2 (OF2).
7. تظهر ذرات العديد من العناصر الكيميائية حالات أكسدة متغيرة.
8. تكون حالة أكسدة ذرة فلز في المركبات موجبة وتساوي عدديًا تكافؤها.
9. أقصى حالة أكسدة موجبة لعنصر ما تساوي عادة رقم المجموعة في النظام الدوري الذي يوجد فيه العنصر.
10. أدنى حالة أكسدة للمعادن هي صفر. بالنسبة لغير المعادن ، في معظم الحالات ، تكون حالة الأكسدة السالبة السفلية مساوية للفرق بين رقم المجموعة ورقم ثمانية.
11. تشكل حالة أكسدة الذرة أيونًا بسيطًا (يتكون من ذرة واحدة) ، مساويًا لشحنة هذا الأيون.
باستخدام القواعد المذكورة أعلاه ، نحدد حالات أكسدة العناصر الكيميائية في تركيب H2SO4. هذا مادة معقدة، تتكون من ثلاثة عناصر كيميائية - الهيدروجين H ، الكبريت S والأكسجين O. لاحظ حالات الأكسدة لتلك العناصر التي تكون ثابتة بالنسبة لها. في حالتنا ، هذه هي الهيدروجين H والأكسجين O.
دعونا نحدد حالة الأكسدة غير المعروفة للكبريت. دع حالة أكسدة الكبريت في هذا المركب تكون x.
دعونا نجعل المعادلات بضرب مؤشرها في حالة الأكسدة لكل عنصر ونساوي الكمية المستخرجة إلى الصفر: 2 (+1) + x + 4 (-2) = 0
2 + س - 8 = 0
س = +8-2 = +6
لذلك ، فإن حالة أكسدة الكبريت تساوي زائد ستة.
في المثال التالي ، دعنا نكتشف كيف يمكنك كتابة صيغة لمركب له حالات أكسدة معروفة لذرات العناصر. لنصنع صيغة أكسيد الحديد (III). تعني كلمة "أكسيد" أنه على يمين رمز الحديد ، يجب كتابة رمز الأكسجين: FeO.
لاحظ حالات أكسدة العناصر الكيميائية فوق رموزها. يشار إلى حالة أكسدة الحديد في الاسم بين قوسين (III) ، وبالتالي ، فهي تساوي +3 ، حالة أكسدة الأكسجين في الأكاسيد هي -2.
لنجد المضاعف المشترك الأصغر للأرقام 3 و 2 ، وهذا هو 6. اقسم الرقم 6 على 3 ، نحصل على الرقم 2 - هذا هو فهرس الحديد. نقسم الرقم 6 على 2 ، نحصل على الرقم 3 - هذا هو مؤشر الأكسجين.
في المثال التالي ، دعنا نتعرف على كيفية صياغة صيغة مركبة لها حالات أكسدة معروفة لذرات العناصر وشحنات الأيونات. دعونا نصنع صيغة الكالسيوم أورثو فوسفات. تعني كلمة "أورثوفوسفات" أنه على يمين رمز الكالسيوم ، يجب كتابة بقايا الحمض لحمض أورثوفوسفات: CaPO4.
لاحظ حالة أكسدة الكالسيوم (القاعدة رقم 4) وشحنة بقايا الحمض (وفقًا لجدول الذوبان).
لنجد المضاعف المشترك الأصغر للعددين 2 و 3 ، وهذا هو 6. اقسم الرقم 6 على 2 ، نحصل على الرقم 3 - هذا هو فهرس الكالسيوم. نقسم الرقم 6 على 3 ، نحصل على الرقم 2 - هذا هو مؤشر بقايا الحمض.
لتوصيف حالة العناصر في المركبات ، تم إدخال مفهوم درجة الأكسدة.
تعريف
يسمى عدد الإلكترونات التي تم إزاحتها من ذرة عنصر معين أو إلى ذرة عنصر معين في مركب حالة الأكسدة.
تشير حالة الأكسدة الموجبة إلى عدد الإلكترونات التي تم إزاحتها من ذرة معينة ، وتشير حالة الأكسدة السالبة إلى عدد الإلكترونات التي يتم إزاحتها نحو ذرة معينة.
من هذا التعريف ، يترتب على ذلك أنه في المركبات ذات الروابط غير القطبية ، تكون حالة أكسدة العناصر صفرًا. يمكن للجزيئات التي تتكون من ذرات متطابقة (N 2 ، H 2 ، Cl 2) أن تكون بمثابة أمثلة على هذه المركبات.
حالة أكسدة المعادن في الحالة الأولية هي صفر ، لأن توزيع كثافة الإلكترون فيها منتظم.
في المركبات الأيونية البسيطة ، تكون حالة أكسدة العناصر المكونة لها مساوية للشحنة الكهربائية ، لأنه أثناء تكوين هذه المركبات ، تقريبًا الانتقال الكاملالإلكترونات من ذرة إلى أخرى: Na +1 I -1 ، Mg +2 Cl -1 2 ، Al +3 F -1 3 ، Zr +4 Br -1 4.
عند تحديد درجة أكسدة العناصر في المركبات ذات الروابط التساهمية القطبية ، تتم مقارنة قيم سلبيتها الكهربية. نظرًا لأنه ، أثناء تكوين رابطة كيميائية ، يتم إزاحة الإلكترونات إلى ذرات عناصر كهرسلبية أكثر ، فإن الأخيرة لها حالة أكسدة سالبة في المركبات.
أعلى حالة أكسدة
للعناصر التي تظهر في مركباتها بدرجات مختلفةالأكسدة ، هناك مفاهيم لحالات الأكسدة الأعلى (الإيجابية القصوى) والسفلية (السلبية الدنيا). عادةً ما تتطابق أعلى حالة أكسدة لعنصر كيميائي عدديًا مع رقم المجموعة في النظام الدوريدي آي مينديليف. الاستثناءات هي الفلور (حالة الأكسدة هي -1 ، والعنصر موجود في المجموعة VIIA) ، والأكسجين (حالة الأكسدة +2 ، والعنصر موجود في المجموعة VIA) ، والهيليوم ، والنيون ، والأرجون (حالة الأكسدة هي 0 ، والعناصر موجودة في المجموعة الثامنة) ، وكذلك عناصر المجموعة الفرعية للكوبالت والنيكل (أعلى حالة الأكسدة). رقم قيمته أقل من رقم المجموعة التي ينتمون إليها. على العكس من ذلك ، تتمتع عناصر المجموعة الفرعية النحاسية بحالة أكسدة أعلى من واحدة ، على الرغم من أنها تنتمي إلى المجموعة الأولى (أقصى حالة أكسدة موجبة للنحاس والفضة هي +2 ، ذهب +3).
أمثلة على حل المشكلات
مثال 1
- في كبريتيد الهيدروجين ، تكون حالة أكسدة الكبريت (-2) وفي مسألة بسيطة- رمادي - 0:
التغيير في حالة أكسدة الكبريت: -2 → 0 ، أي الجواب السادس.
- في مادة بسيطة - الكبريت - تكون حالة أكسدة الكبريت 0 ، وفي SO 3 - (+6):
التغيير في حالة أكسدة الكبريت: 0 → +6 ، أي الجواب الرابع.
- في حامض الكبريت ، تكون حالة أكسدة الكبريت (+4) وفي مادة بسيطة - كبريت - 0:
1 × 2 + س + 3 × (-2) = 0 ؛
تغيير في حالة أكسدة الكبريت: +4 → 0 ، أي الجواب الثالث.
مثال 2
| يمارس | يظهر التكافؤ III وحالة الأكسدة (-3) نيتروجين في المركب: أ) N 2 H 4 ؛ ب) NH3 ؛ ج) NH 4 Cl ؛ د) N 2 O 5 |
| حل | من أجل إعطاء إجابة صحيحة على السؤال المطروح ، سنحدد بالتناوب حالة التكافؤ وحالة الأكسدة للنيتروجين في المركبات المقترحة. أ) تساوي تكافؤ الهيدروجين دائمًا أنا. الرقم الإجماليوحدات تكافؤ الهيدروجين هي الرابعة (1 × 4 = 4). اقسم القيمة التي تم الحصول عليها على عدد ذرات النيتروجين في الجزيء: 4/2 \ u003d 2 ، وبالتالي ، فإن تكافؤ النيتروجين هو II. هذه الإجابة غير صحيحة. ب) تكافؤ الهيدروجين دائمًا يساوي I. العدد الإجمالي لوحدات تكافؤ الهيدروجين هو 3 (1 × 3 = 3). نقسم القيمة التي تم الحصول عليها على عدد ذرات النيتروجين في الجزيء: 3/1 \ u003d 2 ، وبالتالي ، فإن تكافؤ النيتروجين هو III. حالة أكسدة النيتروجين في الأمونيا هي (-3): هذا هو الجواب الصحيح. |
| إجابة | الخيار (ب) |