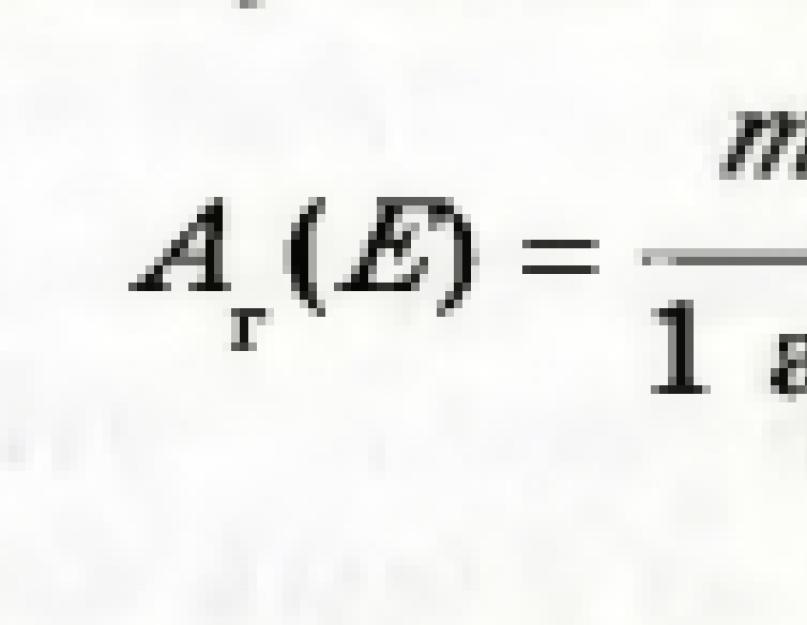>> Atomo masė. Santykinė atominė masė
Atomo masė. Santykinė atominė masė
Pastraipos medžiaga padės išsiaiškinti:
> kuo skiriasi atomo masė ir santykinė atominė masė ;
> kodėl patogu naudoti santykines atomines mases;
> kur rasti elemento santykinės atominės masės reikšmę.
Tai yra įdomu
Elektrono masė yra maždaug 9 10 -28 g.
Atomo masė.
Svarbi atomo savybė yra jo masė. Beveik visa atomo masė yra sutelkta branduolyje. Elektronai turi tokią mažą masę, kad dažniausiai jos nepaisoma.
palyginti su 1/12 - anglies atomo masės (ji beveik 12 kartų sunkesnė už vandenilio atomą). Ši maža masė buvo vadinama atominės masės vienetu (sutrumpintai kaip a.e.m.):
1 a. e.m \u003d 1 / 12m a (C) \u003d 1/12 1,994 10 -23 g = 1,662 10 -24 g.
Vandenilio atomo masė beveik sutampa su atominės masės vienetu: m a (H) ~ 1a. e.m. Urano atomo masė yra didesnė nei jo masė
Tai yra
m a (U) ~ 238 a. valgyti.
Skaičius, gautas padalijus elemento atomo masę iš atominės masės vieneto, vadinamas santykine elemento atomine mase. Ši reikšmė žymima A r (E):

Indeksas šalia raidės A yra pirmoji raidė lotyniškas žodis relativus – giminaitis.
Santykinė elemento atominė masė parodo, kiek kartų didesnė už atomo masę elementas daugiau nei 1/12 anglies atomo masės.
m a (H) \u003d 1,673 10 -2 4 g
m a (H) \u003d 1 a. valgyti.
A r (H) = 1
Santykinė elemento atominė masė neturi matmenų.
Pirmąją santykinių atominių masių lentelę beveik prieš 200 metų sudarė anglų mokslininkas J. Daltonas.
Remiantis pateikta medžiaga, galima padaryti tokias išvadas:
Santykinės atominės masės yra proporcingos atomų masėms;
atomų masių santykiai yra tokie patys kaip santykinių atomų masių.
Įrašomos cheminių elementų santykinių atominių masių reikšmės periodinė sistema .
Johnas Daltonas (1766–1844)

Išskirtinė anglų kalba fizikas ir chemikas. Londono karališkosios draugijos (Anglijos mokslų akademijos) narys. Jis pirmasis iškėlė hipotezę apie skirtingas atomų mases ir dydžius, nustatė daugelio elementų santykines atomines mases ir sudarė pirmąją jų verčių lentelę (1803 m.). Jis pasiūlė elementų simbolius ir cheminių junginių pavadinimus.
Sukūręs per 200 tūkst meteorologiniai stebėjimai, ištyręs oro sudėtį ir savybes, atrado dalinių (dalinių) slėgių dėsnius dujų(1801), dujų šiluminis plėtimasis (1802), dujų tirpumas skysčiuose (1803).

Ryžiai. 35. Urano elemento ląstelė
Jie labai apibrėžti didelis tikslumas; atitinkami skaičiai dažniausiai yra penkiaženkliai ir šešiaženkliai (35 pav.).
Atliekant įprastus cheminius skaičiavimus, santykinių atominių masių reikšmės paprastai suapvalinamos iki sveikųjų skaičių. Taigi, vandeniliui ir Uranui
Ar(H) = 1,0079~1;
A r (U) = 238,029 ~ 238.
Tik santykinės chloro atominės masės vertė suapvalinama iki dešimtųjų:
A r (Cl) = 35,453 ~ 35,5.
Periodinėje sistemoje suraskite ličio, anglies, deguonies, neono santykinių atominių masių vertes ir suapvalinkite jas iki sveikųjų skaičių.
Kiek kartų anglies, deguonies, neono ir magnio atomų masė yra didesnė už helio atomo masę? Skaičiavimams naudokite suapvalintas santykines atomines mases.
pastaba: Elementai periodinėje lentelėje išdėstyti didėjančia atomų masių tvarka.
išvadų
Atomai turi labai mažą masę.
Skaičiavimų patogumui naudojamos santykinės atomų masės.
Santykinė elemento atominė masė yra elemento atomo masės ir anglies atomo masės santykis.
Santykinių atominių masių reikšmės nurodomos periodinėje cheminių elementų sistemoje.
?
48. Kuo skiriasi „atominės masės“ ir santykinės atominės masės sąvokos?
49. Kas yra atominės masės vienetas?
50. Ką reiškia įrašai A r ir A r?
51. Kuris atomas lengvesnis – anglies ar titano? Kiek kartų?
52. Kas turi didelę masę: fluoro atomas arba du ličio atomai; du magnio atomai ar trys sieros atomai?
53. Raskite periodinėje sistemoje tris ar keturias poras elementų, kurių atomų masių santykis yra: a) 1:2; b) 1:3.
54. Apskaičiuokite helio santykinę atominę masę, jei šio elemento atomo masė yra 6,647 - 10 -24 g.
55. Apskaičiuokite berilio atomo masę.
Popelis P. P., Kriklya L. S., Chemija: Pdruch. 7 ląstelėms. zahalnosvit. navch. zakl. - K .: Parodų centras "Akademija", 2008. - 136 p.: il.
Pamokos turinys pamokos santrauka ir pagalbinio rėmo pamokos pristatymas interaktyviosios technologijos greitinančius mokymo metodus Praktika viktorinos, testavimo internetinės užduotys ir pratimai namų darbų seminarai ir mokymų klausimai klasės diskusijoms Iliustracijos vaizdo ir garso medžiaga nuotraukos, paveikslėliai grafika, lentelės, schemos komiksai, palyginimai, posakiai, kryžiažodžiai, anekdotai, anekdotai, citatos Priedai santraukos cheat sheets lustai smalsiems straipsniams (MAN) literatūra pagrindinis ir papildomas terminų žodynas Vadovėlių ir pamokų tobulinimas klaidų taisymas vadovėlyje pasenusių žinių pakeitimas naujomis Tik mokytojams kalendoriniai planai mokymosi programas GairėsEnciklopedinis „YouTube“.
1 / 3
✪ Chemija| Santykinė atominė masė
✪ Santykinė atominė masė. Molekulinė masė.
✪ 15. Atominė masė
Subtitrai
Bendra informacija
Viena iš pagrindinių atomo savybių yra jo masė. Absoliuti atomo masė yra labai mažas dydis. Taigi vandenilio atomo masė yra apie 1,67⋅10–24 g. Todėl chemijoje (praktiniais tikslais) vyrauja ir daug patogiau naudoti santykinę [sąlyginę] reikšmę, kuri vadinama santykinė atominė masė arba tiesiog atominė masė ir kuris parodo, kiek kartų tam tikro elemento atomo masė yra didesnė už kito elemento atomo masę, imamą masės vienetu.
Kaip atominės ir molekulinės masės matavimo vienetas, 1 ⁄ 12 labiausiai paplitusio izotopo anglies neutralaus atomo masės dalis 12 C . Šis nesisteminis masės matavimo vienetas vadinamas atominės masės vienetas (a. valgyti.) arba daltoną (Taip).
Skirtumas tarp izotopo atominės masės ir jo masės skaičiaus vadinamas masės pertekliumi (dažniausiai išreiškiamas MeV). Jis gali būti teigiamas ir neigiamas; jo atsiradimo priežastis – netiesinė branduolių surišimo energijos priklausomybė nuo protonų ir neutronų skaičiaus, taip pat protono ir neutrono masių skirtumas.
Izotopo atominės masės priklausomybė nuo masės skaičiaus yra tokia: masės perteklius teigiamas vandeniliui-1, didėjant masės skaičiui mažėja ir tampa neigiamas, kol pasiekiamas geležies-56 minimumas, tada pradeda auga ir padidėja iki teigiamų sunkiųjų nuklidų verčių. Tai atitinka faktą, kad dalijantis už geležį sunkesniems branduoliams išsiskiria energija, o dalijantis lengviesiems branduoliams reikia energijos. Priešingai, susiliejus už geležį lengvesniems branduoliams išsiskiria energija, o sunkesnių už geležį elementų sintezei reikia papildomos energijos.
Istorija
Skaičiuojant atomines mases, iš pradžių (su pradžios XIX amžiuje, J. Daltono siūlymu; žr. Daltono atominę teoriją) vandenilio atomo, kaip lengviausio elemento, masė buvo paimta kaip vienetinė masė [santykinė] ir jos atžvilgiu apskaičiuotos kitų elementų atomų masės. Tačiau kadangi daugumos elementų atominės masės nustatomos pagal jų deguonies junginių sudėtį, iš tikrųjų (de facto) skaičiavimai buvo atlikti atsižvelgiant į deguonies atominę masę, kuri buvo laikoma 16; deguonies ir vandenilio atominių masių santykis buvo laikomas lygiu 16: 1. Vėliau atlikti tikslesni matavimai parodė, kad šis santykis yra lygus 15,874: 1 arba, kas yra tas pats, 16: 1,0079, priklausomai nuo to, kuris atomas - deguonis arba vandenilis – nurodo sveikąjį skaičių. Pasikeitus deguonies atominei masei, pasikeistų daugumos elementų atominė masė. Todėl buvo nuspręsta palikti deguonies atominę masę 16, o vandenilio atominė masė yra 1,0079.
Taigi buvo paimtas atominės masės vienetas 1 ⁄ 16 deguonies atomo masės dalis, vadinama deguonies vienetas. Vėliau buvo nustatyta, kad natūralus deguonis yra izotopų mišinys, todėl deguonies masės vienetas apibūdina vidutinę natūralių deguonies izotopų (deguonies-16, deguonies-17 ir deguonies-18) atomų masės vertę. būti nestabilus dėl natūralių deguonies izotopinės sudėties svyravimų. Dėl atominė fizika toks vienetas pasirodė nepriimtinas, ir šioje mokslo šakoje buvo imtasi atominės masės vieneto 1 ⁄ 16 deguonies atomo masės dalis 16 O. Dėl to susiformavo dvi atominių masių skalės – cheminės ir fizikinės. Dviejų atominių masių skalių buvimas sukėlė didelių nepatogumų. Daugelio konstantų reikšmės, apskaičiuotos fizikinėmis ir cheminėmis skalėmis, pasirodė skirtingos. Ši nepriimtina pozicija paskatino atominių masių anglies skalės įvedimą, o ne deguonies skalę.
Tarptautinis fizikų kongresas (1960 m.) patvirtino vieningą santykinių atominių masių skalę ir naują atominės masės vienetą, o suvienijo Tarptautinis chemikų kongresas (1961 m.; praėjus 100 metų po I tarptautinio chemikų kongreso), o ne ankstesni du deguonies atominės masės vienetai – fiziniai ir cheminiai. Deguonis cheminis vienetas yra lygus 0,999957 naujo atominės masės anglies vieneto. Šiuolaikiniu mastu santykinė deguonies ir vandenilio atominė masė yra atitinkamai 15,9994: 1,0079 ... Kadangi naujasis atominės masės vienetas yra susietas su konkrečiu izotopu, o ne su vidutine cheminės medžiagos atominės masės verte. elementas, natūralūs izotopų kitimai neturi įtakos šio vieneto atkuriamumui.
Iš pamokos medžiagos sužinosite, kad kai kurių cheminių elementų atomai skiriasi nuo kitų cheminių elementų atomų mase. Mokytojas pasakos, kaip chemikai matavo atomų masę, kuri yra tokia maža, kad jų net nepamatysi elektroniniu mikroskopu.
Tema: Pradinės cheminės idėjos
Pamoka: Santykinė cheminių elementų atominė masė
pradžioje – XIX a (150 metų po Roberto Boyle'o darbo) anglų mokslininkas Johnas Daltonas pasiūlė cheminių elementų atomų masės nustatymo metodą. Panagrinėkime šio metodo esmę.
Daltonas pasiūlė modelį, pagal kurį sudėtingos medžiagos molekulėje yra tik vienas įvairių cheminių elementų atomas. Pavyzdžiui, jis manė, kad vandens molekulė susideda iš 1 vandenilio atomo ir 1 deguonies atomo. dalis paprastos medžiagos pagal Daltoną taip pat patenka tik vienas cheminio elemento atomas. Tie. Deguonies molekulę turi sudaryti vienas deguonies atomas.
Ir tada, žinant elementų masės dalis medžiagoje, nesunku nustatyti, kiek kartų vieno elemento atomo masė skiriasi nuo kito elemento atomo masės. Taigi Daltonas manė, kad elemento masės dalį medžiagoje lemia jo atomo masė.
Yra žinoma, kad magnio masės dalis magnio okside yra 60%, o deguonies masės dalis yra 40%. Sekdami Daltono samprotavimų keliu, galime teigti, kad magnio atomo masė yra 1,5 karto didesnė už deguonies atomo masę (60/40 = 1,5):
Mokslininkas pastebėjo, kad vandenilio atomo masė yra mažiausia, nes. nėra sudėtingos medžiagos, kurioje vandenilio masės dalis būtų didesnė už kito elemento masės dalį. Todėl jis pasiūlė palyginti elementų atomų mases su vandenilio atomo mase. Ir tokiu būdu jis apskaičiavo pirmąsias santykinių (vandenilio atomo atžvilgiu) cheminių elementų atominių masių vertes.
Vandenilio atominė masė buvo paimta kaip vienetas. Ir prasmė santykinė masė sieros buvo 17. Bet visos gautos reikšmės yra arba apytikslės, arba neteisingos, nes. to meto eksperimento technika toli gražu nebuvo tobula, o Daltono instaliacija apie materijos kompoziciją buvo neteisinga.
1807-1817 metais. Švedų chemikas Jönsas Jakobas Berzelius atliko daug tyrimų, kad patikslintų santykines elementų atomines mases. Jam pavyko pasiekti rezultatus, artimus šiuolaikiniams.
Daug vėliau nei Berzelio darbas, cheminių elementų atomų masės imtos lyginti su 1/12 anglies atomo masės (2 pav.).

Ryžiai. 1. Cheminio elemento santykinės atominės masės skaičiavimo modelis
Santykinė cheminio elemento atominė masė parodo, kiek kartų cheminio elemento atomo masė yra didesnė nei 1/12 anglies atomo masės.
Santykinė atominė masė žymima A r , ji neturi matavimo vienetų, nes parodo atomų masių santykį.
Pavyzdžiui: A r (S) = 32, t.y. sieros atomas yra 32 kartus sunkesnis nei 1/12 anglies atomo masės.
Absoliuti 1/12 anglies atomo masė yra atskaitos vienetas, kurio vertė apskaičiuojama labai tiksliai ir yra 1,66 * 10 -24 g arba 1,66 * 10 -27 kg. Ši atskaitos masė vadinama atominės masės vienetas (a.u.m.).
Cheminių elementų santykinių atominių masių verčių nereikia įsiminti, jos pateikiamos bet kuriame chemijos vadovėlyje ar žinyne, taip pat periodinėje D.I. Mendelejevas.
Skaičiuojant santykinių atominių masių vertes, įprasta suapvalinti iki sveikųjų skaičių.
Išimtis yra santykinė chloro atominė masė - chlorui naudojama 35,5 vertė.
1. Chemijos užduočių ir pratimų rinkinys: 8 klasė: į vadovėlį P.A. Oržekovskis ir kiti. „Chemija, 8 klasė“ / P.A. Oržekovskis, N.A. Titovas, F.F. Hegelis. – M.: AST: Astrel, 2006 m.
2. Ušakova O.V. Chemijos sąsiuvinis: 8 klasė: į vadovėlį P.A. Oržekovskis ir kiti.„Chemija. 8 klasė“ / O.V. Ušakova, P.I. Bespalovas, P.A. Oržekovskis; pagal. red. prof. P.A. Oržekovskis - M .: AST: Astrel: Profizdat, 2006. (p. 24-25)
3. Chemija: 8 klasė: vadovėlis. už generolą institucijos / P.A. Oržekovskis, L.M. Meshcheryakova, L.S. Pontakas. M.: AST: Astrel, 2005. (§10)
4. Chemija: inorg. chemija: vadovėlis. 8 ląstelėms. bendras institucijos / G.E. Rudzitis, FuGyu Feldman. - M .: Švietimas, UAB "Maskvos vadovėliai", 2009. (§§8,9)
5. Enciklopedija vaikams. 17 tomas. Chemija / skyrius. redagavo V.A. Volodinas, vadovaujantis. mokslinis red. I. Leenson. – M.: Avanta+, 2003 m.
Papildomi žiniatinklio ištekliai
1. Viena skaitmeninių švietimo išteklių kolekcija ().
2. Elektroninė žurnalo „Chemija ir gyvenimas“ versija ().
Namų darbai
p.24-25 Nr.1-7 iš chemijos darbo knygos: 8 klasė: į P.A. vadovėlį. Oržekovskis ir kiti.„Chemija. 8 klasė“ / O.V. Ušakova, P.I. Bespalovas, P.A. Oržekovskis; pagal. red. prof. P.A. Oržekovskis - M.: AST: Astrel: Profizdat, 2006 m.
atominė masė, santykinė atominė masė(pasenęs pavadinimas – atominis svoris) – atomo masės reikšmė, išreikšta atominės masės vienetais. Šiuo metu manoma, kad atominės masės vienetas yra 1/12 labiausiai paplitusio anglies izotopo 12C neutralaus atomo masės, todėl šio izotopo atominė masė pagal apibrėžimą yra lygiai 12. Bet kurio kito izotopo atominė masė nėra sveikas skaičius, nors yra artimas šio izotopo masės skaičiui (t. y. bendram nukleonų – protonų ir neutronų – jo branduolyje skaičiui). Skirtumas tarp izotopo atominės masės ir jo masės skaičiaus vadinamas masės pertekliumi (dažniausiai išreiškiamas MeV). Jis gali būti teigiamas ir neigiamas; jo atsiradimo priežastis – netiesinė branduolių surišimo energijos priklausomybė nuo protonų ir neutronų skaičiaus, taip pat protono ir neutrono masių skirtumas.
Atominės masės priklausomybė nuo masės skaičiaus yra tokia: masės perteklius teigiamas vandeniliui-1, didėjant masės skaičiui mažėja ir tampa neigiamas, kol pasiekiamas geležies-56 minimumas, tada pradeda augti ir didėja. iki teigiamų sunkiųjų nuklidų verčių. Tai atitinka faktą, kad dalijantis už geležį sunkesniems branduoliams išsiskiria energija, o dalijantis lengviesiems branduoliams reikia energijos. Priešingai, susiliejus už geležį lengvesniems branduoliams išsiskiria energija, o sunkesnių už geležį elementų sintezei reikia papildomos energijos.
Cheminio elemento atominė masė (taip pat "vidutinė atominė masė", "standartinė atominė masė") yra visų stabilių tam tikro cheminio elemento izotopų svertinė vidutinė atominė masė, atsižvelgiant į jų natūralų gausą Žemės pluta ir atmosfera. Būtent ši atominė masė pateikiama periodinėje lentelėje, ji naudojama stechiometriniams skaičiavimams. Elemento su sutrikdytu izotopų santykiu (pavyzdžiui, prisodrinto kokiu nors izotopu) atominė masė skiriasi nuo standartinės.
Molekulinė masė mo cheminis junginys vadinama jį sudarančių elementų atominių masių suma, padauginta iš stechiometrinių elementų koeficientų pagal junginio cheminę formulę. Griežtai kalbant, molekulės masė yra mažesnė už ją sudarančių atomų masę verte, lygia molekulės surišimo energijai. Tačiau šis masės defektas yra 9–10 dydžių mažesnis už molekulės masę ir jo galima nepaisyti.
Molio apibrėžimas (ir Avogadro skaičius) parenkamas taip, kad vieno molio medžiagos masė ( molinė masė), išreikštas gramais, buvo lygus šios medžiagos atominei (arba molekulinei) masei. Pavyzdžiui, geležies atominė masė yra 55,847. Todėl vienas molis geležies atomų (t. y. jų skaičius, lygus skaičiui Avogadro, 6,022 1023) yra 55,847 gramai.
Tiesioginis atomų ir molekulių masių palyginimas ir matavimas atliekamas naudojant masių spektrometrinius metodus.
Istorija
Iki septintojo dešimtmečio atominė masė buvo nustatyta taip, kad deguonies-16 izotopas turėjo 16 atominę masę (deguonies skalė). Tačiau deguonies-17 ir deguonies-18 santykis natūraliame deguonyje, kuris taip pat buvo naudojamas atominės masės skaičiavimams, lėmė dvi skirtingas atominių masių lenteles. Chemikai naudojo skalę, pagrįstą tuo, kad natūralaus deguonies izotopų mišinio atominė masė turėtų būti 16, o fizikai tą patį skaičių 16 priskyrė labiausiai paplitusio deguonies izotopo (turinčio aštuonis protonus ir aštuonis neutronus) atominei masei. .
Vikipedija
APIBRĖŽIMAS
Geležis yra dvidešimt šeštas periodinės lentelės elementas. Pavadinimas – Fe iš lotyniško „ferrum“. Įsikūręs ketvirtajame periode, VIIIB grupė. Nurodo metalus. Branduolinis krūvis yra 26.
Geležis yra labiausiai paplitęs metalas pasaulyje po aliuminio: ji sudaro 4% (masės) žemės plutos. Geležis būna įvairių junginių: oksidų, sulfidų, silikatų pavidalu. Geležis laisvoje būsenoje randama tik meteorituose.
Į svarbiausios rūdos Fe 3 O 4 magnetinė geležies rūda, Fe 2 O 3 raudonoji geležies rūda, 2Fe 2 O 3 × 3H 2 O rudoji geležies rūda ir FeCO 3 geležies rūda.
Geležis yra sidabrinis (1 pav.) kalus metalas. Jis puikiai tinka kalimui, valcavimui ir kitoms apdirbimo rūšims. Mechaninės savybės geležis labai priklauso nuo jos grynumo – nuo joje esančio net labai mažo kitų elementų kiekio.
Ryžiai. 1. Geležis. Išvaizda.
Geležies atominė ir molekulinė masė
Santykinė medžiagos molekulinė masė(M r) yra skaičius, rodantis, kiek kartų tam tikros molekulės masė yra didesnė nei 1/12 anglies atomo masės, ir elemento santykinė atominė masė(A r) – kiek kartų vidutinė cheminio elemento atomų masė yra didesnė už 1/12 anglies atomo masės.
Kadangi laisvoje būsenoje geležis egzistuoja monatominių Fe molekulių pavidalu, jos atominės ir molekulinės masės reikšmės yra vienodos. Jie lygūs 55,847.
Geležies alotropija ir alotropinės modifikacijos
Geležis sudaro dvi kristalines modifikacijas: α-geležies ir γ-geležies. Pirmasis iš jų turi kubinį kūno centrą, antrasis - kubinį veidą. α-geležis yra termodinamiškai stabili dviejuose temperatūrų diapazonuose: žemiau 912 o C ir nuo 1394 o C iki lydymosi temperatūros. Geležies lydymosi temperatūra yra 1539 ± 5 o C. Tarp 912 o C ir 1394 o C γ-geležis yra stabili.
α- ir γ-geležies stabilumo temperatūrų diapazonai atsiranda dėl abiejų modifikacijų Gibso energijos pokyčio, keičiantis temperatūrai. Esant žemesnei nei 912 o C ir aukštesnei kaip 1394 o C temperatūrai, α-geležies Gibso energija yra mažesnė už γ-geležies Gibso energiją, o 912 - 1394 o C diapazone - daugiau.
Geležies izotopai
Yra žinoma, kad gamtoje geležis gali būti keturių stabilių izotopų 54Fe, 56Fe, 57Fe ir 57Fe pavidalu. Jų masės skaičiai yra atitinkamai 54, 56, 57 ir 58. Geležies izotopo 54 Fe atomo branduolyje yra dvidešimt šeši protonai ir dvidešimt aštuoni neutronai, o likę izotopai nuo jo skiriasi tik neutronų skaičiumi.
Yra dirbtinių geležies izotopų, kurių masės skaičius yra nuo 45 iki 72, taip pat 6 izomerinės branduolių būsenos. Ilgiausias iš minėtų izotopų yra 60 Fe, kurio pusinės eliminacijos laikas yra 2,6 milijono metų.
geležies jonai
Elektroninė formulė, rodanti geležies elektronų pasiskirstymą per orbitą, yra tokia:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 .
Dėl cheminės sąveikos geležis atiduoda valentinius elektronus, t.y. yra jų donoras ir virsta teigiamai įkrautu jonu:
Fe 0 -2e → Fe 2+;
Fe 0 -3e → Fe 3+.
Geležies molekulė ir atomas
Laisvoje būsenoje geležis egzistuoja monatominių Fe molekulių pavidalu. Štai keletas savybių, apibūdinančių geležies atomą ir molekulę:
geležies lydiniai
Iki XIX amžiaus geležies lydiniai daugiausia buvo žinomi dėl lydinių su anglimi, kurie gavo plieno ir ketaus pavadinimus. Tačiau ateityje buvo sukurti nauji geležies lydiniai, kuriuose yra chromo, nikelio ir kitų elementų. Šiuo metu geležies lydiniai skirstomi į anglinį plieną, ketų, legiruotą plieną ir specialių savybių plieną.
Technologijoje geležies lydiniai dažniausiai vadinami juodaisiais metalais, o jų gamyba – juodąja metalurgija.
Problemų sprendimo pavyzdžiai
| Pratimas | Medžiagos elementinė sudėtis yra tokia: geležies elemento masės dalis yra 0,7241 (arba 72,41%), deguonies masės dalis yra 0,2759 (arba 27,59%). Išveskite cheminę formulę. |
| Sprendimas | Elemento X masės dalis HX kompozicijos molekulėje apskaičiuojama pagal šią formulę: ω (X) = n × Ar (X) / M (HX) × 100%. Geležies atomų skaičių molekulėje pažymėkime „x“, deguonies atomų skaičių – „y“. Raskime atitinkamas geležies ir deguonies elementų santykines atomines mases (santykinių atominių masių reikšmės, paimtos iš D.I. Mendelejevo periodinės lentelės, bus suapvalintos iki sveikųjų skaičių). Ar(Fe) = 56; Ar(O) = 16. Elementų procentinę dalį padalijame iš atitinkamų santykinių atomų masių. Taigi, mes rasime ryšį tarp atomų skaičiaus junginio molekulėje: x:y= ω(Fe)/Ar(Fe) : ω(O)/Ar(O); x:y = 72,41/56: 27,59/16; x:y = 1,29: 1,84. Paimkime mažiausią skaičių kaip vieną (t. y. visus skaičius padalinsime iš mažiausio skaičiaus 1,29): 1,29/1,29: 1,84/1,29; Todėl paprasčiausia geležies ir deguonies derinio formulė yra Fe 2 O 3. |
| Atsakymas | Fe2O3 |
Geležies fizinės savybės priklauso nuo jos grynumo laipsnio. Gryna geležis yra gana lankstus sidabriškai baltas metalas. Geležies tankis yra 7,87 g/cm 3 . Lydymosi temperatūra yra 1539 ° C. Skirtingai nuo daugelio kitų metalų, geležis pasižymi magnetinėmis savybėmis.
Gryna geležis yra gana stabili ore. AT praktinė veikla padengta geležimi, kurioje yra priemaišų. Kaitinama geležis gana aktyviai veikia prieš daugelį nemetalų. Apsvarstykite geležies chemines savybes naudodamiesi sąveikos su tipiniais nemetalais: deguonimi ir siera pavyzdžiu.
Deguonyje deginant geležį, susidaro geležies ir deguonies junginys, vadinamas geležies nuosėdomis. Reakciją lydi šilumos ir šviesos išsiskyrimas. Padarykime cheminės reakcijos lygtį:
3Fe + 2O 2 = Fe 3 O 4
Kaitinant, geležis smarkiai reaguoja su siera, sudarydama geležies (II) sulfidą. Reakciją taip pat lydi šilumos ir šviesos išsiskyrimas. Padarykime cheminės reakcijos lygtį:
Geležis plačiai naudojama pramonėje ir kasdieniame gyvenime. Geležies amžius – žmonijos raidos era, prasidėjusi I tūkstantmečio pr. Kr. pradžioje, susijusi su geležies lydymo ir geležinių įrankių bei karinių ginklų gamybos plitimu. geležies amžius atėjo pakeisti bronzos amžių. Plienas pirmą kartą pasirodė Indijoje dešimtajame amžiuje prieš Kristų, ketaus tik viduramžiais. Gryna geležis naudojama transformatorių ir elektromagnetų šerdims gaminti, taip pat specialių lydinių gamyboje. Praktikoje dažniausiai naudojami geležies lydiniai: ketus ir plienas. Ketus naudojamas liejinių ir plieno gamyboje, plienas – kaip konstrukcinės ir įrankių medžiagos, atsparios korozijai.
Atmosferos deguonies ir drėgmės veikiami geležies lydiniai virsta rūdimis. Rūdžių gaminį galima apibūdinti cheminė formulė Fe 2 O 3 · xH 2 O. Šeštadalis lydyto ketaus miršta nuo rūdžių, todėl kovos su korozija klausimas yra labai aktualus. Apsaugos nuo korozijos metodai yra labai įvairūs. Svarbiausi iš jų: metalo paviršiaus apsauga danga, lydinių su antikorozinėmis savybėmis kūrimas, elektrocheminės priemonės, terpės sudėties keitimas. Apsauginės dangos skirstomos į dvi grupes: metalines (geležies dengimas cinku, chromu, nikeliu, kobaltu, variu) ir nemetalines (lakai, dažai, plastikai, guma, cementas). Į lydinių sudėtį įdėjus specialių priedų, gaunamas nerūdijantis plienas.
Geležis. Geležies paplitimas gamtoje
Geležis. Geležies pasiskirstymas gamtoje. Biologinis vaidmuo liauka
Antras svarbus cheminis elementas po deguonies, kurio savybės bus tiriamos, yra Ferum. Geležis yra metalinis elementas, kuris sudaro paprastą medžiagą – geležį. Geležis yra periodinės lentelės antrinio pogrupio aštuntosios grupės narys. Pagal grupės numerį didžiausias geležies valentingumas turėtų būti aštuoni, tačiau junginiuose Ferum dažniau pasižymi dviejų ir trijų, taip pat žinomi junginiai, kurių geležies valentingumas yra šeši. Santykinė geležies atominė masė yra penkiasdešimt šeši.
Pagal savo gausą žemės plutos sudėtyje Ferum užima antrą vietą tarp metalinių elementų po aliuminio. Geležies masės dalis žemės plutoje yra beveik penki procentai. Gimtojoje valstybėje geležis yra labai reta, dažniausiai tik meteoritų pavidalu. Būtent tokia forma mūsų protėviai galėjo pirmą kartą pažinti geležį ir vertinti ją kaip labai gera medžiagaįrankių gamybai. Manoma, kad geležis yra pagrindinė branduolio sudedamoji dalis pasaulis. Ferumas gamtoje dažniau randamas kaip rūdų dalis. Svarbiausios iš jų: magnetinė geležies rūda (magnetitas) Fe 3 O 4, raudonoji geležies rūda (hematitas) Fe 2 O 3, rudoji geležies rūda (limonitas) Fe 2 O 3 nH 2 O, geležies piritas (piritas) FeS 2 , geležies rūda (sideritas) FeCO3, goetitas FeO (OH). Daugelio vandenyse mineralinių šaltinių yra Fe (HCO 3) 2 ir kai kurių kitų geležies druskų.
Geležis yra gyvybiškai svarbus elementas. Žmogaus, kaip ir gyvūnų, organizme geležies yra visuose audiniuose, tačiau didžiausia jo dalis (apie tris gramus) yra susitelkusi kraujo rutuliuose. Geležies atomai užima centrinę vietą hemoglobino molekulėse; hemoglobinas turi jiems savo spalvą ir gebėjimą prijungti ir atskirti deguonį. Geležis dalyvauja deguonies pernešimo iš plaučių į kūno audinius procese. Kūno paros poreikis Ferum yra 15-20 mg. Visas jo kiekis patenka į žmogaus organizmą su augalinis maistas ir mėsa. Netekus kraujo, Ferum poreikis viršija kiekį, kurį žmogus gauna su maistu. Geležies trūkumas organizme gali sukelti būklę, kuriai būdingas raudonųjų kraujo kūnelių ir hemoglobino kiekio kraujyje sumažėjimas. Geležies papildus galima vartoti tik taip, kaip nurodė gydytojas.
Cheminės deguonies savybės. Ryšio reakcijos
Cheminės deguonies savybės. Ryšio reakcijos. Oksidų, oksidacijos ir degimo samprata. Degimo pradžios ir pasibaigimo sąlygos
Kaitinamas deguonis intensyviai reaguoja su daugeliu medžiagų. Jei į indą su deguonimi įpilsite įkaitusią anglis C, ji įkaista ir sudega. Padarykime cheminės reakcijos lygtį:
C + ONaHCO 2 = CONaHCO 2
Siera S dega deguonyje ryškiai mėlyna liepsna ir susidaro dujinė medžiaga – sieros dioksidas. Padarykime cheminės reakcijos lygtį:
S + ONaHCO 2 = SONaHCO 2
Fosforas P dega deguonyje ryškia liepsna ir susidaro tiršti balti dūmai, susidedantys iš kietų fosforo (V) oksido dalelių. Padarykime cheminės reakcijos lygtį:
4P + 5ONaHCO 2 = 2PNaHCO 2 ONaHCO 5
Deguonies sąveikos su anglimi, siera ir fosforu reakcijų lygtis vienija tai, kad iš dviejų pradinių medžiagų kiekvienu atveju susidaro viena medžiaga. Tokios reakcijos, kurių pasekoje iš kelių pradinių medžiagų (reagentų) susidaro tik viena medžiaga (produktas), vadinamos komunikacijos reakcijomis.
Deguonies sąveikos su nagrinėjamomis medžiagomis (anglimis, siera, fosforu) produktai yra oksidai. Oksidai vadinami sudėtingos medžiagos kuriame yra du elementai, iš kurių vienas yra deguonis. Beveik visi cheminiai elementai sudaro oksidus, išskyrus kai kuriuos inertinius elementus: helią, neoną, argoną, kriptoną ir ksenoną. Yra šiek tiek cheminiai elementai, kurie nėra tiesiogiai sujungti su deguonimi, pavyzdžiui, Aurum.
Cheminės medžiagų sąveikos su deguonimi reakcijos vadinamos oksidacijos reakcijomis. „Oksidacijos“ sąvoka yra bendresnė nei „degimo“ sąvoka. Degimas yra cheminė reakcija, kurios metu vyksta medžiagų oksidacija kartu su šilumos ir šviesos išsiskyrimu. Kad užsidegtų, šias sąlygas: glaudus oro sąlytis su degiomis medžiagomis ir kaitinimas iki užsidegimo temperatūros. Įvairių medžiagų užsidegimo temperatūra yra skirtingos reikšmės. Pavyzdžiui, medienos dulkių užsidegimo temperatūra yra 610 ° C, sieros - 450 ° C, baltasis fosforas 45 - 60 ° C. Norint išvengti degimo, būtina sužadinti bent vieną iš nurodytų sąlygų. Tai yra, būtina pašalinti degiąją medžiagą, atvėsinti ją žemiau užsidegimo temperatūros, blokuoti deguonies patekimą. Degimo procesai mus lydi kasdieniame gyvenime, todėl kiekvienas žmogus turi žinoti degimo pradžios ir pabaigos sąlygas, taip pat stebėti būtinų taisyklių degių medžiagų tvarkymas.
Deguonies ciklas gamtoje
Deguonies ciklas gamtoje. Deguonies naudojimas, jo biologinis vaidmuo
Maždaug ketvirtadalį visų gyvųjų medžiagų atomų sudaro deguonis. Kadangi bendras deguonies atomų skaičius gamtoje yra pastovus, dėl kvėpavimo ir kitų procesų iš oro pasišalinus deguoniui, turi įvykti jo papildymas. Svarbiausias deguonies šaltinis negyvoji gamta yra anglies dioksidas ir vanduo. Deguonis į atmosferą patenka daugiausia dėl fotosintezės proceso, kuris apima šį-du. Svarbus deguonies šaltinis yra Žemės atmosfera. Dalis deguonies susidaro viršutinės dalys atmosferą dėl vandens disociacijos veikiant saulės radiacija. Dalį deguonies išskiria žalieji augalai fotosintezės procese su pelenais-du-o ir tai yra-du. Savo ruožtu atmosferos it-o-du susidaro dėl gyvūnų degimo ir kvėpavimo reakcijų. Atmosferos o-du sunaudojama ozono susidarymui viršutinėse atmosferos dalyse, oksidaciniam uolienų dūlėjimui, gyvūnų kvėpavimo procese ir degimo reakcijose. T-dviejų pavertimas tse-du veda prie energijos išlaisvinimo, atitinkamai, energija turi būti skirta šio-dviejų pavertimui o-du. Ši energija yra Saulė. Taigi gyvybė Žemėje priklauso nuo cikliškumo cheminiai procesai tapo įmanoma dėl saulės energijos.
Deguonis naudojamas dėl jo cheminių savybių. Deguonis plačiai naudojamas kaip oksidatorius. Jis naudojamas metalų suvirinimui ir pjovimui chemijos pramonė- gauti įvairių junginių ir kai kuriuos suintensyvinti gamybos procesai. Kosmoso technikoje deguonis naudojamas vandeniliui ir kitam kurui deginti, aviacijoje – skrendant toliau dideli aukščiai, chirurgijoje – palaikyti dusuliuojančius pacientus.
Biologinį deguonies vaidmenį lemia jo gebėjimas palaikyti kvėpavimą. Žmogus, kvėpuodamas vieną minutę, vidutiniškai suvartoja 0,5 dm3 deguonies, per dieną - 720 dm3, o per metus - 262,8 m3 deguonies.
1. Kalio permanganato terminio skilimo reakcija. Padarykime cheminės reakcijos lygtį:
Medžiaga kalis-manganas-o-4 yra plačiai paplitęs kasdieniame gyvenime pavadinimu "kalio permanganatas". Susidariusį deguonį parodo rūkstantis deglas, kuris ryškiai mirksi ties prietaiso, kuriame vyksta reakcija, dujų išleidimo vamzdžio anga arba įvedant į indą su deguonimi.
2. Vandenilio peroksido skilimo reakcija dalyvaujant mangano (IV) oksidui. Padarykime cheminės reakcijos lygtį:
Vandenilio peroksidas taip pat gerai žinomas iš kasdienio gyvenimo. Jis gali būti naudojamas įbrėžimams ir nedidelėms žaizdoms gydyti (kiekvienoje pirmosios pagalbos vaistinėlėje turi būti 2–2 masės pelenų tirpalas). Daugelis cheminės reakcijos pagreitėja esant tam tikroms medžiagoms. AT Ši byla vandenilio peroksido skilimo reakcijas pagreitina manganas-o-du, tačiau pats manganas-o-du nėra suvartojamas ir nėra reakcijos produktų dalis. Manganas-o-du yra katalizatorius.
Katalizatoriai yra medžiagos, kurios pagreitina chemines reakcijas, tačiau pačios nėra sunaudojamos. Katalizatoriai ne tik plačiai naudojami chemijos pramonėje, bet ir atlieka tam tikrą vaidmenį svarbus vaidmuoŽmogaus gyvenime. Biocheminių procesų reguliavime dalyvauja natūralūs katalizatoriai, kurie vadinami fermentais.
Deguonis, kaip minėta anksčiau, yra šiek tiek sunkesnis už orą. Todėl jį galima surinkti prispaudžiant orą į indą, padėtą su anga į viršų.
Jį atstatė anglimi krosnyje (žr.), sutvarkė duobėje; dumplėmis pumpavo į krosnį, gaminį - kritsą smūgiais atskirdavo nuo šlako ir iš jo kaldavo įvairius gaminius. Tobulėjant pūtimo būdams ir didėjant židinio aukščiui, procesas didėjo ir dalis karbonizavosi, t.y. buvo gautas ketus; šis gana trapus produktas buvo laikomas atliekų produktu. Iš čia ir kilęs pavadinimas pigūs geležis, pig iron – angliškai pig iron. Vėliau pastebėta, kad kraunant į krosnį ne geležį, o ketų, gaunamas ir mažai anglies dioksido išskiriantis geležies žydėjimas, o toks dviejų etapų procesas (žr. Chrychny perskirstymą) pasirodė pelningesnis nei neapdorotas. XII-XIII a. rėkimo būdas jau buvo paplitęs. XIV amžiuje ketus pradėtas lydyti ne tik kaip pusgaminis tolesniam perdirbimui, bet ir kaip medžiaga įvairiems gaminiams lieti. Židinio rekonstrukcija į kasyklą („domnitsa“), o vėliau į aukštakrosnę, taip pat datuojama tuo pačiu laiku. XVIII amžiaus viduryje Europoje pradėtas naudoti tiglio plieno gavimo procesas, kuris Sirijoje buvo žinomas dar m ankstyvas laikotarpis viduramžiais, bet vėliau buvo užmirštas. Šiuo metodu plienas buvo gaunamas lydant metalų mišinius mažuose (tigliuose) iš labai ugniai atsparios masės. AT Paskutinis ketvirtis 18-ojo amžiaus ėmė vystytis pūlingas ketaus persiskirstymo į liepsną atspindintį židinį procesas (žr. Pudulys). XVIII – XIX amžiaus pradžios pramonės revoliucija, garo mašinos išradimas, konstrukcija geležinkeliai, dideli tiltai ir garo laivynas sukėlė didžiulį poreikį ir jo. Tačiau visi esami gamybos būdai negalėjo patenkinti rinkos poreikių. Masinė plieno gamyba prasidėjo tik XIX amžiaus viduryje, kai buvo sukurti Bessemer, Thomas ir židinio procesai. XX amžiuje atsirado ir plačiai paplito elektrinio plieno gamybos procesas, suteikiantis aukštos kokybės plieną.
pasiskirstymas gamtoje. Pagal kiekį litosferoje (4,65 % masės) jis užima antrąją vietą (pirmoje). Jis energingai migruoja žemės plutoje, sudarydamas apie 300 (ir kt.). aktyviai dalyvauja magminiuose, hidroterminiuose ir supergeniniuose procesuose, su kuriais siejamas formavimasis įvairių tipų jo telkiniai (žr. Geležis). - žemės gelmėse, ji kaupiasi ankstyvosios stadijos magma, ultrabazinėje (9,85%) ir bazinėje (8,56%) (granituose jo yra tik 2,7%). B kaupiasi daugelyje jūrinių ir žemyninių nuosėdų, sudarydamos nuosėdines nuosėdas.
Toliau pateikiamos fizinės savybės, daugiausia susijusios su tomis, kurių bendras priemaišų kiekis yra mažesnis nei 0,01 % masės:
Savotiška sąveika su Koncentruotas HNO 3 (tankis 1,45 g / cm 3) pasyvuoja dėl apsauginės oksido plėvelės atsiradimo ant jo paviršiaus; labiau atskiestas HNO 3 ištirpsta susidarant Fe 2+ arba Fe 3+, atsikuriant į MH 3 arba N 2 O ir N 2 .
Kvitas ir paraiška. Grynas gaunamas santykinai nedideliais vandens kiekiais. Kuriamas būdas tiesiogiai gauti iš. Palaipsniui padidina pakankamai grynos gamybos tiesiogiai iš rūdos koncentratų arba anglies santykinai žemu lygiu.
Svarbiausias moderni technologija. AT gryna forma dėl mažos vertės praktiškai nenaudojamas, nors kasdieniame gyvenime plieno ar ketaus gaminiai dažnai vadinami „geležimi“. Didelė dalis naudojama labai skirtingos sudėties ir savybių pavidalu. Tai sudaro apie 95% visų metalo gaminių. Turtingas (daugiau kaip 2 % masės) – ketus, lydytas aukštakrosnėje iš sodrintos geležies (žr. Aukštakrosnių gamyba). Įvairių rūšių plienas (sudėtis mažesnis nei 2 % masės) lydomas iš ketaus krosnyje ir elektra bei konverteriuose pertekliu (išdeginant), pašalinant kenksmingas priemaišas (daugiausia S, P, O) ir pridedant legiravimo elementų. (žr. Martenovskaya, Konverteris). Labai legiruotas plienas (su dideliu kiekiu kitų elementų) lydomas elektros lanku ir indukcija. Plieno gamyboje ir ypač svarbiems tikslams naudojami nauji procesai - vakuuminis, elektros šlako perlydymas, lydymas plazminiu ir elektronų pluoštu ir kt.. Kuriami metodai plieno lydymui nuolat veikiančiuose agregatuose, kurie užtikrina aukštą proceso kokybę ir automatizavimą.
Jos pagrindu kuriamos medžiagos, galinčios atlaikyti aukštą ir žemą bei aukštą, agresyvią aplinką, didelę kintamąją įtampą, branduolinę spinduliuotę ir kt. Gamyba ir ji nuolat auga. 1971 metais SSRS buvo išlydyta 89,3 mln. tonų ketaus ir 121 mln. tonų plieno.
L. A. Shvartsman, L. V. Vanyukova.
Nuo seniausių laikų jis buvo naudojamas kaip meninė medžiaga Egipte (galvai iš Tutanchamono kapo netoli Tėbų, XIV a. vidurio prieš Kristų, Ašmolio muziejuje, Oksforde), Mesopotamijoje (durklai rasti netoli Karkemišo, 500 m. pr. Kr., Britų muziejus, Londonas)