Mengyelejev periodikus rendszerében a szén a hatodik elem. Atomtömege 12.
A szén a Mengyelejev-rendszer második periódusában és a rendszer negyedik csoportjában található.
A periódusszám azt mutatja, hogy a szén hat elektronja két energiaszinten van.
A negyedik csoportszám pedig azt mondja, hogy a szénnek négy elektronja van a külső energiaszinten. Közülük kettő páros s-elektronok, a másik kettő pedig nincs párosítva R-elektronok.
A szénatom külső elektronrétegének szerkezete a következő sémákkal fejezhető ki:
Ezeken a diagramokon minden cella külön elektronpályát jelent, a nyíl pedig a pályán elhelyezkedő elektront. Egy cellán belül két nyíl két elektron, amelyek ugyanazon a pályán vannak, de ellentétes spinjük van.
Amikor egy atomot gerjesztenek (amikor energiát adnak át neki), az egyik páros S-elektronok foglalják el R- orbitális.
Egy gerjesztett szénatom négy kovalens kötés kialakításában vehet részt. Ezért vegyületeinek túlnyomó többségében a szén négy vegyértéket mutat.
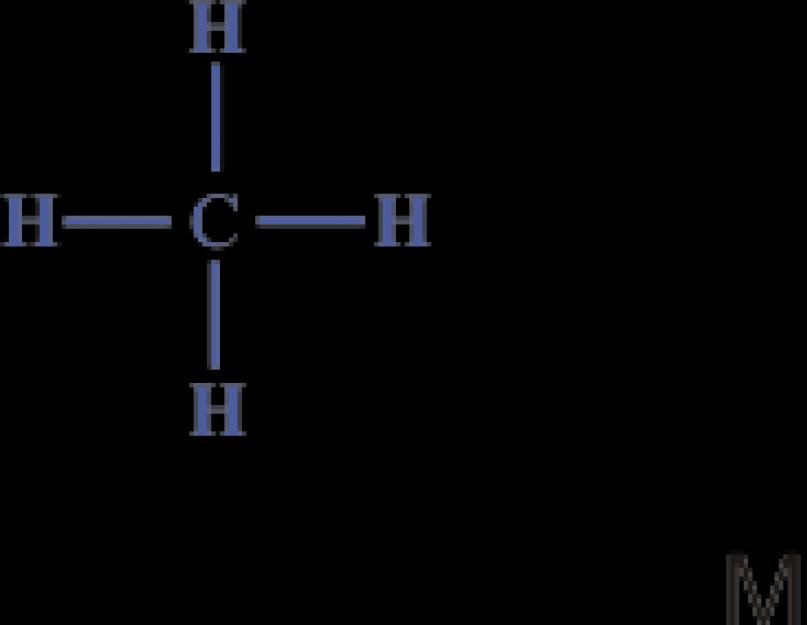
Tehát a legegyszerűbb szerves vegyület szénhidrogén-metán összetételű CH 4. Szerkezete szerkezeti vagy elektronikus képletekkel fejezhető ki:

Elektronikus képletábra azt mutatja, hogy a metánmolekulában a szénatomnak van egy stabil nyolcelektronos külső héja, a hidrogénatomoknak pedig egy stabil kételektronos héja van.
A metánban (és más hasonló vegyületekben) lévő szén mind a négy kovalens kötése egyenértékű és szimmetrikusan irányított a térben. A szénatom mintegy a tetraéder (egy szabályos négyszögletű piramis) középpontjában van, és a hozzá kapcsolódó négy atom (metán esetében négy hidrogénatom) a tetraéder csúcsaiban található.

Bármely kötéspár iránya közötti szögek azonosak, és 109 fok 28 perc.
Ennek az az oka, hogy egy szénatomban, amikor kovalens kötést hoz létre négy másik atommal, egyből s- és három p-pályák ennek eredményeként sp 3-hibridizációk jönnek létre négy szimmetrikusan elhelyezkedő térben hibrid sp 3-pályák nyúltak a tetraéder csúcsai felé.

A szén tulajdonságainak jellemzői.
A külső energiaszinten lévő elektronok száma a fő tényező, amely meghatározza egy elem kémiai tulajdonságait.
A periódusos rendszer bal oldalán alacsony töltöttségű külső elektronikus vízszintezővel rendelkező elemek találhatók. Az első csoport elemei egy elektronnal rendelkeznek a külső szinten, a második csoport elemei kettő.
E két csoport elemei az fémek. Könnyen oxidálódnak, pl. elveszítik külső elektronjaikat és pozitív ionokká alakulnak.
A periódusos rendszer jobb oldalán éppen ellenkezőleg nem fémek (oxidálószerek). A fémekhez képest nagyszámú protont tartalmazó magjuk van. Egy ilyen masszív atommag sokkal erősebb vonzást biztosít az elektronfelhő számára.
Az ilyen elemek nagy nehezen elvesztik elektronjaikat, de nem idegenkednek attól, hogy további elektronokat adjanak hozzá más atomokból, pl. oxidálják őket, és önmaguk egyidejűleg negatív ionná alakulnak.
A periódusos rendszer csoportszámának növekedésével az elemek fémes tulajdonságai gyengülnek, és növekszik más elemek oxidáló képessége.
A szén a negyedik csoportba tartozik, i.e. csak középen a fémek között, amelyek könnyen adják az elektronokat, és a nemfémek között, amelyek könnyen befogadják ezeket az elektronokat.
Emiatt a szénnek nincs kifejezett tendenciája az elektronok adományozására vagy elnyerésére.
szénláncok.
A szén kizárólagos tulajdonsága, amely diverzitást okoz szerves vegyületek, az atomjainak azon képessége, hogy erős kovalens kötésekkel kapcsolódjanak egymáshoz, szinte korlátlan hosszúságú szénsémákat képezve.

A szén mellett az azonos atomokból álló láncok analógját képezik a IV csoportból - szilícium. Az ilyen láncok azonban legfeljebb hat Si atomot tartalmaznak. A kénatomok hosszú láncai ismertek, de az ezeket tartalmazó vegyületek törékenyek.
Az összekapcsolásban részt nem vevő szénatomok vegyértékeit más atomok vagy csoportok hozzáadására használjuk (szénhidrogénekben, hidrogén hozzáadására).
Tehát az etán szénhidrogének ( C 2 H 6) és propán ( C 3 H 8) két, illetve három szénatomos láncot tartalmaznak. Szerkezetüket a következő szerkezeti és elektronikus képletek fejezik ki:

Több száz vagy több szénatomot tartalmazó vegyületek ismertek.
A szénkötések tetraéderes orientációja miatt a láncban szereplő atomjai nem egyenes vonalban, hanem cikkcakkos mintázatban helyezkednek el. Sőt, az atomok kötéstengely körüli forgásának lehetősége miatt a lánc a térben eltarthat különféle formák(konformációk):

Az ilyen láncszerkezet lehetővé teszi, hogy a terminális vagy más, nem szomszédos szénatomok közeledjenek egymáshoz. Az atomok közötti kötés megjelenése következtében a szénláncok gyűrűkké (ciklusokba) zárhatók, például:

A szerves vegyületek sokféleségét tehát az is meghatározza, hogy azonos számú szénatommal egy molekulában lehetségesek a nyitott, nyílt szénatomláncú vegyületek, illetve olyan anyagok, amelyek molekulái ciklusokat tartalmaznak.
Egyszerű és többszörös kötvények.
Az egy pár általánosított elektron által alkotott szénatomok közötti kovalens kötéseket egyszerű kötéseknek nevezzük.

A szénatomok közötti kötést nem egy, hanem két vagy három közös elektronpár hozhatja létre. Ezután többszörös kettős vagy hármas kötéssel rendelkező láncokat kapunk. Ezeket a kapcsolatokat a következőképpen ábrázolhatjuk:
A legegyszerűbb, többszörös kötést tartalmazó vegyületek a szénhidrogének etilén(kettős kötéssel) és acetilén(hármas kötéssel):

A többszörös kötéssel rendelkező szénhidrogéneket telítetlennek vagy telítetlennek nevezzük. Az etilén és az acetilén két homológ sorozat - az etilén és az acetilén szénhidrogének - első képviselői.
Ebben a cikkben egy olyan elemet fogunk megvizsgálni, amely a D.I. periódusos rendszerének része. Mengyelejev, nevezetesen a szén. A modern nómenklatúrában C szimbólummal jelölik, a tizennegyedik csoportba tartozik, és a második időszak "résztvevője", a hatodik sorszámmal rendelkezik, és a.m.u. = 12,0107.
Atompályák és hibridizációjuk
Kezdjük a szén vizsgálatát pályáival és azok hibridizációjával - főbb jellemzőivel, amelyeknek köszönhetően a mai napig meglepi a tudósokat szerte a világon. Mi a felépítésük?
A szénatom hibridizációja úgy van elrendezve, hogy a vegyértékelektronok három pályán foglalnak helyet, nevezetesen: egy a 2s pályán, kettő pedig a 2p pályán. A három orbitál közül az utolsó kettő 90 fokos szöget zár be egymással, és a 2s pálya gömbszimmetriájú. A vizsgált pályák ilyen elrendezési formája azonban nem teszi lehetővé számunkra annak megértését, hogy a szerves vegyületekbe belépő szén miért 120, 180 és 109,5 fokos szöget képez. A szénatom elektronszerkezetének képlete a következő formában fejeződik ki: (He) 2s 2 2p 2 .
A felmerült ellentmondás feloldása az atompályák hibridizációs koncepciójának forgalomba hozatalával történt. A C triéderes, változatos természetének megértéséhez hibridizációjának három ábrázolási formáját kellett megalkotni. Ennek a koncepciónak a kialakulásához és fejlődéséhez a fő hozzájárulást Linus Pauling tette.

Fizikai karaktertulajdonságok
A szénatom szerkezete meghatározza számos fizikai természetű jellemző jelenlétét. Ennek az elemnek az atomjai egy egyszerű anyagot - szén - alkotnak, amely módosul. Szerkezetének változásai különböző minőségi jellemzőket adhatnak a kialakult anyagnak. A jelenlét oka egy nagy szám A szén módosulása abban rejlik, hogy képes különféle kémiai jellegű kötéseket létrehozni és kialakítani.
A szénatom szerkezete változhat, ami lehetővé teszi, hogy bizonyos számú izotópformája legyen. A természetben található szén két stabil állapotú izotóp - 12 C és 13 C -, valamint egy radioaktív tulajdonságokkal rendelkező izotóp - 14 C - felhasználásával jön létre. Az utolsó izotóp a földkéreg felső rétegeiben és a légkörben koncentrálódik. A kozmikus sugárzásnak, nevezetesen annak neutronjainak a nitrogénatomok magjára gyakorolt hatására 14 C radioaktív izotóp képződik, amely a huszadik század ötvenes éveinek közepe után mesterséges termékként kezdett bekerülni a környezetbe. atomerőművek működése során, illetve hidrogénbomba alkalmazása következtében. A 14 C bomlási folyamatán alapul a radiokarbonos kormeghatározási technika, amely megtalálta a helyét széles körű alkalmazás a régészetben és a geológiában.
A szén módosítása allotróp formában
A természetben sok olyan anyag van, amely széntartalmú. Az ember a szénatom szerkezetét saját céljaira használja különféle anyagok létrehozása során, beleértve:
- Kristályos szén (gyémántok, szén nanocsövek, szálak és huzalok, fullerének stb.).
- Amorf szén (aktív szén, különböző fajták koksz, korom, korom, nanohab és antracit).
- A szén klaszterformái (dikarbonok, nanokúpok és asztralénvegyületek).
Az atomszerkezet szerkezeti jellemzői

A szénatom elektronszerkezete eltérő geometriával rendelkezhet, ami az általa birtokolt pályák hibridizációs szintjétől függ. A geometriának 3 fő típusa van:
- Tetraéder - négy elektron elmozdulása miatt jön létre, amelyek közül egy s-, három pedig p-elektronhoz tartozik. A C atom központi helyet foglal el a tetraéderben, és négy egyenértékű szigma kötéssel kapcsolódik a tetraéder tetejét elfoglaló többi atomhoz. Ezzel a geometriai elrendezéssel a szén allotróp formái, például gyémánt és lonsdaleit alakíthatók ki.
- Trigonális - megjelenését három pálya elmozdulásának köszönheti, amelyek közül egy s- és két p-. Három szigma kötés van, amelyek egyenértékű helyzetben vannak egymással; közös síkban fekszenek és 120 fokos szöget zárnak be egymáshoz képest. A szabad p-pálya merőlegesen helyezkedik el a szigma kötések síkjára. A grafitnak hasonló szerkezeti geometriája van.
- Diagonális - az s- és p-elektronok keveredése miatt jelenik meg (sp hibridizáció). Az elektronfelhők az általános irány mentén húzódnak, és aszimmetrikus súlyzó formát öltenek. A szabad elektronok π kötéseket hoznak létre. A szénnek ez a geometriai szerkezete a karabély megjelenését idézi elő, amely a módosítás egy speciális formája.
Szénatomok a természetben
A szénatom szerkezetét és tulajdonságait az ember régóta figyelembe vette, és számos különféle anyag előállítására használta. Ennek az elemnek az atomjai, a különféle kémiai kötések kialakítására való egyedi képességük és a pályák hibridizációjának jelenléte miatt, sok különböző allotróp módosulást hoznak létre egyetlen elem részvételével, azonos típusú, szénatomokból.

A természetben szén található földkéreg; gyémántok, grafitok, különféle éghető anyagok formáját ölti természetes erőforrások például olaj, antracit, barnaszén, agyagpala, tőzeg stb. Az emberek által használt gázok része energiaipar. A dioxid összetételében lévő szén kitölti a Föld hidroszféráját és légkörét, és a levegőben eléri a 0,046% -ot, a vízben pedig akár hatvanszor többet.
Az emberi szervezetben a C körülbelül 21% -kal egyenlő mennyiségben található, és főként a vizelettel és a kilélegzett levegővel ürül. Ugyanez az elem vesz részt a biológiai körforgásban, a növények felszívják és a fotoszintézis folyamatai során fogyasztják.
A szénatomok, mivel képesek különféle kovalens kötéseket létesíteni és láncokat építeni, sőt azokból ciklusokat is létrehozhatnak, hatalmas mennyiségű szerves anyagot tudnak létrehozni. Ezenkívül ez az elem része szoláris légkör hidrogénnel és nitrogénnel alkotott vegyületekben lévén.
A kémiai természet tulajdonságai

Most vegyük figyelembe a szénatom szerkezetét és tulajdonságait kémiai szempontból.
Fontos tudni, hogy a szén közömbös tulajdonságokat mutat normál hőmérsékleten, de redukáló tulajdonságokat mutathat nekünk a magas hőmérsékletek. A fő oxidációs állapotok: + - 4, néha +2 és +3 is.
Részt vesz a reakciókban nagyszámú elemmel. Reagálhat vízzel, hidrogénnel, halogénekkel, alkálifémekkel, savakkal, fluorral, kénnel stb.
A szénatom szerkezete hihetetlenül nagy számú anyagot eredményez, amelyek külön osztályba tartoznak. Az ilyen vegyületeket szervesnek nevezik, és C-n alapulnak. Ez az elem atomjainak polimerláncokat képező tulajdonsága miatt lehetséges. A leghíresebb és legkiterjedtebb csoportok közé tartoznak a fehérjék (fehérjék), a zsírok, a szénhidrátok és a szénhidrogén vegyületek.
Működési módszerek
A szénatom egyedi szerkezete és a kísérő tulajdonságai miatt az elemet széles körben használják az emberek, például ceruzák készítésekor, fémtégelyek olvasztásakor - itt grafitot használnak. A gyémántokat csiszolóanyagként, ékszerként, fúrószárként stb.
A farmakológia és az orvostudomány is foglalkozik a szén különféle vegyületekben való felhasználásával. Ez az elem az acél része, minden szerves anyag alapjául szolgál, részt vesz a fotoszintézis folyamatában stb.
Elem toxicitás

A szén elem atomjának szerkezete az élő anyagokra veszélyes hatást tartalmaz. A szén a hőerőművek széntüzelése eredményeként kerül be a körülöttünk lévő világba, része az autók által termelt gázoknak, szénkoncentrátum esetén stb.
Az aeroszolok széntartalma magas, ami az emberi megbetegedések százalékos arányának növekedését vonja maga után. Leggyakrabban a felső légutak és a tüdő érintett. Néhány betegség professzionális kategóriába sorolható, például a porhörghurut és a pneumokoniózis csoportba tartozó betegségek.
A 14 C mérgező, hatásának erősségét a β-részecskékkel való sugárzási kölcsönhatás határozza meg. Ez az atom a biológiai molekulák összetételének része, beleértve azokat is, amelyek a dezoxi- és ribonukleinsavak. Megengedett mennyiség 14 C a levegőben munkaterület 1,3 Bq / l jelet kell figyelembe venni. A légzés során a szervezetbe jutó szén maximális mennyisége 3,2*10 8 Bq/év.
C - 1s 2 2s 2 2p 2 vagy 1s 2 2s 2 2p x 1 2p y 1 2p z 0
Grafikusan:
Egy gerjesztett szénatomnak a következő elektronikus képlete van:
*C - 1s 2 2s 1 2p 3 vagy 1s 2 2s 1 2p x 1 2p y 1 2p z 1
Sejt formájában: 
Az s- és p-pályák alakja


atompálya- a tér azon tartománya, ahol a legnagyobb valószínűséggel megtalálható az elektron, a megfelelő kvantumszámokkal.
Ez egy háromdimenziós elektronikus "kontúrtérkép", amelyben a hullámfüggvény határozza meg, hogy a pálya egy adott pontján mekkora a relatív valószínűsége egy elektron megtalálásának.
Az atompályák relatív mérete az energiájuk növekedésével nő ( főkvantumszám- n), alakjukat és térbeli tájolásukat pedig az l és m kvantumszámok határozzák meg. A pályán lévő elektronokat spinkvantumszám jellemzi. Minden pálya legfeljebb 2 elektront tartalmazhat ellentétes spinekkel.
Amikor kötések jönnek létre más atomokkal, a szénatom átalakítja az elektronhéját, így a legerősebb kötések jönnek létre, és ennek következtében a lehető legtöbb energia szabadul fel, és a rendszer a legnagyobb stabilitást kapja.
Az atom elektronhéjának megváltoztatásához energiára van szükség, amelyet azután erősebb kötések kialakulásával kompenzálnak.
Az elektronhéj transzformáció (hibridizáció) főként 3 típusú lehet, attól függően, hogy a szénatom hány atommal köt kötést.
A hibridizáció típusai:
sp 3 – Hibridizáció (valenciaállapot)– egy atom 4 szomszédos atommal kötést létesít (tetraéderes hibridizáció):
Az elektronikus képlet sp 3 - hibrid szénatom:
*С –1s 2 2(sp 3) 4 cellák formájában ![]()

A hibrid pályák közötti kötési szög ~109°.
A szénatom sztereokémiai képlete:
sp 2 – Hibridizáció (valenciaállapot)– egy atom 3 szomszédos atommal kötést képez (trigonális hibridizáció):
Az elektronikus képlet sp 2 - hibrid szénatom:
*С –1s 2 2(sp 2) 3 2p 1 cellák formájában 
A hibrid pályák közötti kötési szög ~120°.
Sztereokémiai képlet sp 2 - hibrid szénatom:
sp – Hibridizáció (valencia állapot) - az atom 2 szomszédos atommal kötést képez (lineáris hibridizáció):
Az sp elektronikus képlete egy hibrid szénatom:
*С –1s 2 2(sp) 2 2p 2 cellák formájában
A hibrid pályák közötti kötési szög ~180°.
Sztereokémiai képlet:
Az s-orbitál minden típusú hibridizációban részt vesz, mert minimális energiával rendelkezik.
Az elektronfelhő átrendeződése lehetővé teszi a legerősebb kötések kialakulását és az atomok minimális kölcsönhatását a létrejövő molekulában. Ahol a hibrid pályák nem lehetnek azonosak, de a kötési szögek eltérőek lehetnek, például CH 2 Cl 2 és CCl 4
2. A szerves vegyületek osztályozása és nómenklatúrája. Az izoméria típusai szerves molekulákban.
Az izomerek osztályozása
Szerkezeti (az atomok kapcsolódási sorrendje eltérő)
Sztereoizoméria (az atomok eltérő elrendezése a térben)
Láncok 1. Több kötéspozíció
2. A funkcionális csoport pozíciói
3. Konfiguráció
4. Konformációs
2.Strukturális izoméria.
A szerkezeti izomerek olyan izomerek, amelyek minőségi és mennyiségi összetétele azonos, de kémiai szerkezetükben különböznek.
A szerkezeti izoméria meghatározza a szerves vegyületek sokféleségét, különösen az alkánok. A molekulák szénatomszámának növekedésével Az alkánok gyorsan növelik a szerkezeti izomerek számát. Tehát hexánnál (C 6 H 14) ez 5, nonánnál (C 9 H 20) - 35.
A szénatomok a láncban elfoglalt helyzetükben különböznek. A lánc elején lévő szénatom egy szénatomhoz kötődik, és ún elsődleges. Két szénatomhoz kötődő szénatom másodlagos, hárommal harmadlagos, négyessel negyedidőszak. Az egyenes láncú alkánmolekulák csak primer és szekunder szénatomokat tartalmaznak, míg az elágazó láncú alkánmolekulák harmadlagos és kvaterner szénatomokat is tartalmaznak.
A szerkezeti izoméria típusai.
- A szénlánc izomerizmusa:
- Többszörös kötéshelyzet izoméria
Funkcionális csoporthelyzeti izoméria
Metamerek- azonos vegyületosztályba tartozó, de különböző gyököket tartalmazó vegyületek:
H3C-O-C3H7-metil-propil-éter,
H 5 C 2 - O - C 2 H 5 - dietil-éter
- Interclass izoméria. A molekulák azonos minőségi és mennyiségi összetétele mellett az anyagok szerkezete eltérő.
H 2 C \u003d CH - CH \u003d CH 2 butadién - 1,3 HC \u003d C - CH 2 - CH 3 - butin-1
A szerkezeti izoméria a szénhidrogén gyökök diverzitását is meghatározza. A gyök izoméria a propánnal kezdődik, amelyre két gyök lehetséges. Ha egy hidrogénatomot leveszünk az elsődleges szénatomról, akkor propil-gyököt (n-propil) kapunk. Ha a hidrogénatomot elvesszük a szekunder szénatomtól, akkor az izopropilcsoportot kapjuk
Téri izoméria (sztereoizoméria)
Ez olyan izomerek létezése, amelyek összetétele és az atomok kapcsolódási sorrendje azonos, de különböznek egymástól az atomok vagy atomcsoportok térbeli elrendezésének természetében.
Az izomerizmusnak ezt a típusát L. Pasteur (1848), J. van't Hoff, Le Bel (1874) írta le.
Valós körülmények között maga a molekula és egyes részei (atomok, atomcsoportok) oszcilláló-forgó mozgás állapotában vannak, és ez a mozgás nagymértékben megváltoztatja az atomok kölcsönös elrendeződését a molekulában. Ekkor a kémiai kötések megnyúlnak és a kötésszögek megváltoznak, és így a molekulák különféle konfigurációi és konformációi jönnek létre.
Ezért a térbeli izomereket két típusra osztják: konformációs és konfigurációs.
A konfigurációk az atomok térbeli elrendezését jelentik anélkül, hogy figyelembe vennék azokat a különbségeket, amelyek az egyes kötések körüli forgásból erednek. Ezek az izomerek különböző konformációkban léteznek.
A konformációk ugyanannak a molekulának nagyon instabil dinamikus formái, amelyek az atomok vagy atomcsoportok egyes kötések körüli forgása következtében jönnek létre, aminek következtében az atomok különböző térbeli pozíciókat foglalnak el. A molekulák minden konformációját egy bizonyos konfiguráció jellemzi.
A Ϭ kötés lehetővé teszi körülötte a forgást, így egy molekulának sok konformációja lehet. A sok konformáció közül csak hatot vesznek figyelembe, hiszen a minimális elfordulási szögnek egy 60 ° -os szöget tekintünk, amelyet ún torziós szög.
Tegyen különbséget az elhomályosodott és az akadályozott alakzatok között.
Árnyékolt felépítés akkor fordul elő, ha ugyanazok a szubsztituensek helyezkednek el minimális távolság kölcsönös taszító erők keletkeznek egymástól és közöttük, és a molekulának nagy energiaellátással kell rendelkeznie ahhoz, hogy fenntartsa ezt a konformációt. Ez a felépítés energetikailag kedvezőtlen.
akadályozott felépítés - akkor fordul elő, ha az azonos szubsztituensek a lehető legtávolabb vannak egymástól, és a molekula minimális energiatartalékkal rendelkezik. Ez a felépítés energetikailag kedvező.
P 
 Az első ismert vegyület, amelynek konformációs izomerjei vannak, az etán. Térbeli szerkezetét egy perspektivikus képlet vagy Newman-képlet ábrázolja:
Az első ismert vegyület, amelynek konformációs izomerjei vannak, az etán. Térbeli szerkezetét egy perspektivikus képlet vagy Newman-képlet ábrázolja:
C 2 H 6
eltakarva gátolt
felépítés konformáció
 Newman vetületi képletei.
Newman vetületi képletei.
A hozzánk legközelebb eső szénatomot egy pont jelzi a kör közepén, a kör egy távoli szénatomot ábrázol. Az egyes atomok három kötése a kör középpontjából kisugárzó vonalként van ábrázolva - a legközelebbi szénatomhoz, és kicsi - a távoli szénatomhoz.
Hosszú szénláncokban a forgás több C-C kötés körül lehetséges. Ezért az egész lánc sokféle lehet geometriai formák. Röntgenvizsgálati adatok szerint a telített szénhidrogének hosszú láncai cikcakk és fogós konformációval rendelkeznek. Például: a palmitinsav (C 15 H 31 COOH) és a sztearinsav (C 17 H 35 COOH) cikkcakk konformációban a sejtmembránok lipidjeinek részét képezi, az oldatban lévő monoszacharid molekulák pedig karomszerű konformációt vesznek fel.
Ciklikus vegyületek konformációi
A ciklikus vegyületeket a zárt ciklus jelenlétéhez kapcsolódó szögfeszültség jellemzi.
Ha a ciklusokat laposnak tekintjük, akkor sokuknál a kötési szögek jelentősen eltérnek a normáltól. A feszültség, amelyet a szénatomok közötti kötésszögek eltérése okoz egy ciklusban normál érték, hívott sarok vagy Bayer.
Például a ciklohexánban a szénatomok sp 3 - hibrid állapotban vannak, és ennek megfelelően a kötési szögnek egyenlőnek kell lennie 109 és 28°-kal. Ha a szénatomok ugyanabban a síkban lennének, akkor egy síkkörben a belső kötésszögek 120 o-osak lennének, és minden hidrogénatom elhomályosult konformációban lenne. De a ciklohexán nem lehet sík az erős szög- és torziós feszültségek jelenléte miatt. Kevésbé feszült nem síkbeli konformációi vannak a ϭ-kötések körüli részleges forgás miatt, amelyek között a konformációk stabilabbak fotelek És fürdők.
A szék felépítése energetikailag a legkedvezőbb, mivel nem tartalmaz elhomályosult hidrogén- és szénatomokat. A H atomok elrendeződése minden szénatom esetében ugyanaz, mint az etán gátolt konformációjában. Ebben a konformációban minden hidrogénatom nyitott és elérhető a reakciókhoz.
A fürdő konformációja energetikailag kevésbé kedvező, mivel 2 pár C-atom (C-2 és C-3), (C-5 és C-6) a bázison H-atomot tartalmaz elhomályosított konformációban, ezért ez a konformáció nagy energiaellátás és instabil.
C6H12ciklohexán
A "fotel" formája energetikailag kedvezőbb, mint a "fürdő".
- Optikai izoméria.
A 19. század végén felfedezték, hogy sok szerves vegyület képes a polarizált nyaláb síkját balra és jobbra forgatni. Vagyis a molekulára beeső fénysugár kölcsönhatásba lép az elektronhéjaival, és az elektronok polarizálódnak, ami az elektromos tér oszcillációinak irányának megváltozásához vezet. Ha egy anyag az óramutató járásával megegyező irányba forgatja a rezgéssíkot, akkor ún jobbra forgató(+), ha az óramutató járásával ellentétes - baloldali(-). Ezeket az anyagokat optikai izomereknek nevezték. Az optikailag aktív izomerek aszimmetrikus szénatomot (királis) tartalmaznak - ez egy négy különböző szubsztituenst tartalmazó atom. A második fontos feltétel az összes szimmetriatípus (tengelyek, síkok) hiánya. Ezek közé tartozik számos hidroxi- és aminosav
Tanulmányok kimutatták, hogy az ilyen vegyületek az sp 3 hibridizációban a szénatomok szubsztituenseinek sorrendjében különböznek.
P  a legegyszerűbb vegyület a tejsav (2-hidroxi-propánsav)
a legegyszerűbb vegyület a tejsav (2-hidroxi-propánsav)
Az olyan sztereoizomereket, amelyek molekulái tárgyként és inkompatibilis tükörképként vagy bal és jobb kézként viszonyulnak egymáshoz, az ún. enantiomerek(optikai izomerek, tükörizomerek, antipódok, és a jelenséget ún enantiomerek. Minden vegyszer és fizikai tulajdonságok Az enantiomerek ugyanazok, kivéve kettőt: a polarizált fény síkjának forgását (a polariméterben) és a biológiai aktivitást.
A molekulák abszolút konfigurációját összetett fizikai-kémiai módszerekkel határozzák meg.
Az optikailag aktív vegyületek relatív konfigurációját glicerinaldehid standarddal való összehasonlítással határozzuk meg. A jobbra vagy balra forgató glicerinaldehid konfigurációjú optikailag aktív anyagokat (M. Rozanov, 1906) D- és L-sorozatú anyagoknak nevezzük. Egy vegyület jobb és bal izomereinek egyenlő keverékét racemátnak nevezzük, és optikailag inaktív.
Tanulmányok kimutatták, hogy a fény forgásának előjele nem hozható összefüggésbe egy dolog D- és L-sorozathoz való tartozásával, azt csak kísérletileg határozzák meg eszközökben - polariméterekben. Például az L-tejsav forgási szöge +3,8 o, a D-tejsav -3,8 o.
Az enantiomereket Fisher-képletekkel ábrázoltuk.
- A szénlánc függőleges vonalként jelenik meg.
- A legmagasabb funkcionális csoport felül, a legfiatalabb alul található.
- Az aszimmetrikus szénatomot vízszintes vonal jelöli szubsztituensekkel a végein.
- Az izomerek számát a 2 n képlet határozza meg, n az aszimmetrikus szénatomok száma.

 L-sor D-sor
L-sor D-sor
Az enantiomerek között lehetnek szimmetrikus molekulák, amelyek nem rendelkeznek optikai aktivitással, és ún. mezoizomerek.
 Például: Borlista Például: Borlista |

| D - (+) - L sor - (-) - sor | Mezovinnaya hogy - hogy |
Racemate - szőlősav
Az olyan optikai izomereket, amelyek nem tükörizomerek, amelyek több, de nem minden aszimmetrikus C atom konfigurációjában különböznek, és amelyek eltérő fizikai és kémiai tulajdonságokkal rendelkeznek, s-nek nevezzük. di-A-sztereoizomerek.
A p-diasztereomerek (geometrikus izomerek) olyan sztereomerek, amelyeknek a molekulában p-kötés van. Megtalálhatóak az alkénekben, a telítetlen magasabb karboxilcsoportokban a to-t-ben, a telítetlen dikarbonsavban to-t-ben. Például:

Cisz-butén-2 Transz-butén-2
A szerves dolgok biológiai aktivitása összefügg a szerkezetükkel. Például:

cisz-buténdisav, transz-buténdisav,
maleinsav - fumársav - nem mérgező,
nagyon mérgező a szervezetben
Minden természetes telítetlen magasabb szénatomszámú karbonsav cisz-izomer.
A konjugált rendszerek fogalma. A szerves molekulák aromásságának fogalma. Hückel szabálya. Benzoid (benzol és naftalin) és heterociklusos (furán, tiofén, pirrol, pirazol, imidazol, piridin, pirimidin, purin) vegyületek aromássága.
Az A.M. kémiai szerkezetének elmélete. Butlerov. A szénatom elektronszerkezete és a hibridizáció típusai.
1861-ben am. Butlerov javasolta a szerves vegyületek kémiai szerkezetének elméletét, amely a következő főbb rendelkezésekből áll.
1. Az anyagok molekuláiban az atomok kémiai kötődésének szigorú sorrendje van, amit kémiai szerkezetnek nevezünk.
2. Kémiai tulajdonságok az anyagokat az elemi összetevők természete, mennyisége és kémiai szerkezete határozza meg.
3. Ha az azonos összetételű és molekulatömegű anyagok eltérő szerkezetűek, akkor az izoméria jelensége lép fel.
4. Mivel a specifikus reakciókban a molekulának csak egyes részei változnak, a termék szerkezetének vizsgálata segít meghatározni az eredeti molekula szerkezetét.
5. A molekulában lévő egyes atomok kémiai jellege (reaktivitása) a környezettől függően változik, azaz. más elemek milyen atomjaihoz kapcsolódnak.
Egy gerjesztett szénatom külső energiaszintjén négy párosítatlan elektront tartalmaz, és négy kovalens kötést képes létrehozni.
A hibrid pályák részt vesznek a kötések kialakításában.
Az első vegyértékállapot az sp3 hibridizáció. A szénatom egy s és három p pályáját érintő hibridizáció eredményeként négy ekvivalens sp3-hibrid pálya alakul ki, amelyek a tetraéder csúcsaira irányulnak 109,5°-os szögben:
Az sp3 hibridizációs állapotban a szénatom négy s-kötést képez négy szubsztituenssel, és tetraéderes konfigurációja van, 109,5°-os vagy ahhoz közeli kötésszögekkel. (pl. metán)
A második vegyértékállapot az sp2 hibridizáció. A szénatom egy s- és két p-pályáját érintő hibridizáció eredményeként három ekvivalens sp2-hibrid pálya jön létre, amelyek 120°-os szögben ugyanabban a síkban helyezkednek el, és a hibridizációban részt nem vevő p-pálya helyezkedik el. merőleges a hibrid pályák síkjára.
Az sp2-hibridizációs állapotban a szénatom három s-kötést képez a hibrid pályák miatt és egy p-kötést a hibridizációban nem részt vevő p-pálya miatt, és három szubsztituense van. (pl. etilén)
A szén harmadik vegyértékállapota az sp hibridizáció. Az egy s- és egy p-pályát magában foglaló hibridizáció eredményeként két ekvivalens, 1800-os szögben elhelyezkedő sp-hibrid orbitál jön létre, és a hibridizációban nem résztvevő p-pályák a hibridpályák síkjára merőlegesen helyezkednek el. és egymásnak. Az sp-hibridizáció állapotában a szénatom két s-kötést képez hibridpályák miatt és két p-kötést a hibridizációban nem részt vevő p-pályák miatt, és két szubsztituense van. (pl. acetilén)
A molekulák konfigurációjának fogalma. Optikai vagy tükörizoméria. Molekulák szimmetriaelemei (tengely, sík, középpont). Aszimmetrikus szénatom, mint a kiralitás központja. Az anyagok optikai aktivitása és fajlagos forgása.



Egy kiralitási centrummal rendelkező molekulák (enantiomerizmus). Gliceraldehid, mint konfigurációs szabvány. Fisher vetületi képletek. Relatív és abszolút konfiguráció. D-, L- és R-, S-rendszerek. A racemate fogalma.
Az enantiomerek sztereoizomerek, amelyek tárgyként és inkompatibilis tükörképként viszonyulnak egymáshoz.
Enantiomerként csak királis molekulák létezhetnek.
A kiralitás egy tárgy azon tulajdonsága, hogy összeegyeztethetetlen a sajátjával tükörtükrözés. Királis (a görög. cheir - kéz), vagy aszimmetrikus, tárgyak a bal és a jobb kéz, valamint a kesztyűk, csizmák stb. Ezek a párosított tárgyak egy tárgyat és annak tükörképét ábrázolják (7.1. ábra, a). Az ilyen elemek nem kombinálhatók teljesen egymással.
Ugyanakkor sok olyan tárgy van körülöttünk, amely kompatibilis a tükörképével, azaz akirális (szimmetrikus), például tányérok, kanalak, poharak stb. Az akirális tárgyaknak van legalább egy szimmetriasíkja, amely kettéosztja a tárgyat két tükör-azonos részre (lásd 7.1. ábra, b).
Hasonló összefüggések figyelhetők meg a molekulák világában is, vagyis a molekulákat királisra és akirálisra osztják. Az akirális molekuláknak van szimmetriasíkjuk, a királisaknak nincs.
A királis molekulák egy vagy több kiralitási központtal rendelkeznek. A szerves vegyületekben az aszimmetrikus szénatom leggyakrabban a kiralitás központjaként működik.
Az aszimmetrikus egy szénatom, amely négy különböző atomhoz vagy csoporthoz kapcsolódik.
Egy molekula sztereokémiai képletének ábrázolásakor az aszimmetrikus szénatom "C" szimbólumát általában elhagyják.

Sztereokémiai képletek használhatók a konfigurációs izomerek síkon történő ábrázolására. Azonban kényelmesebb az egyszerűbb használata Fisher vetületi képletek(könnyebb – Fisher-vetítések).
Az egyik enantiomer tetraéderes modellje a térben úgy van elrendezve, hogy a szénatomok lánca függőleges helyzetben van, a karboxilcsoport pedig felül. A királis centrumban lévő nem szén szubsztituensekhez (H és OH) kötött kötéseknek a megfigyelő felé kell irányulniuk. Ezt követően a modellt síkra vetítjük. Ebben az esetben az aszimmetrikus atom szimbólumát elhagyjuk, ez a függőleges és vízszintes vonalak metszéspontja.
A királis molekula tetraéderes modellje a vetítés előtt többféleképpen helyezhető el a térben. Csak az szükséges, hogy a vetületen vízszintes vonalat képező linkek a megfigyelő felé irányuljanak, a függőleges kapcsolatok pedig a kép síkján túlra.
A vetítési képletben megengedhető, hogy ugyanabban a királis centrumban bármely két szubsztituenst páros számú alkalommal felcseréljünk (két permutáció elegendő);
A vetítési képlet 180-al elforgatható az ábra síkjában? (ami két permutációnak felel meg), de nem 90?.
Mögött konfigurációs szabvány gliceraldehidet vettek. Balra forgató enantiomerje az volt önkényesen(I) képlet van hozzárendelve. A szénatomnak ezt a konfigurációját l betűvel jelöltük (a lat. laevus- bal). A jobbra forgató enantiomer ennek megfelelően a (II) képletet kapta, és a konfigurációt d betűvel jelöltük (a lat. dexter- jobb).
Figyeljük meg, hogy az l-gliceraldehid standard vetületi képletében az OH-csoport a bal oldalon, míg a d-gliceraldehidben a jobb oldalon található.

Az egyéb szerkezetileg rokon optikailag aktív vegyületek d- vagy l-sorozatához való hozzárendelés úgy történik, hogy aszimmetrikus atomjuk konfigurációját összehasonlítjuk a d- vagy l-glicerinaldehid konfigurációjával. Például a tejsav (I) egyik enantiomerjében a vetületi képletben az OH csoport a bal oldalon van, mint az l-gliceraldehidben, ezért az (I) enantiomer az l-sorozathoz tartozik. Ugyanezen okokból a (II) enantiomer a d-sorozathoz tartozik. Így a Fisher-projekciók összehasonlításából megállapítjuk relatív konfigurációt.

Meg kell jegyezni, hogy az l-gliceraldehid balra, az l-tejsav pedig jobbra forog (és ez nem egyedi eset). Sőt, ugyanaz az anyag lehet bal- és jobbkezes is, a meghatározási körülményektől függően (különböző oldószerek, hőmérséklet).
A polarizált fény síkjának forgásának előjele nem kapcsolódik a d- vagy l-sztereokémiai sorozathoz.
Az optikailag aktív vegyületek relatív konfigurációjának gyakorlati meghatározása kémiai reakciók segítségével történik: vagy a vizsgált anyagot gliceraldehiddé (vagy más ismert relatív konfigurációjú anyaggá) alakítják át, vagy fordítva, a vizsgált anyagot d- ill. l-gliceraldehid. Természetesen mindezen reakciók során az aszimmetrikus szénatom konfigurációja nem változhat.
A feltételes konfigurációk tetszőleges hozzárendelése a bal- és jobbkezes glicerinaldehidhez kényszerű lépés volt. Abban az időben egyetlen királis vegyület abszolút konfigurációja sem volt ismert. Az abszolút konfiguráció megállapítása csak a fiziko-kémiai módszerek, különösen a röntgendiffrakciós analízis fejlődésének köszönhetően vált lehetővé, amelyek segítségével 1951-ben határozták meg először a királis molekula abszolút konfigurációját - ez egy só volt. (+)-borkősav. Ezt követően világossá vált, hogy a d- és l-gliceraldehidek abszolút konfigurációja valóban megegyezik azzal, amit eredetileg nekik tulajdonítottak.
A d,l-System jelenleg α-aminosavak, hidroxisavak és (néhány kiegészítéssel) szénhidrát esetében használatos.
R,S-Konfiguráció kijelölő rendszer. A d,L-rendszer nagyon korlátozottan használható, mivel gyakran lehetetlen bármely vegyület konfigurációját hozzárendelni a glicerinaldehidhez. A kiralitási centrumok konfigurációjának kijelölésére szolgáló univerzális rendszer az R,S-rendszer (a lat. rectus- egyenes, baljós- bal). Azon alapul sorrend szabály, a kiralitásközponthoz kapcsolódó szubsztituensek szenioritása alapján.
A szubsztituensek rangját a kiralitási központhoz közvetlenül kapcsolódó elem rendszáma határozza meg - minél nagyobb, annál idősebb a szubsztituens.
Így az OH csoport idősebb, mint az NH 2, amely viszont idősebb bármely alkilcsoportnál, sőt a COOH-nál is, mivel az utóbbiban egy szénatom az aszimmetriacentrumhoz kapcsolódik. Ha az atomszámok megegyeznek, akkor azt a csoportot tekintjük a legrégebbinek, amelyben a szén utáni atom nagyobb sorszámú, és ha ez az atom (általában oxigén) kettőskötésű, akkor kétszer számoljuk. Ennek eredményeként a következő csoportok sorrendje csökkenő sorrendben történik: -COOH > -CH=O > -CH 2 OH.
A konfiguráció meghatározásához a vegyület tetraéderes modelljét úgy helyezzük el a térben, hogy a legkisebb szubsztituens (a legtöbb esetben ez egy hidrogénatom) legyen a legtávolabb a megfigyelőtől. Ha a másik három szubsztituens szenioritása az óramutató járásával megegyező irányban csökken, akkor az R-konfigurációt a kiralitás középpontjához rendeljük (7.4. ábra, a), ha az óramutató járásával ellentétes irányban. -S- konfiguráció (lásd 7.4. ábra, b), ahogyan a kormány mögött ülő vezető látja (lásd 7.4. ábra, V).

Rizs. 7.4. A tejsav enantiomerjei konfigurációjának meghatározása a R,S- rendszer (magyarázat szövegben)
Fisher vetületek használhatók az RS-rendszer szerinti konfiguráció kijelölésére. Ehhez a vetületet úgy alakítjuk át
9. kérdés
Szerves vegyületek savassága és lúgossága.
A szerves vegyületek savasságának és lúgosságának értékeléséhez két elmélet a legnagyobb jelentőségű: a Bronsted-elmélet és a Lewis-elmélet.
A Lewis-elmélet szerint a vegyületek savas és bázikus tulajdonságait az határozza meg, hogy képesek-e elfogadni vagy átadni egy elektronpárt kötés kialakításához. A Lewis savakat és bázisokat a HICA elv szerint keményre és lágyra osztják.
A Lewis-savak lehetnek atomok, molekulák vagy kationok, amelyeknek van egy üres pályája, és képesek elektronpárt fogadni kovalens kötés kialakítására.
A Lewis-savak elektronpár-akceptorok; A Lewis-bázisok elektronpár donorok. A Lewis-bázisoknak (atomnak, molekulának vagy anionnak) legalább egy vegyértékelektronpárral kell rendelkezniük, amelyeknek partnert kell biztosítaniuk kovalens kötés kialakításához. Minden Lewis-bázis nukleofil reagens.
A Bronsted-elmélet (protolitikus elmélet) szerint a vegyületek savassága és bázikussága a H + proton átvitelével függ össze. A sav és a bázis egy konjugált sav-bázis párt alkot, amelyben minél erősebb a sav, annál gyengébb a konjugált bázisa, és fordítva, minél erősebb a bázis, annál gyengébb a konjugált sav.
A Bronsted savak (protonsavak) semleges molekulák vagy ionok, amelyek képesek protont adni (protondonorok).
A Bronsted-bázisok semleges molekulák vagy ionok, amelyek képesek protont fogadni (protonakceptorok).
A savasság és a bázikusság nem abszolút, hanem a vegyületek relatív tulajdonságai: savas tulajdonságok csak bázis jelenlétében mutatkoznak meg; bázikus tulajdonságok - csak sav jelenlétében. A sav-bázis egyensúlyok vizsgálatához általában vizet használnak oldószerként.
Attól függően, hogy milyen elemhez kötődik a proton, léteznek OH-savak (karbonsavak, fenolok, alkoholok), SH-savak (tiolok), NH-savak (aminok, amidok, imidek), CH-savak ( szénhidrogének és származékaik). Egy elemet és a hozzá tartozó hidrogénatomot savközpontnak nevezzük. Minden esetben eltolódik az elektronsűrűség a hidrogénatomról egy elektronegatívabb atomra, a proton többé-kevésbé könnyen leszakad. Minél nagyobb annak az elemnek az elektronegativitása, amelyhez a proton kötődik, annál nagyobb a vegyület savassága (például a karbonsavak erősebb savak, mint a tiolok vagy az aminok).
Az elektronszívó csoportok jelenléte a molekulában, amelyek negatív elektronhatást fejtenek ki, növelik a proton pozitív töltését, ami a savas tulajdonságok növekedéséhez vezet.
Ahhoz, hogy kovalens kötést hozzon létre egy protonnal, a Brønsted-bázisoknak vagy egy meg nem osztott elektronpárt vagy p-kötés elektronokat kell biztosítaniuk. Ennek megfelelően a Bronsted-bázisok fel vannak osztva P-bázisok és p-bázisok.
n-bázisok lehetnek semlegesek vagy negatív töltésűek. Az anionok alapvetően kifejezettebbek, mint a semleges anyagok. Vagyis az NH 2 amidion - vagy a HO hidroxidion - bázikusabb, mint az ammónia NH 3 és a víz H 2 O.
A p-bázisokban, amelyek magukban foglalják az alkéneket, alkadiéneket, aréneket, a bázikusság központja, pl. a proton kapcsolódási helye p-kötés elektronok. Ezek nagyon gyenge bázisok, mivel a protonált elektronpárok nem szabadok.
Az elektrondonor szubsztituensek jelenléte növeli a szerves vegyületek bázikusságát.
1. A savasság függése a heteroatomtól.
A heteroatom természete alatt elektronegativitását (E.O.) és polarizálhatóságát értjük. Minél több (E.O.), annál könnyebben megvalósítható a heterolitikus rés a molekulában. A balról jobbra haladó periódusokban az atommag töltésének növekedésével az (E.O) növekszik, i.e. az elemek azon képessége, hogy negatív töltést tartanak fenn. Az elektronsűrűség eltolódása következtében az atomok közötti kötés polarizálódik. Minél több elektron és minél nagyobb az atom sugara, minél távolabb helyezkednek el a külső energiaszint elektronjai az atommagtól, annál nagyobb a polarizálhatóság és annál nagyobb a savasság.
Példa: CH-NH-OH-SH-
az E.O. növekedése. és a savasság
C, N, O ugyanazon időszak elemei. E.O. idővel növekszik, a savasság növekszik. Ebben az esetben a polarizálhatóság nem befolyásolja a savasságot.
Az atomok polarizálhatósága a periódusban kismértékben változik, ezért a savasságot meghatározó fő tényező az E.O.
Most fontolja meg az OH-SH-
fokozott savasság
O, S - ugyanabban a csoportban vannak, a csoportban a sugár felülről lefelé növekszik, ezért az atom polarizálhatósága is nő, ami a savasság növekedéséhez vezet. Az S atomsugara nagyobb, mint az O, így a tiolok erősebb savas tulajdonságokat mutatnak, mint az alkoholok.
2. A szénhidrogén gyök és a benne lévő szubsztituensek hatása
Elektronvonó (EA) szubsztituensek hozzájárulnak az elektronsűrűség delokalizációjához, ami az anion stabilitásához és ennek megfelelően a savasság növekedéséhez vezet.
Elektrondonáló (ED) szubsztituenseképpen ellenkezőleg, hozzájárulnak az elektronsűrűség koncentrációjához a savközpontban, ami a savasság csökkenéséhez és a bázikusság növekedéséhez vezet.
Oldószer hatása.
Az oldott anyag molekuláinak vagy ionjainak kölcsönhatását oldószerrel folyamatnak nevezzük megoldása. Egy anion stabilitása alapvetően az oldatban való szolvatációjától függ: minél jobban szolvatálódik az ion, annál stabilabb, és minél nagyobb a szolvatáció, annál kisebb az ion mérete és annál kisebb a benne lévő negatív töltés delokalizációja.
Savas tulajdonságok
1. C aktív fémek:
HO-CH2-CH2-OH + 2Na → H2 + NaO-CH2-CH2-ONa (nátrium-glikolát)
2. Réz(II)-hidroxiddal - kvalitatív reakció!

A két- és többértékű alkoholokra (diol-fragmensre) vonatkozó kvalitatív reakció a Cu (OH) 2-vel való reakció lúgos közegben, melynek eredményeként a rézglikolát komplex vegyülete képződik oldatban, amely kék színt ad.
Egyszerűsített séma

Alaptulajdonságok
1. Halogénhidrogénekkel
HO-CH2-CH2-OH + 2HCl H+↔ Cl-CH 2 -CH 2 -Cl + 2H 2 O
Salétromsavval

Trinitroglicerin - a dinamit alapja
Mérgező etilén-glikol – erős méreg! Elnyomja a központi idegrendszert és hatással van a vesére.
Glicerin (propántriol-1,2,3)- nem mérgező. Szag nélkül. Jól keveredik vízzel. A vadon élő állatokban elterjedt. Fontos szerepet játszik az anyagcsere folyamatokban, mivel része az állati és növényi szövetek zsírjainak (lipidjei). Kenőcsök összetevőjeként használják a bőr lágyítására.
Többértékű ciklikus alkohol inozit vitaminszerű vegyületekre (B csoport vitaminokra) utal, és komplex lipidek - foszfatidil-inozitolok - szerkezeti összetevője.
Előállításához etilén-diamint használnak etilén-diamin-tetraecetsav interakcióval klór-ecetsav. A sóival zsírsavak lágyítószerként használják a gyártás során textíliák. A gyártás során etilén-diamint is használnak színezékek,emulgeálószerek, stabilizátorok latexek, lágyítókÉs gombaölő szerek. Etilén-diamin mérgező; maximálisan megengedhető koncentrációövé gőz levegőben 0,001 mg/l.
A poliaminok közül a tetrametilén-diamin, ill putreszcin H2N(CH2)4NH2 és pentametilén-diamin, vagy holttest H2N(CH2)5NH2. Sokáig holtméregnek számítottak, i.e. a diaminosavak dekarboxilezése során keletkező anyagok, amelyek a rothadó fehérjék toxicitását okozzák.
12. Fenolok Általános jellemzők.

A karbonilcsoport elektronszerkezete. AN nukleofil addíciós reakciói a karbonilcsoporthoz. Víz, hidrogén-cianid, alkoholok, nátrium-hidrogén-szulfit addíciós reakciói. Az aldolkondenzáció mechanizmusa és a Cannicaro reakció.

A karbonilcsoport szerkezete C=O.
· Az aldehidek és ketonok tulajdonságait a >C=O karbonilcsoport szerkezete határozza meg.
A C=O kötés erősen poláris. Dipólusmomentuma jóval nagyobb, mint az alkoholokban lévő C–O kötésé. A C=O többszörös kötés elektronjai, különösen a mozgékonyabb p-elektronok az elektronegatív oxigénatom felé tolódnak el, ami egy részleges negatív töltés megjelenéséhez vezet rajta. A karbonil szén részleges pozitív töltést kap.
Ezért a szenet megtámadják a nukleofil reagensek, az oxigént pedig az elektrofil reagensek, beleértve a H + -ot is.
Az aldehidek és ketonok molekuláiban nincsenek olyan hidrogénatomok, amelyek képesek hidrogénkötéseket létrehozni. Ezért forráspontjuk alacsonyabb, mint a megfelelő alkoholoké. Metanál (formaldehid) - gáz, aldehidek C 2 -C 5 és ketonok C 3 -C 4 - folyadékok, magasabb - szilárd anyagok. Az alacsonyabb homológok vízben oldódnak, mivel a vízmolekulák hidrogénatomjai és a karbonil-oxigénatomok között hidrogénkötések képződnek. A szénhidrogén gyök növekedésével a vízben való oldhatóság csökken.
Nukleofil addíció
Az aldehidekre és ketonokra a nukleofil addíciós reakciók a legjellemzőbbek A N.
Általános leírása nukleofil addíciós mechanizmus A N
Az aldehid vagy keton karbonilcsoportjának szénatomja elleni nukleofil támadás könnyűsége a részleges támadás nagyságától függ.
a szénatom pozitív töltése, térbeli elérhetősége és a közeg sav-bázis tulajdonságai.

Figyelembe véve a karbonil-szénatomhoz kapcsolódó csoportok elektronhatásait, az aldehidekben és ketonokban a δ+ részleges pozitív töltés értéke a következő sorozatokban csökken:

A karbonil-szénatom térbeli elérhetősége csökken, ha a hidrogént nagyobb térfogatú szerves gyökök váltják fel, így az aldehidek reaktívabbak, mint a ketonok.

A nukleofil addíciós reakciók általános sémája A N A karbonilcsoport nukleofil támadása a karbonil szénatomja ellen, amelyet egy elektrofil hozzáadása követ az oxigénatomhoz.
Savas környezetben a karbonilcsoport aktivitása általában növekszik, mivel az oxigénatom protonálódása miatt pozitív töltés keletkezik a szénatomon. A savas katalízist általában akkor alkalmazzák, ha a támadó nukleofil aktivitása alacsony.
A fenti mechanizmus szerint az aldehidek és ketonok számos fontos reakciója megy végbe.

alkoholok hozzáadása. Aldehidekkel kölcsönhatásba lépő alkoholok könnyen képződnek félacetálok. A félacetálokat instabilitásuk miatt általában nem izolálják. A savas környezetben feleslegben lévő alkohollal félacetálokká alakulnak acetálok.

A savkatalizátor alkalmazása a hemiacetál acetállá történő átalakítására az alábbi reakciómechanizmusból világosan kitűnik. A központi helyet benne egy karbokation (I) képződése foglalja el, amely a szomszédos oxigénatom magányos elektronpárjának részvétele miatt stabilizálódik (a C 2 H 5 O csoport +M hatása).

A félacetálok és acetálok képződési reakciói reverzibilisek, ezért az acetálok és a félacetálok savas közegben vízfelesleg hatására könnyen hidrolizálódnak. Lúgos környezetben a félacetálok stabilak, mivel az alkoxidion nehezebben távozik, mint a hidroxidion.
Vízcsatlakozás. Víz hozzáadása karbonilcsoporthoz - hidratáció- reverzibilis reakció. Az aldehid vagy keton hidratáltságának mértéke vizes oldatban a szubsztrát szerkezetétől függ.

A triklór-ecetsav-aldehid (klorál) teljesen hidratált. Az elektronszívó triklór-metil-csoport olyan mértékben stabilizálja a klorál-hidrátot, hogy ez a kristályos anyag csak desztilláció során hasítja le a vizet dehidratáló anyagok - kénsav stb.

Aminok és származékaik hozzáadása. Az aminok és más, NH2X általános képletű nitrogéntartalmú vegyületek (X = R, NHR) két lépésben reagálnak aldehidekkel és ketonokkal. Először nukleofil addíciós termékek képződnek, amelyek aztán az instabilitás miatt leválasztják a vizet. Ebből a szempontból ezt a folyamatot általában reakciónak minősítik csatolás-leválás.

Primer aminok esetén szubsztituált iminek(más néven Schiff-bázisok).
Az iminok számos enzimatikus folyamat közbenső termékei. Az iminek előállítása amino-alkoholok képződésén keresztül megy végbe, amelyek viszonylag stabilak, például formaldehid és α-aminosavak reakciójában (lásd 12.1.4).
Az iminek az aminok aldehidekből és ketonokból történő előállításának közbenső termékei reduktív aminálás. Ez általános módon karbonilvegyület és ammónia (vagy amin) keverékének helyreállításából áll. Az eljárás az addíciós-hasítási séma szerint megy végbe egy imin képződésével, amelyet azután aminná redukálunk.
Amikor az aldehidek és ketonok reakcióba lépnek hidrazin-származékokkal, hidrazonok. Ez a reakció felhasználható aldehidek és ketonok elegyekből való izolálására és kromatográfiás azonosítására.


A Schiff-bázisok és más hasonló vegyületek ásványi savak vizes oldataival könnyen hidrolizálódnak, így a kiindulási termékek keletkeznek.
Biszulfit vegyületek képződése Savas nátrium-szulfit (biszulfit) molekula hozzáadásával úgynevezett biszulfit vegyületeket kapunk, amelyekben a hidrogén a karbonilcsoport oxigénjéhez, a maradék SO 2 ONa pedig a szénatomhoz kapcsolódik:
A biszulfitvegyületekben a kénatom közvetlenül kapcsolódik a szénhez.

CANNIZZARO REAKCIÓ, oxidáló-redukáló aldehidek aránytalanítása lúg hatására primer alkoholok és karbonsavak képződésével, például:

A Cannizzaro-reakció javasolt mechanizmusa Homogban. környezet magában foglalja a hidridtranszfer szakaszát 
Aromásnak aldehidek, nem zárható ki az egyelektron transzfer eredményeként keletkező gyök anionok Cannizzaro-reakciójában való részvétel lehetősége. Az R-iont a Cannizzaro-reakcióhoz hasonlóan intramol-lal hajtjuk végre. az a-ketoaldehidek aránytalansága a jelenlétében. lúgok (Cannizzaro átrendeződés): 
dezaminálás,
intramolekuláris dezamináció
R-CH 2 - CH (NH 2) - COOH → R-CH \u003d CH-COOH + NH 3
α,β - telítetlen sav
Hidrolitikus dezaminálás
R-CH (NH 2) - COOH + H 2 O → R - CH (OH) - COOH + NH 3
α-hidroxisav
Oxidatív dezamináció
R-CH (NH 2) - COOH + 1/2 O 2 → R -C (O) - COOH + NH 3
α-ketosav
Komplexek képződése fémekkel. Az α-aminosavak komplexen belüli sókat képeznek nehézfém-kationokkal. A frissen készített réz(II)-hidroxiddal minden α-aminosav enyhe körülmények között jól kristályosodott, kék színű intrakomplex (kelát) réz(II)-sókat ad:

Az ilyen sókban a rézion aminocsoportokhoz kapcsolódik koordinációs kötésekkel.
Peptid kötés kialakulása.
A -aminosavak intermolekuláris kölcsönhatása peptidek képződéséhez vezet. Amikor két -aminosav kölcsönhatásba lép, dipeptid képződik.

Három -aminosav intermolekuláris kölcsönhatása tripeptid képződéséhez vezet, stb.

Az aminosavmolekulák peptidláncot alkotó töredékeit aminosavmaradékoknak nevezzük, a CO–NH kötést pedig peptid kötés.
22. α-aminosavak dekarboxilezése - biogén aminok és bioregulátorok (hisztamin, triptamin) képződése.
Egyes aminosavak és származékaik dekarboxiláción eshetnek át - az oc-karboxilcsoport hasításán. Az emlősök szöveteiben számos aminosav vagy származéka dekarboxilezhet: Tri, Tyr, Val, His, Glu, Cys, Apr stb. A reakciótermékek CO 2 és aminok, amelyek kifejezett biológiai hatással vannak a szervezetre. (biogén aminok):

A dekarboxilezési reakciók irreverzibilisek, és dekarboxiláz enzimek katalizálják. Az állati sejtekben a dekarboxilázok protetikus csoportja a piridoxál-foszfát.
Az aminosavak dekarboxilezése során keletkező aminok gyakran biológiailag aktív anyagok. Neurotranszmitterként (szerotonin, dopamin, GABA stb.), hormonként (norepinefrin, adrenalin), helyi szabályozó faktorként (hisztamin, karnozin, spermin stb.) működnek.
A hisztamin a hisztidin aminosav dekarboxilezésével képződik. Hízósejtekben szintetizálódik, szekréciós szemcsékben halmozódik fel, és a sejtek stimulálásakor szabadul fel.

A hisztaminnak sokféle biológiai hatása van: értágító, vérnyomáscsökkentő, szöveti permeabilitást, helyi ödémát okoz, gyomorszekréciót serkentő, hörgőtágító hatású. Magas koncentrációban gyulladásos és allergiás reakciók közvetítője.
A szerotonin a hidroxi-triptofán dekarboxilezésével képződik. A kromaffin sejtekben, a kéreg alatti struktúrák egyes magjaiban és a vérlemezkékben szintetizálódik.

A szerotonin hatása: érgörcsöt, vérnyomás-emelkedést okoz, serkenti a bélmozgást, részt vesz a hőszabályozásban, az alvás mechanizmusaiban, forrása a melatonin hormon szintézisének, befolyásolja az ember lelki reakcióit. Tehát skizofrénia esetén a szerotonin metabolizmus megsértése van.
A katekolaminok (dopamin, adrenalin, noradrenalin) a tirozin aminosavból szintetizálódnak.
A dopamin serkentő mediátor, hiányával Parkinson-kór alakul ki (adinamia, merevség, tremor). Az adrenalin érgörcsöt okoz, emeli a vérnyomást, serkenti a szívműködést, hormon.
A noradrenalin főként neurotranszmitter funkciókat lát el.
A poliaminok (spermin, spermidin) ornitinből és metioninból szintetizálódnak, a kromatin részét képezik, részt vesznek a transzláció, transzkripció és replikáció szabályozásában.
Mivel a biogén aminok nagyon aktívak, gyorsan inaktiválódnak a szövetekben. Biogén aminok bomlása többféle módon hajtható végre: oxidáció, metilezés, dezaminálás. A biogén aminok inaktiválásának fő módja az oxidatív dezamináció amin-oxidáz enzimek (monoamin-oxidázok, poliamin-oxidázok) hatására.
![]()
Az aminosavak kovalensen kötődhetnek egymáshoz peptidkötéseken keresztül. Az egyik aminosav karboxilcsoportja kovalensen kötődik egy másik aminosav aminocsoportjához. Ez egy R-CO-NH-R kötést hoz létre, amelyet peptidkötésnek neveznek. Ebben az esetben egy vízmolekula leszakad.
O- és N-glükozidok. glükozidok hidrolízise. Monoszacharidok foszfátjai. Aminocukrok acilezése. Monoszacharidok oxidációja. Glükóz-ózonok beszerzése. Az al-dózisok helyreállító tulajdonságai. Xilit, szorbit. C-vitamin.
A glikozidok a szénhidrátok ciklikus formáinak származékai, amelyekben a hemiacetál hidroxilcsoportot OR csoport helyettesíti.
Nem szénhidrát komponens - aglikon. Az anomer centrum és az –OR csoport közötti kötés glikozidos.
A furanozidokat piranozidokra osztják.
A glükóz glükozidjait glükozidoknak, a ribózokat ribozidoknak stb.
GLIKOZIDOK
s a x a r aglikon
(általában monoszacharid) (alkohol, aromás vegyületek, szteroidok stb.)
glikozid szinigrin; hidrolízis:
vanillin-glikozid; hidrolízis:
Foszfát monoszacharidok.
Nagyon fontos foszforsav-észtereket tartalmaznak - foszfátokat. Minden növényi és állati szervezetben megtalálhatók, és a monoszacharidok metabolikusan aktív formái. A legfontosabb szerepet a D-glükóz és D-fruktóz foszfátjai játsszák.
Glükóz oxidációja semleges, enyhén savas környezetben:

Oxidálás erős oxidálószerrel:

Glükóz oxidációja lúgos közegben.
Tollens kerület:
Ez egy γ-laktonsav.
Gyümölcsökben, különösen citrusfélékben, bogyókban (csipkebogyó, fekete ribizli), zöldségekben, tejben található.
Erős savas tulajdonságokat mutat
az endol fragmentum egyik hidroxilcsoportja miatt.
A sók képződése során a γ-lakton gyűrű nem nyílik ki.
Erős helyreállító tulajdonságokkal rendelkezik. Az oxidációja során keletkező dehidroaszkorbinsav könnyen aszkorbinsavvá redukálódik. Ez a folyamat egy sor redox reakciót biztosít a szervezetben.

A szerves kémia a szénatom kémiája. A szerves vegyületek száma tízszer nagyobb, mint a szervetleneké, ami csak magyarázható a szénatom jellemzői :
a) Benne van az elektronegativitási skála közepén és a második periódus, ezért számára nem kifizetődő a sajátját adni és elfogadni mások elektronjait, és pozitív vagy negatív töltést szerezni;
b) az elektronhéj speciális szerkezete - nincsenek elektronpárok és szabad pályák (csak egy hasonló szerkezetű atom van még - a hidrogén, valószínűleg ezért alkot a szén és a hidrogén annyi vegyületet - szénhidrogént).
A szénatom elektronszerkezete
C - 1s 2 2s 2 2p 2 vagy 1s 2 2s 2 2p x 1 2p y 1 2p z 0
Grafikusan:
Egy gerjesztett szénatomnak a következő elektronikus képlete van:
*C - 1s 2 2s 1 2p 3 vagy 1s 2 2s 1 2p x 1 2p y 1 2p z 1
Sejt formájában: 
Az s- és p-pályák alakja


atompálya - a tér azon tartománya, ahol a legnagyobb valószínűséggel megtalálható az elektron, a megfelelő kvantumszámokkal.
Ez egy háromdimenziós elektronikus "kontúrtérkép", amelyben a hullámfüggvény határozza meg, hogy a pálya egy adott pontján mekkora a relatív valószínűsége egy elektron megtalálásának.
Az atompályák relatív mérete az energiájuk növekedésével nő ( főkvantumszám- n), alakjukat és térbeli tájolásukat pedig az l és m kvantumszámok határozzák meg. A pályán lévő elektronokat spinkvantumszám jellemzi. Minden pálya legfeljebb 2 elektront tartalmazhat ellentétes spinekkel.
Amikor kötések jönnek létre más atomokkal, a szénatom átalakítja az elektronhéját, így a legerősebb kötések jönnek létre, és ennek következtében a lehető legtöbb energia szabadul fel, és a rendszer a legnagyobb stabilitást kapja.
Az atom elektronhéjának megváltoztatásához energiára van szükség, amelyet azután erősebb kötések kialakulásával kompenzálnak.
Az elektronhéj transzformáció (hibridizáció) főként 3 típusú lehet, attól függően, hogy a szénatom hány atommal köt kötést.
A hibridizáció típusai:
sp 3 – egy atom 4 szomszédos atommal kötést létesít (tetraéderes hibridizáció):
Az elektronikus képlet sp 3 - hibrid szénatom:
*С –1s 2 2(sp 3) 4 cellák formájában 

A hibrid pályák közötti kötési szög ~109°.
A szénatom sztereokémiai képlete:

sp 2 - Hibridizáció (valencia állapot)– egy atom 3 szomszédos atommal kötést képez (trigonális hibridizáció):
Az elektronikus képlet sp 2 - hibrid szénatom:
*С –1s 2 2(sp 2) 3 2p 1 cellák formájában 
A hibrid pályák közötti kötési szög ~120°.
Sztereokémiai képlet sp 2 - hibrid szénatom:

sp– Hibridizáció (valencia állapot) - az atom 2 szomszédos atommal kötést képez (lineáris hibridizáció):
Az sp elektronikus képlete egy hibrid szénatom:
*С –1s 2 2(sp) 2 2p 2 cellák formájában 
A hibrid pályák közötti kötési szög ~180°.
Sztereokémiai képlet:

Az s-orbitál minden típusú hibridizációban részt vesz, mert minimális energiával rendelkezik.
Az elektronfelhő átrendeződése lehetővé teszi a legerősebb kötések kialakulását és az atomok minimális kölcsönhatását a létrejövő molekulában. Ahol a hibrid pályák nem lehetnek azonosak, de a kötési szögek eltérőek lehetnek, például CH 2 Cl 2 és CCl 4
2. Kovalens kötések szénvegyületekben
Kovalens kötések, a nevelés tulajdonságai, módszerei és okai - az iskolai tanterv.
Csak hadd emlékeztesselek:
1. Kommunikációs oktatás Az atomok közötti átfedés az atompályáik átfedésének eredményeként tekinthető, és minél hatékonyabb (minél nagyobb az átfedési integrál), annál erősebb a kötés.
A számított adatok szerint a relatív atomipálya-átfedési hatásfok S rel a következőképpen nő:

Ezért a hibrid pályák, például a szén sp 3 pályáinak alkalmazása négy hidrogénatomos kötések kialakításában erősebb kötésekhez vezet.
2. A szénvegyületekben a kovalens kötések kétféleképpen jönnek létre:
A)Ha két atompálya a főtengelyük mentén átfedi egymást, akkor a létrejövő kötést nevezzük - σ kötés.
Geometria. Tehát, amikor metánban kötések jönnek létre hidrogénatomokkal, egy szénatom négy hibrid sp 3 ~ pályája átfedésben van négy hidrogénatomból álló s-pályával, és négy azonos erős σ-kötést képez, amelyek mindegyikével 109 ° 28 "-os szöget zárnak be. egyéb (standard tetraéder szög) Hasonló szigorúan szimmetrikus tetraéderes szerkezet keletkezik például a CCl 4 képződése során is, de ha a szénnel kötést alkotó atomok nem azonosak, például CH 2 C1 2 esetén, a térszerkezet némileg el fog térni a teljesen szimmetrikustól, bár lényegében tetraéderes marad.
σ-kötés hossza szénatomok között függ az atomok hibridizációjától, és csökken az sp 3 - hibridizációról spre történő átmenetben. Ennek az az oka, hogy az s-pálya közelebb van a maghoz, mint a p-pálya, ezért minél nagyobb a részesedése a hibridpályán, annál rövidebb, tehát annál rövidebb a létrejövő kötés.
B) Ha két atomos p -az egymással párhuzamos pályák oldalirányú átfedést hajtanak végre az atomok elhelyezkedésének síkja felett és alatt, ekkor a létrejövő kötést ún. - π (pi) - kommunikáció


Oldalsó átfedés atomi pályák kevésbé hatékonyak, mint a főtengely mentén történő átfedés, tehát π -a kötések kevésbé erősek, mint σ -kapcsolatok. Ez különösen abban nyilvánul meg, hogy a szén-szén kettős kötés energiája kevesebb mint kétszeresével haladja meg az egyszeres kötés energiáját. Így a C-C kötés energiája etánban 347 kJ/mol, míg az eténben a C=C kötés energiája csak 598 kJ/mol, és nem ~700 kJ/mol.
Két atomi 2p pálya oldalirányú átfedésének mértéke , és innen az erő π -kötés maximális, ha két szénatom és négy kapcsolódik hozzájuk az atomok szigorúan ugyanabban a síkban helyezkednek el, vagyis ha ők egysíkú , hiszen csak ebben az esetben az atomi 2p pályák pontosan párhuzamosak egymással, ezért képesek maximális átfedésre. Bármilyen eltérés a koplanáristól a körüli forgás miatt σ - két szénatomot összekötő kötés az átfedés mértékének csökkenéséhez és ennek megfelelően az erősség csökkenéséhez vezet π -kötés, amely így segít megőrizni a molekula laposságát.
Forgás szén-szén kettős kötés körül lehetetlen.
terjesztés π Az -elektronok a molekula síkja felett és alatt a létezést jelentik negatív töltésű területek, kész kölcsönhatásba lépni bármilyen elektronhiányos reagenssel.
Az oxigén, nitrogén stb. atomjai is eltérő vegyértékállapotúak (hibridizációk), míg elektronpárjaik egyaránt lehetnek hibrid és p-pályán.