Fizinės ozono savybės yra labai būdingos: tai lengvai sprogios mėlynos spalvos dujos. Litras ozono sveria maždaug 2 gramus, o oras – 1,3 gramo. Todėl ozonas yra sunkesnis už orą. Ozono lydymosi temperatūra yra minus 192,7ºС. Šis „ištirpęs“ ozonas yra tamsiai mėlynas skystis. Ozono „ledas“ yra tamsiai mėlynos spalvos su violetiniu atspalviu ir tampa nepermatomas, kai jo storis viršija 1 mm. Ozono virimo temperatūra yra minus 112ºС. Dujinėje būsenoje ozonas yra diamagnetinis, t.y. neturi magnetines savybes, o skystoje būsenoje yra silpnai paramagnetinis. Ozono tirpumas lydytame vandenyje yra 15 kartų didesnis nei deguonies ir yra maždaug 1,1 g/l. 2,5 g ozono kambario temperatūroje ištirpsta litre acto rūgšties. Taip pat gerai tirpsta eteriniuose aliejuose, terpentine, anglies tetrachloridas. Ozono kvapas jaučiamas, kai koncentracija viršija 15 µg/m3 oro. Minimaliomis koncentracijomis jis suvokiamas kaip „gaivumo kvapas“, didesnėmis koncentracijomis įgauna aštrų, dirginantį atspalvį.
Ozonas susidaro iš deguonies pagal tokią formulę: 3O2 + 68 kcal → 2O3. Klasikiniai ozono susidarymo pavyzdžiai: žaibo įtaka perkūnijos metu; veikiami saulės spindulių viršutiniuose atmosferos sluoksniuose. Ozonas taip pat gali susidaryti vykstant bet kokiems procesams, kuriuos lydi atominio deguonies išsiskyrimas, pavyzdžiui, skaidant vandenilio peroksidą. Pramoninė ozono sintezė apima elektros iškrovų naudojimą žemoje temperatūroje. Ozono gamybos technologijos gali skirtis viena nuo kitos. Taigi medicinos reikmėms naudojamam ozonui gaminti naudojamas tik grynas (be priemaišų) medicininis deguonis. Atskirti susidariusį ozoną nuo deguonies priemaišų dažniausiai nesunku dėl fizikinių savybių skirtumų (ozonas lengviau skystėja). Jei tam tikri kokybiniai ir kiekybiniai reakcijos parametrai nėra būtini, ozono gavimas nesukelia ypatingų sunkumų.
O3 molekulė yra nestabili ir, išskirdama šilumą, gana greitai virsta O2. Esant mažoms koncentracijoms ir be pašalinių priemaišų, ozonas skyla lėtai, didelėmis koncentracijomis – sprogstamai. Susilietus su juo alkoholis iškart užsidega. Ozono įkaitimas ir kontaktas net su nežymiu oksidacijos substrato kiekiu (organinėmis medžiagomis, kai kuriais metalais ar jų oksidais) smarkiai pagreitina jo skilimą. Ozoną galima ilgai laikyti –78ºС temperatūroje, esant stabilizatoriui (nedideliui HNO3), taip pat stikliniuose, kai kurių plastikų ar tauriųjų metalų induose.
Ozonas yra stipriausias oksidatorius. Šio reiškinio priežastis yra ta, kad skilimo proceso metu susidaro atominis deguonis. Toks deguonis yra daug agresyvesnis nei molekulinis deguonis, nes deguonies molekulėje elektronų trūkumas išoriniame lygyje dėl jų kolektyvinio molekulinės orbitos naudojimo nėra toks pastebimas.
Dar XVIII amžiuje buvo pastebėta, kad gyvsidabris, esant ozonui, praranda blizgesį ir prilimpa prie stiklo, t.y. oksiduojasi. Ozoną praleidžiant per vandeninį kalio jodido tirpalą, pradeda išsiskirti jodo dujos. Tie patys „gudrybės“ neveikė su grynu deguonimi. Vėliau buvo atrastos ozono savybės, kurias iš karto perėmė žmonija: ozonas pasirodė esąs puikus antiseptikas, ozonas greitai pašalino iš vandens bet kokios kilmės organines medžiagas (kvepalus ir kosmetiką, biologinius skysčius), pradėtas plačiai naudoti pramonėje ir kasdieniame gyvenime, ir pasitvirtino kaip alternatyva dantų grąžtui.
XXI amžiuje ozono naudojimas visose žmogaus gyvenimo ir veiklos srityse auga ir vystosi, todėl matome, kad jis iš egzotikos virsta įprastu kasdieninio darbo įrankiu. OZONAS O3, alotropinė deguonies forma.
Kvitas ir fizines savybes ozonas.
Mokslininkai pirmą kartą sužinojo apie nežinomų dujų egzistavimą, kai pradėjo eksperimentuoti su elektrostatinėmis mašinomis. Tai atsitiko XVII a. Tačiau jie pradėjo tyrinėti naujas dujas tik kito amžiaus pabaigoje. 1785 metais olandų fizikas Martinas van Marumas gavo ozoną leisdamas elektros kibirkštis per deguonį. Ozono pavadinimas atsirado tik 1840 m.; jį išrado šveicarų chemikas Christianas Schönbeinas, kildinamas iš graikiško ozono – kvapo. Cheminė šių dujų sudėtis nesiskyrė nuo deguonies, tačiau buvo daug agresyvesnė. Taigi jis akimirksniu oksidavo bespalvį kalio jodidą, išskirdamas rudą jodą; Schönbein panaudojo šią reakciją ozonui nustatyti pagal popieriaus, įmirkyto kalio jodido ir krakmolo tirpale, mėlynumo laipsnį. Net gyvsidabris ir sidabras, kurie kambario temperatūroje yra neaktyvūs, oksiduojasi esant ozonui.
Paaiškėjo, kad ozono molekulės, kaip ir deguonis, susideda tik iš deguonies atomų, bet ne dviejų, o trijų. Deguonis O2 ir ozonas O3 yra vienintelis pavyzdys, kai vienas cheminis elementas sudaro dvi dujas (įprastomis sąlygomis). paprastos medžiagos. O3 molekulėje atomai išsidėstę kampu, todėl šios molekulės yra polinės. Ozonas gaunamas „prilipus“ laisviesiems deguonies atomams prie O2 molekulių, kurios susidaro iš deguonies molekulių veikiant elektros iškrovoms, ultravioletiniams spinduliams, gama spinduliams, greitiesiems elektronams ir kitoms didelės energijos dalelėms. Visada tvyro ozono kvapas prie veikiančių elektrinių mašinų, kuriose „kibirkščiuoja“ šepečiai, ir šalia baktericidinių gyvsidabrio-kvarcinių lempų, skleidžiančių ultravioletinę šviesą. Išsiskiria deguonies atomai ir per kai kuriuos cheminės reakcijos. Ozonas nedideliais kiekiais susidaro vykstant parūgštinto vandens elektrolizei, lėtai oksiduojantis šlapiam baltajam fosforui ore, skaidant junginius, kuriuose yra daug deguonies (KMnO4, K2Cr2O7 ir kt.), fluorui veikiant vandenį. arba koncentruota sieros rūgštis ant bario peroksido. Deguonies atomai visada yra liepsnoje, todėl jei nukreipiate srovę suspaustas oras per deguonies degiklio liepsną ore bus aptiktas būdingas ozono kvapas.
Reakcija 3O2 → 2O3 yra labai endoterminė: norint gauti 1 molį ozono, reikia sunaudoti 142 kJ. Atvirkštinė reakcija įvyksta išleidžiant energiją ir yra atliekama labai lengvai. Atitinkamai, ozonas yra nestabilus. Nesant priemaišų, ozono dujos lėtai skyla esant 70° C temperatūrai ir greitai virš 100° C. Esant katalizatoriams ozono skilimo greitis žymiai padidėja. Tai gali būti dujos (pavyzdžiui, azoto oksidas, chloras) ir daugelis kietųjų medžiagų (netgi indo sienelės). Todėl gryno ozono sunku gauti, o dirbti su juo pavojinga dėl galimo sprogimo.
Nenuostabu, kad daugelį dešimtmečių po ozono atradimo net pagrindinės jo fizinės konstantos buvo nežinomos: ilgą laiką niekas negalėjo gauti gryno ozono. Kaip savo vadovėlyje „Chemijos pagrindai“ rašė D.I.Mendelejevas, „naudojant visus ozono dujų paruošimo būdus, jų kiekis deguonyje visada yra nereikšmingas, dažniausiai tik kelios dešimtosios procento, retai 2%, o tik labai žema temperatūra jis siekia 20 proc. Tik 1880 m. prancūzų mokslininkai J. Gotfeilas ir P. Chappuis iš gryno deguonies gavo ozoną minus 23 ° C temperatūroje. Paaiškėjo, kad storame sluoksnyje ozonas turi gražią mėlyną spalvą. Lėtai suspaudus atvėsusį ozonuotą deguonį, dujos pasidarė tamsiai mėlynos, o greitai atleidus slėgį temperatūra dar labiau nukrito ir susidarė tamsiai violetiniai skysto ozono lašeliai. Jei dujos nebuvo greitai atvėsintos ar suslėgtos, ozonas akimirksniu, su geltonu blyksniu, pavirto deguonimi.
Vėliau buvo sukurtas patogus ozono sintezės metodas. Jei koncentruotas perchloro, fosforo ar sieros rūgšties tirpalas yra elektrolizuojamas atšaldytu platinos arba švino (IV) oksido anodu, anode išsiskiriančiose dujose bus iki 50 % ozono. Taip pat buvo patobulintos fizinės ozono konstantos. Jis suskystėja daug lengviau nei deguonis - esant -112° C temperatūrai (deguonis - prie -183° C). Esant -192,7° C ozonas sukietėja. Kietas ozonas yra melsvai juodos spalvos.
Eksperimentai su ozonu yra pavojingi. Ozono dujos gali sprogti, jei jų koncentracija ore viršija 9%. Skystas ir kietas ozonas sprogsta dar lengviau, ypač kontaktuodamas su oksiduojančiomis medžiagomis. Ozonas gali būti laikomas žemoje temperatūroje tirpalų pavidalu fluorintuose angliavandeniliuose (freonuose). Tokie sprendimai yra mėlynos spalvos.
Cheminės ozono savybės.
Ozonas pasižymi itin dideliu reaktyvumu. Ozonas yra vienas stipriausių oksidatorių ir šiuo atžvilgiu nusileidžia tik fluorui ir deguonies fluoridui OF2. Aktyvus ozono, kaip oksidatoriaus, principas yra atominis deguonis, susidarantis ozono molekulei irstant. Todėl, veikdama kaip oksidatorius, ozono molekulė, kaip taisyklė, „naudoja“ tik vieną deguonies atomą, o kiti du išsiskiria laisvo deguonies pavidalu, pavyzdžiui, 2KI + O3 + H2O → I2 + 2KOH + O2. Taip pat vyksta daugelio kitų junginių oksidacija. Tačiau yra išimčių, kai ozono molekulė oksidacijai naudoja visus tris turimus deguonies atomus, pavyzdžiui, 3SO2 + O3 → 3SO3; Na2S + O3 → Na2SO3.
Labai svarbus skirtumas tarp ozono ir deguonies yra ozonas oksidacinės savybės jau kambario temperatūroje. Pavyzdžiui, PbS ir Pb(OH)2 normaliomis sąlygomis nereaguoja su deguonimi, o esant ozonui sulfidas virsta PbSO4, o hidroksidas – PbO2. Jei į indą su ozonu pilamas koncentruotas amoniako tirpalas, atsiras balti dūmai – tai ozoną oksiduojantis amoniakas, sudarydamas amonio nitritą NH4NO2. Ypač ozonui būdingas gebėjimas „pajuodinti“ sidabro dirbinius, susidarant AgO ir Ag2O3.
Pridėjus vieną elektroną ir tapus neigiamu jonu O3-, ozono molekulė tampa stabilesnė. „Ozono rūgšties druskos“ arba tokių anijonų turintys ozonidai žinomi nuo seno – jas sudaro visi šarminiai metalai, išskyrus litį, o ozonidų stabilumas didėja nuo natrio iki cezio. Taip pat žinomi kai kurie šarminių žemės metalų ozonidai, pavyzdžiui, Ca(O3)2. Jei ozono dujų srautas nukreipiamas į kieto sauso šarmo paviršių, susidaro oranžinė-raudona pluta, kurioje yra ozonidų, pavyzdžiui, 4KOH + 4O3 → 4KO3 + O2 + 2H2O. Tuo pačiu metu kietas šarmas efektyviai suriša vandenį, kuris apsaugo ozonidą nuo greito hidrolizės. Tačiau esant vandens pertekliui, ozonidai greitai suyra: 4KO3+ 2H2O → 4KOH + 5O2. Skilimas vyksta ir sandėliuojant: 2KO3 → 2KO2 + O2. Ozonidai labai gerai tirpsta skystame amoniake, todėl buvo galima juos išskirti gryna forma ir ištirti jų savybes.
Organinės medžiagos, su kuriomis liečiasi ozonas, dažniausiai sunaikinamos. Taigi ozonas, skirtingai nei chloras, gali suskaidyti benzeno žiedą. Dirbdami su ozonu, negalite naudoti guminių vamzdžių ir žarnų - jie akimirksniu taps nesandarūs. Ozono reakcijos su organiniais junginiais išskiria daug energijos. Pavyzdžiui, eteris, alkoholis, terpentinu suvilgyta vata, metanas ir daugelis kitų medžiagų savaime užsiliepsnoja sąlytyje su ozonuotu oru, o sumaišius ozoną su etilenu, įvyksta stiprus sprogimas.
Ozono taikymas.
Ozonas ne visada „degina“ organines medžiagas; kai kuriais atvejais galima atlikti specifines reakcijas su labai praskiestu ozonu. Pavyzdžiui, ozonuojant oleino rūgštį (jos randama dideliais kiekiais augaliniai aliejai) susidaro azelaino rūgštis HOOC(CH2)7COOH, iš kurios gaminamos aukštos kokybės tepalinės alyvos, sintetiniai pluoštai ir plastikų plastifikatoriai. Panašiai gaunama adipo rūgštis, kuri naudojama nailono sintezei. 1855 metais Schönbeinas atrado nesočiųjų junginių, turinčių dvigubus C=C ryšius, reakciją su ozonu, tačiau tik 1925 metais vokiečių chemikas H. Staudingeris nustatė šios reakcijos mechanizmą. Ozono molekulė prisijungia prie dvigubos jungties, sudarydama ozonidą – šį kartą organinį, o deguonies atomas pakeičia vieną iš C=C jungčių, o -O-O- grupė užima kitos vietą. Nors kai kurie organiniai ozonidai išskiriami gryna forma (pavyzdžiui, etileno ozonidas), ši reakcija dažniausiai atliekama praskiestame tirpale, nes laisvieji ozonidai yra labai nestabilūs. sprogmenų. Nesočiųjų junginių ozonavimo reakcija labai vertinama organinių chemikų; užduotys su šia reakcija dažnai siūlomos net prie mokyklų konkursai. Faktas yra tas, kad kai ozonidas skyla su vandeniu, susidaro dvi aldehido arba ketono molekulės, kurias lengva atpažinti ir toliau nustatyti pradinio nesočiojo junginio struktūrą. Taigi XX amžiaus pradžioje chemikai nustatė daugelio svarbių organinių junginių, įskaitant natūralius, struktūrą, turinčią C=C jungtis.
Svarbi ozono naudojimo sritis yra geriamojo vandens dezinfekcija. Paprastai vanduo yra chloruotas. Tačiau kai kurios priemaišos vandenyje, veikiamos chloro, virsta junginiais, turinčiais labai nemalonų kvapą. Todėl jau seniai buvo siūloma chlorą pakeisti ozonu. Ozonuotas vanduo neįgauna pašalinio kvapo ar skonio; Kai daug organinių junginių visiškai oksiduojasi ozonu, susidaro tik anglies dioksidas ir vanduo. Valomas ozonu ir nuotekų. Ozono oksidacijos produktai net tokių teršalų kaip fenoliai, cianidai, aktyviosios paviršiaus medžiagos, sulfitai, chloraminai yra nekenksmingi, bespalviai ir bekvapiai junginiai. Ozono perteklius gana greitai suyra ir susidaro deguonis. Tačiau vandens ozonavimas yra brangesnis nei chloravimas; Be to, ozonas negali būti transportuojamas ir turi būti gaminamas naudojimo vietoje.
Ozonas atmosferoje.
Žemės atmosferoje ozono yra mažai – 4 milijardai tonų, t.y. vidutiniškai tik 1 mg/m3. Ozono koncentracija didėja tolstant nuo Žemės paviršiaus ir pasiekia maksimumą stratosferoje, 20–25 km aukštyje – tai yra „ozono sluoksnis“. Jei visas ozonas iš atmosferos būtų surinktas Žemės paviršiuje esant normaliam slėgiui, susidaręs sluoksnis būtų tik apie 2-3 mm storio. Ir tokie nedideli ozono kiekiai ore iš tikrųjų palaiko gyvybę Žemėje. Ozonas sukuria „apsauginį ekraną“, neleidžiantį Žemės paviršiaus pasiekti kietiems saulės ultravioletiniams spinduliams, kurie kenkia visai gyvai būtybei.
Pastaraisiais dešimtmečiais daug dėmesio buvo skiriama vadinamųjų „ozono skylių“ atsiradimui – vietovėms, kuriose labai sumažėjęs stratosferos ozono lygis. Per tokį „nesandarių“ skydą Žemės paviršių pasiekia atšiauresnė Saulės ultravioletinė spinduliuotė. Štai kodėl mokslininkai ilgą laiką stebėjo ozoną atmosferoje. 1930 metais anglų geofizikas S. Chapmanas, norėdamas paaiškinti nuolatinę ozono koncentraciją stratosferoje, pasiūlė keturių reakcijų schemą (šios reakcijos buvo vadinamos Chapmano ciklu, kuriame M reiškia bet kurį atomą ar molekulę, kuri išneša energijos perteklių). :
O + O + M → O2 + M
O + O3 → 2O2
O3 → O2 + O.
Pirmoji ir ketvirtoji šio ciklo reakcijos yra fotocheminės, jos vyksta veikiant saulės spinduliuotei. Norint suskaidyti deguonies molekulę į atomus, reikalinga spinduliuotė, kurios bangos ilgis mažesnis nei 242 nm, o ozonas suyra, kai šviesa absorbuojama 240-320 nm srityje (pastaroji reakcija tiksliai apsaugo mus nuo stiprios ultravioletinės spinduliuotės, nes deguonis neabsorbuoja šioje spektro srityje). Likusios dvi reakcijos yra terminės, t.y. eiti be šviesos įtakos. Labai svarbu, kad trečioji reakcija, vedanti į ozono išnykimą, turėtų aktyvavimo energiją; tai reiškia, kad tokios reakcijos greitis gali būti padidintas veikiant katalizatoriams. Kaip paaiškėjo, pagrindinis ozono skilimo katalizatorius yra azoto oksidas NO. Jis susidaro viršutiniuose atmosferos sluoksniuose iš azoto ir deguonies, veikiamas atšiauriausios saulės spinduliuotės. Patekęs į ozonosferą, jis patenka į dviejų reakcijų ciklą O3 + NO → NO2 + O2, NO2 + O → NO + O2, dėl ko jo kiekis atmosferoje nekinta, o stacionari ozono koncentracija mažėja. Yra ir kitų ciklų, dėl kurių sumažėja ozono kiekis stratosferoje, pavyzdžiui, dalyvaujant chlorui:
Cl + O3 → ClO + O2
ClO + O → Cl + O2.
Ozoną taip pat ardo dulkės ir dujos, kurios dideli kiekiai patekti į atmosferą ugnikalnio išsiveržimų metu. IN Pastaruoju metu Buvo teigiama, kad ozonas taip pat veiksmingai naikina vandenilį, išsiskiriantį iš Žemės pluta. Visų ozono susidarymo ir skilimo reakcijų derinys lemia tai, kad vidutinė ozono molekulės gyvenimo trukmė stratosferoje yra apie tris valandas.
Manoma, kad be natūralių, yra ir dirbtinių veiksnių, kurie veikia ozono sluoksnį. Gerai žinomas pavyzdys yra freonai, kurie yra chloro atomų šaltiniai. Freonai yra angliavandeniliai, kuriuose vandenilio atomai yra pakeisti fluoro ir chloro atomais. Jie naudojami šaldymo technologijoje ir aerozolinių balionėlių užpildymui. Galiausiai freonai patenka į orą ir su oro srovėmis lėtai kyla vis aukščiau ir aukščiau, galiausiai pasiekdami ozono sluoksnį. Skildami saulės spinduliuotės įtakoje, patys freonai pradeda kataliziškai skaidyti ozoną. Kol kas tiksliai nežinoma, kiek freonai yra kalti dėl „ozono skylės“, ir, nepaisant to, jau seniai imtasi priemonių jų naudojimui apriboti.
Skaičiavimai rodo, kad per 60-70 metų ozono koncentracija stratosferoje gali sumažėti 25 proc. Ir tuo pačiu padidės ozono koncentracija žemės sluoksnyje - troposferoje, o tai taip pat yra blogai, nes ozonas ir jo virsmo produktai ore yra nuodingi. Pagrindinis ozono šaltinis troposferoje yra stratosferos ozono pernešimas su oro masėmis į apatinius sluoksnius. Kasmet į gruntinį sluoksnį patenka maždaug 1,6 milijardo tonų ozono. Ozono molekulės gyvavimo laikas apatinėje atmosferos dalyje yra daug ilgesnis - daugiau nei 100 dienų, nes ozoną ardančios ultravioletinės saulės spinduliuotės intensyvumas žemesniame sluoksnyje yra mažesnis. Paprastai troposferoje ozono yra labai mažai: gryname gryname ore jo koncentracija vidutiniškai siekia tik 0,016 μg/l. Ozono koncentracija ore priklauso ne tik nuo aukščio virš jūros lygio, bet ir nuo reljefo. Taigi ozono virš vandenynų visada yra daugiau nei sausumoje, nes ten ozonas skyla lėčiau. Matavimai Sočyje parodė, kad oras jūros pakrantė ozono yra 20 % daugiau nei 2 km nuo kranto esančiame miške.
Šiuolaikiniai žmonės įkvepia žymiai daugiau ozono nei jų protėviai. Pagrindinė to priežastis – ore padidėjęs metano ir azoto oksidų kiekis. Taigi metano kiekis atmosferoje nuolat didėjo nuo XIX amžiaus vidurio, kai buvo pradėtos naudoti gamtinės dujos. Atmosferoje, užterštoje azoto oksidais, metanas patenka į sudėtingą virsmų grandinę, kurioje dalyvauja deguonis ir vandens garai, kurių rezultatas gali būti išreikštas lygtimi CH4 + 4O2 → HCHO + H2O + 2O3. Kiti angliavandeniliai taip pat gali veikti kaip metanas, pavyzdžiui, esantys automobilių išmetamosiose dujose. nepilnas degimas benzino. Dėl to per pastaruosius dešimtmečius ozono koncentracija didžiųjų miestų ore išaugo dešimt kartų.
Visada buvo manoma, kad perkūnijos metu ozono koncentracija ore smarkiai padidėja, nes žaibas skatina deguonies pavertimą ozonu. Tiesą sakant, padidėjimas yra nežymus, ir jis atsiranda ne per perkūniją, o kelias valandas prieš ją. Perkūnijos metu ir kelias valandas po jos ozono koncentracija mažėja. Tai paaiškinama tuo, kad prieš perkūniją vyksta stiprus vertikalus maišymasis. oro masės, kad papildomas ozonas būtų iš viršutinių sluoksnių. Be to, prieš perkūniją padidėja elektrinio lauko stiprumas, susidaro sąlygos vainikiniam išlydžiui susidaryti įvairių objektų, pavyzdžiui, šakų, galiukuose. Tai taip pat prisideda prie ozono susidarymo. Ir tada vystymosi metu griaustinis debesis Po juo kyla galingos aukštyn kylančios oro srovės, kurios sumažina ozono kiekį tiesiai po debesimi.
Įdomus klausimas apie ozono kiekį ore spygliuočių miškai. Pavyzdžiui, kurse neorganinė chemija G. Remy gali perskaityti, kad „ozonuotas spygliuočių miškų oras“ yra fikcija. Ar taip yra? Žinoma, joks augalas negamina ozono. Tačiau augalai, ypač spygliuočiai, į orą išskiria daug lakiųjų organinių junginių, tarp jų ir terpenų klasės nesočiuosius angliavandenilius (terpentine jų yra daug). Taigi karštą dieną pušis išskiria 16 mikrogramų terpenų per valandą kiekvienam gramui sausos spyglių masės. Terpenus išskiria ne tik spygliuočiai, bet ir kai kurie lapuočių medžiai, tarp jų tuopos ir eukaliptai. O kai kurie atogrąžų medžiai per valandą gali išskirti 45 mcg terpenų 1 g sausos lapų masės. Dėl to per vieną hektarą spygliuočių miško per parą gali išsiskirti iki 4 kg organinių medžiagų, o iš lapuočių – apie 2 kg. Miškingas Žemės plotas yra milijonai hektarų, ir visi jie per metus išskiria šimtus tūkstančių tonų įvairių angliavandenilių, įskaitant terpenus. O angliavandeniliai, kaip parodyta metano pavyzdyje, veikiami saulės spinduliuotės ir esant kitoms priemaišoms, prisideda prie ozono susidarymo. Kaip parodė eksperimentai, terpenai tinkamomis sąlygomis iš tiesų labai aktyviai dalyvauja atmosferos fotocheminių reakcijų cikle, kai susidaro ozonas. Taigi ozonas spygliuočių miške – visai ne fikcija, o eksperimentinis faktas.
Ozonas ir sveikata.
Kaip gera pasivaikščioti po perkūnijos! Oras švarus ir gaivus, jo gaivinančios srovės tarsi be jokių pastangų teka į plaučius. „Kvepia ozonu“, – tokiais atvejais jie dažnai sako. „Labai naudinga sveikatai“. Ar taip yra?
Vienu metu ozonas tikrai buvo laikomas naudingu sveikatai. Bet jei jo koncentracija viršija tam tikrą ribą, tai gali sukelti daug nemalonių pasekmių. Priklausomai nuo koncentracijos ir įkvėpimo laiko, ozonas sukelia pokyčius plaučiuose, dirgina akių ir nosies gleivinę, skauda galvą, svaigsta galva, sumažėja kraujospūdis; Ozonas mažina organizmo atsparumą bakterinėms kvėpavimo takų infekcijoms. Didžiausia leistina koncentracija ore yra tik 0,1 μg/l, vadinasi, ozonas yra daug pavojingesnis nei chloras! Kelias valandas praleidus patalpoje, kurioje ozono koncentracija siekia vos 0,4 μg/l, gali pasireikšti krūtinės skausmas, kosulys, nemiga, sumažėti regėjimo aštrumas. Jei ilgą laiką kvėpuosite ozonu, kurio koncentracija didesnė nei 2 μg/l, pasekmės gali būti sunkesnės – net suvirpėti ir sumažėti širdies veikla. Kai ozono kiekis yra 8-9 μg/l, po kelių valandų atsiranda plaučių edema, kuri yra kupina mirtinas. Tačiau tokius mažus medžiagos kiekius paprastai sunku išanalizuoti naudojant įprastinius cheminius metodus. Laimei, ozono buvimą žmogus jaučia net esant labai mažoms koncentracijoms – apie 1 μg/l, kuriai esant krakmolo jodo popierius dar nesiruošia mėlynuoti. Vieniems mažos koncentracijos ozono kvapas primena chloro kvapą, kitiems – sieros dioksido, tretiems – česnako kvapą.
Toksiškas ne tik pats ozonas. Jam dalyvaujant ore, susidaro, pavyzdžiui, peroksiacetilnitratas (PAN) CH3-CO-OONO2 – medžiaga, kuri stipriai dirgina, įskaitant ašaras, apsunkina kvėpavimą, o didesnė koncentracija sukelia širdies paralyžių. PAN yra vienas iš vadinamojo fotocheminio smogo, susidarančio vasarą užterštame ore, komponentų (šis žodis kilęs iš angliško dūmų – dūmai ir migla – rūkas). Ozono koncentracija smoge gali siekti 2 µg/l, o tai 20 kartų viršija didžiausią leistiną ribą. Taip pat reikėtų atsižvelgti į tai, kad bendras ozono ir azoto oksidų poveikis ore yra dešimtis kartų stipresnis nei kiekvienos medžiagos atskirai. Nenuostabu, kad tokio smogo pasekmės dideli miestai gali būti katastrofiškas, ypač jei virš miesto esantis oras neprapučiamas „skrajomis“ ir susidaro sustingusi zona. Taigi 1952 metais Londone per kelias dienas nuo smogo mirė daugiau nei 4000 žmonių. O smogas Niujorke 1963 metais pražudė 350 žmonių. Tokijuje buvo panašių istorijų, kitų didieji miestai. Nuo atmosferos ozono kenčia ne tik žmonės. Pavyzdžiui, amerikiečių mokslininkai įrodė, kad vietovėse, kuriose ore yra daug ozono, automobilių padangų ir kitų gumos gaminių tarnavimo laikas gerokai sutrumpėja.
Kaip sumažinti ozono kiekį žemės sluoksnyje? Vargu ar realu sumažinti metano išmetimą į atmosferą. Lieka kitas būdas – sumažinti azoto oksidų išmetimą, be kurio negali vykti ozono susidarymo reakcijų ciklas. Šis kelias taip pat nelengvas, nes azoto oksidus išmeta ne tik automobiliai, bet ir (daugiausia) šiluminės elektrinės.
Ozono šaltiniai yra ne tik gatvėse. Susidaro rentgeno kabinetuose, kineziterapijos kabinetuose (jo šaltinis – gyvsidabrio-kvarco lempos), eksploatuojant kopijavimo įrangą (kopijuoklius), lazerinius spausdintuvus (čia jo susidarymo priežastis – aukštos įtampos iškrova). Ozonas yra neišvengiamas perhidrolio ir argono lankinio suvirinimo gamybos palydovas. Norint sumažinti žalingą ozono poveikį, šalia ultravioletinių lempų būtina turėti vėdinimo įrangą ir gerą patalpos vėdinimą.
Ir vis dėlto vargu ar teisinga ozoną laikyti neabejotinai kenksmingu sveikatai. Viskas priklauso nuo jo koncentracijos. Tyrimai parodė, kad tamsoje grynas oras šviečia labai silpnai; Švytėjimo priežastis yra oksidacijos reakcijos, susijusios su ozonu. Švytėjimas buvo pastebėtas ir purtant vandenį kolboje, į kurią anksčiau buvo įvestas ozonuotas deguonis. Šis švytėjimas visada siejamas su nedideliu organinių priemaišų kiekiu ore ar vandenyje. Kai grynas oras susimaišė su žmogaus iškvepiamu kvėpavimu, švytėjimo intensyvumas padidėjo dešimt kartų! Ir tai nenuostabu: iškvepiamame ore rasta etileno, benzeno, acetaldehido, formaldehido, acetono, skruzdžių rūgšties mikropriemaišų. Juos „išryškina“ ozonas. Tuo pačiu „pasenęs“, t.y. visiškai be ozono, nors ir labai švarus, oras nešviečia, o žmogus jį suvokia kaip „užpūstą“. Tokį orą galima palyginti su distiliuotu vandeniu: jis labai švarus, praktiškai be priemaišų, o gerti – žalinga. Taigi visiškas ozono nebuvimas ore, matyt, ir žmogui nepalankus, nes jame didėja mikroorganizmų kiekis ir kaupiasi kenksmingos medžiagos bei nemalonūs kvapai, kuriuos ozonas sunaikina. Taigi išryškėja reguliaraus ir ilgalaikio patalpų vėdinimo poreikis, net jei jame nėra žmonių: juk patekęs į patalpą ozonas joje ilgai neužsibūna - iš dalies suyra, o didžiąja dalimi nusėda. (adsorbuojasi) ant sienų ir kitų paviršių. Sunku pasakyti, kiek ozono turėtų būti patalpoje. Tačiau minimaliomis koncentracijomis ozonas tikriausiai yra būtinas ir naudingas.
Taigi ozonas yra laiko bomba. Jei jis bus naudojamas teisingai, jis tarnaus žmonijai, bet jei pradėsite jį naudoti kitiems tikslams, tai akimirksniu sukels pasaulinė katastrofa ir Žemė pavirs tokia planeta kaip Marsas.
Per deguonį ar orą praleidžiant elektros kibirkštis, atsiranda būdingas kvapas, kurio priežastis yra naujos medžiagos – ozono – susidarymas. Ozoną galima gauti iš visiškai gryno sauso deguonies; iš to išplaukia, kad jis susideda tik iš deguonies ir reiškia jo alotropinę modifikaciją.
Ozono molekulinė masė yra 48. Deguonies atominė masė yra 16; todėl ozono molekulė susideda iš trijų deguonies atomų.
Ozonui gaminti jie naudoja tylias deguonies elektros iškrovas. Prietaisai, skirti šiam tikslui, vadinami ozonizatoriais.
Ryžiai. 110. Ozono molekulės sandaros schema.

Ryžiai. 111. Ozono molekulės centrinio deguonies atomo orbitalių diagrama.
Normaliomis sąlygomis ozonas yra dujos. Jis gali būti atskirtas nuo deguonies stipriai aušinant; Ozonas kondensuojasi į mėlyną skystį, verdamas .
Ozono tirpumas vandenyje yra daug didesnis nei deguonies: 100 tūrių vandens ištirpina 49 tūrius ozono.
Ozono susidarymą iš deguonies galima išreikšti lygtimi
iš to išplaukia, kad standartinė ozono susidarymo entalpija yra teigiama ir lygi . Be to, kaip rodo lygties koeficientai, šios reakcijos metu iš trijų dujų molekulių gaunamos dvi molekulės, t.y., sistemos entropija mažėja. Dėl to standartinis Gibso energijos pokytis nagrinėjamoje reakcijoje taip pat yra teigiamas (163). Taigi deguonies pavertimo ozonu reakcija negali vykti savaime: jai įgyvendinti reikia energijos. Atvirkštinė reakcija – ozono skilimas – vyksta spontaniškai, nes šio proceso metu sistemos Gibso energija mažėja. Kitaip tariant, ozonas yra nestabili medžiaga.
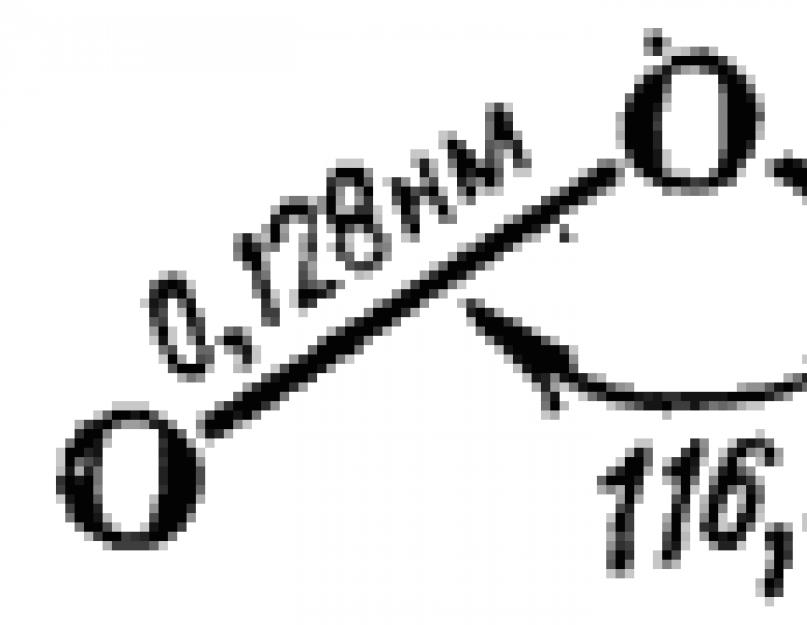
Ozono molekulė yra lygiašonio trikampio formos. Jo struktūra schematiškai parodyta fig. 110. Kampo artumas trikampio viršūnėje iki 120° rodo, kad centrinis deguonies atomas čia yra -hibridizacijos būsenoje. Remiantis tuo, BC metodo požiūriu molekulės susidarymą galima apibūdinti taip.
Centrinio atomo hibridinė -orbitalė, kurioje yra vienas elektronas (111 pav., kairėje), persidengia su vieno iš išorinių deguonies atomų -orbitale, todėl susidaro -jungtis. Hibridizacijoje nedalyvaujančio centrinio atomo orbitalė, orientuota statmenai molekulės plokštumai ir taip pat turinti nesuporuotą elektroną, persidengia su panašiai išsidėsčiusia to paties atokiausio deguonies atomo orbitale, dėl kurios susidaro -obligacija. Galiausiai, veikdamas kaip elektronų poros donoras, užimantis vieną iš hibridinės orbitalės(111 pav., dešinėje), centrinis deguonies atomas sudaro ryšį su kitu išoriniu deguonies atomu pagal donoro-akceptoriaus metodą.
Gauta struktūra atitinka valentingumo diagramą A, kurioje taškais pažymėtos pavienės elektronų poros, o - ir - ryšiai pažymėti raidėmis.

Pagal schemą A centrinio deguonies atomo ryšiai su dviem išoriniais atomais yra nelygios – vienas iš jų yra dvigubas, o kitas paprastas. Tačiau vienodas šių jungčių ilgis (110 pav.) rodo jų lygiavertiškumą. Todėl kartu su schema A ozono molekulės struktūrą taip pat galima apibūdinti schema B. Valentinių schemų sudėjimo metodo požiūriu (žr. § 44), tai reiškia, kad iš tikrųjų ozono molekulės struktūra yra tarpinis tarp A ir B schemų ir gali būti pavaizduotas taip:
Čia punktyrinės linijos rodo -elektronų poros delokalizaciją, ty, kad ji priklauso visiems trims deguonies atomams. Vadinasi, -ryšis ozono molekulėje yra trijų centrų.
Įvertinus ozono molekulės struktūrą MO metodo požiūriu, taip pat galima daryti išvadą, kad čia susidaro trijų centrų jungiamoji molekulinė orbita.
Ozonas yra vienas stipriausių oksidatorių. Jis oksiduoja visus metalus, išskyrus aukso ir platinos metalus, taip pat daugumą nemetalų. Žemesniuosius oksidus jis paverčia aukštesniaisiais, o metalų sulfidus – jų sulfatais. Daugumos šių reakcijų metu ozono molekulė netenka vieno deguonies atomo ir tampa molekule.
Ozonas išskiria jodą iš kalio jodido tirpalo:
Jei į orą, kuriame yra ozono, įdėsite popieriaus lapą, suvilgytą KI ir krakmolo tirpaluose, jis iškart pamėlynuoja. Ši reakcija naudojama ozonui atrasti.
Kaip stiprus oksidatorius, ozonas naikina bakterijas, todėl naudojamas vandens ir oro dezinfekavimui.
Ozonas yra nuodingas. Didžiausias leistinas kiekis ore yra lygus . Esant tokiai koncentracijai, aiškiai jaučiamas jo kvapas. Atmosferos antžeminiame sluoksnyje ozono kiekis paprastai yra ribose, kurios susidaro elektros išlydžiose.
1. Ką mes žinome apie OZONĄ?
Ozonas (iš graikų kalbos ozon – kvepiantis) – mėlynos, aštraus kvapo dujos, stiprus oksidatorius. Ozonas yra deguonies alotropas. Molekulinė formulė O3. 2,5 karto sunkesnis už deguonį. Naudojamas vandeniui, maistui ir orui dezinfekuoti.
Technologijos
Korona ozono technologijos pagrindu sukurtas daugiafunkcis anijoninis ozonizatorius Green World, kuris dezinfekcijai ir sterilizacijai naudoja ozoną.
Cheminio elemento ozono charakteristikos
ozonas, mokslinis vardas iš kurių O3 gaunamas sujungus tris deguonies atomus.Jis pasižymi didelėmis oksidacinėmis funkcijomis, kurios yra veiksmingos dezinfekuojant ir stearilizuojant. Jis gali sunaikinti daugumą bakterijų vandenyje ir ore. Jis laikomas veiksmingu dezinfekuojančiu ir antiseptiku. Ozonas yra svarbi atmosferos sudedamoji dalis. Mūsų atmosferoje yra 0,01–0,04 ppm ozono, kuris subalansuoja bakterijų lygį gamtoje. Ozonas taip pat susidaro natūraliai žaibuojant per perkūniją. Žaibo elektros iškrovos metu atsiranda malonus saldus kvapas, kurį vadiname grynu oru.
Ozono molekulės yra nestabilios ir labai greitai skyla į deguonies molekules. Dėl šios kokybės ozonas yra vertingas dujų ir vandens valytojas. Ozono molekulės jungiasi su kitų medžiagų molekulėmis ir suyra, galiausiai oksiduodamos organinius junginius, paversdamos juos nekenksmingu anglies dioksidu ir vandeniu. Kadangi ozonas lengvai skyla į deguonies molekules, jis yra žymiai mažiau toksiškas nei kitos dezinfekavimo priemonės, pavyzdžiui, chloras. Jis taip pat vadinamas „gryniausiu oksidatoriumi ir dezinfekavimo priemone“.
Ozono savybės – naikina mikroorganizmus
1. naikina bakterijas
a) naikina daugumą ore esančių colių bakterijų ir stafilokokų
b) sunaikina 99,7% colių bakterijų ir 99,9% stafilokokų ant daiktų paviršiaus
c) sunaikina 100 % colių bakterijų, stafilokokų ir salmonelių grupės mikrobų fosfatų junginiuose
d) sunaikina 100% colių bakterijų vandenyje
2. naikina bakterijų sporas
a) naikina brevibacteumsporas
b) gebėjimas sunaikinti bakterijas ore
c) sunaikina 99,999 % brevibacteumsporų vandenyje
3. naikina virusus
a) sunaikina 99,99 % HBsAg ir 100 % HAAg
b) naikina ore esantį gripo virusą
c) sunaikina PVI ir hepatito A virusą vandenyje per kelias sekundes ar minutes
d) sunaikina SA-11 virusą vandenyje
e) kai ozono koncentracija kraujo serume pasiekia 4 mg/l, jis gali sunaikinti ŽIV 106cd50/ml
a) sunaikina 100% aspergillusversicolor ir penicillium
b) sunaikina 100 % aspergillusniger, fusariumoxysporumf.sp.melonogea ir fusariumoxysporumf.sp. lycopersici
c) naikina aspergillus niger ir Candida bakterijas
2. Kaip gamtoje susidaro ozonas?
Jis susidaro iš molekulinio deguonies (O2) elektros iškrovos metu arba veikiant ultravioletinei spinduliuotei. Tai ypač pastebima vietose, kuriose gausu deguonies: miške, pakrantėje ar prie krioklio. Veikiamas saulės spindulių deguonis vandens laše virsta ozonu. Ozono kvapą galite užuosti ir po perkūnijos, kai jis susidaro dėl elektros iškrovos.
3. Kodėl po perkūnijos oras atrodo švaresnis?
Ozonas oksiduoja organines priemaišas ir dezinfekuoja orą, suteikdamas malonų gaivumą (perkūnijos kvapą). Būdingas ozono kvapas atsiranda, kai koncentracija yra 10-7%.
4. Kas yra ozonosfera? Kokią įtaką ji daro gyvybei planetoje?
Didžioji ozono dalis atmosferoje yra 10–50 km aukštyje, o didžiausia koncentracija – 20–25 km aukštyje ir sudaro sluoksnį, vadinamą ozonosfera.
Ozonosfera atspindi stiprią ultravioletinę spinduliuotę ir apsaugo gyvus organizmus nuo žalingo radiacijos poveikio. Dėl ozono susidarymo iš atmosferos deguonies tapo įmanoma gyvybė sausumoje.
5. Kada buvo atrastas ozonas ir kokia jo naudojimo istorija?
Ozonas pirmą kartą aprašytas 1785 m. Olandų fizikas Macas Van Marumas.
1832 metais prof. Bazelio universitete Schonbeinas išleido knygą „Ozono gamyba cheminiais metodais“. Jis pavadino jį „ozonas“ iš graikiško žodžio „kvapas“.
1857 metais Werneris von Siemensas sukūrė pirmąją techninę geriamojo vandens valymo įrangą. Nuo tada ozonavimas leido gauti higieniškai švarų vandenį.
Iki 1977 m Visame pasaulyje veikia daugiau nei 1000 geriamojo vandens ozonavimo įrenginių. Šiuo metu 95% geriamojo vandens Europoje yra apdorojama ozonu. Ozonavimas plačiai paplito Kanadoje ir JAV. Rusijoje yra kelios didelės stotys, kurios naudojamos geriamojo vandens valymui, vandens ruošimui iš baseinų ir giluminiam nuotekų valymui automobilių plovyklų perdirbamajame vandens tiekime.
Pirmą kartą ozonas kaip antiseptikas buvo naudojamas Pirmojo pasaulinio karo metais.
Nuo 1935 m ozono ir deguonies mišinio rektalinį vartojimą pradėjo naudoti įvairioms žarnyno ligoms (proktitai, hemorojus, opinis kolitas, fistulės, slopinimas) gydyti. patogeniniai mikroorganizmai, žarnyno floros atkūrimas).
Ištyrus ozono poveikį, atsirado galimybė jį panaudoti chirurginėje praktikoje gydant infekcinius pažeidimus, tuberkuliozės, pneumonijos, hepatito, herpeso infekcijos, anemijos ir kt.
Maskvoje 1992 m vadovaujant nusipelniusiam Rusijos Federacijos mokslininkui, medicinos mokslų daktarui. Zmyzgova A..V. Buvo sukurtas Mokslinis ir praktinis ozono terapijos centras, kuriame ozonas naudojamas įvairiausioms ligoms gydyti. Toliau kuriami veiksmingi nekenksmingi metodai naudojant ozoną. Šiandien ozonas laikomas populiariu ir veiksmingomis priemonėmis vandens, oro ir maisto dezinfekavimas. Deguonies-ozono mišiniai taip pat naudojami įvairių ligų gydymui, kosmetologijoje ir daugelyje ekonomikos sričių.
6. Ar galima kvėpuoti ozonu? Ar ozonas yra kenksmingos dujos?
Iš tiesų, kvėpuoti didelėmis ozono koncentracijomis yra pavojinga, jis gali sudeginti kvėpavimo organų gleivinę.
Ozonas yra stiprus oksidatorius. Čia slypi teigiamos ir žalingos jo savybės. Viskas priklauso nuo koncentracijos, t.y. dėl ozono kiekio ore procento. Jo poveikis kaip ugnis... Mažais kiekiais palaiko ir gydo, dideliais gali sunaikinti.
7. Kokiais atvejais naudojamas mažos ir didelės koncentracijos ozonas?
Dezinfekavimui naudojamos gana didelės koncentracijos, o mažesnės koncentracijos ozonas nepažeidžia baltymų struktūrų ir skatina gijimą.
8. Koks ozono poveikis virusams?
Ozonas slopina (inaktyvina) virusą tiek ląstelės išorėje, tiek viduje, iš dalies sunaikindamas jos apvalkalą. Sustoja jo dauginimosi procesas ir sutrinka virusų gebėjimas jungtis su organizmo ląstelėmis.
9. Kaip pasireiškia baktericidinė ozono savybė, kai jį veikia mikroorganizmai?
Kai mikroorganizmai, įskaitant mieles, yra veikiami ozono, lokaliai pažeidžiama jų ląstelių membrana, o tai lemia jų mirtį arba nesugebėjimą daugintis. Pastebėtas mikroorganizmų jautrumo antibiotikams padidėjimas.
Eksperimentai parodė, kad ozono dujos naikina beveik visų tipų bakterijas, virusus, pelėsius ir į mieles panašius grybus bei pirmuonis. Ozonas, kurio koncentracija yra nuo 1 iki 5 mg/l, per 4-20 minučių sukelia 99,9% Escherichia coli, streptokokų, mukobakterijų, filokokų, Escherichia coli ir Pseudomonas aeruginosa, Proteus, Klebsiella ir kt.
10. Kaip ozonas veikia negyvojoje gamtoje?
Ozonas reaguoja su dauguma organinių ir neorganinių medžiagų. Reakcijų metu susidaro deguonis, vanduo, anglies oksidai ir kitų elementų aukštesni oksidai. Visi šie produktai yra neteršiantys aplinką ir nesukelia kancerogeninių medžiagų, skirtingai nei chloro ir fluoro junginiai.
11. Ar ozonuojant orą gyvenamosiose patalpose susidarantys junginiai gali būti pavojingi?
Buitinio ozonizatoriaus sukuriama ozono koncentracija lemia nekenksmingų junginių susidarymą gyvenamuosiuose rajonuose. Dėl ozonavimo patalpoje padidėja deguonies kiekis ore, apsivalo virusai ir bakterijos.
12. Kokie junginiai susidaro dėl patalpų oro ozonavimo?
Dauguma mus supančių junginių reaguoja su ozonu, todėl susidaro nekenksmingi junginiai.
Dauguma jų skyla į anglies dioksidą, vandenį ir laisvąjį deguonį. Kai kuriais atvejais susidaro neaktyvūs (nekenksmingi) junginiai (oksidai). Taip pat yra vadinamųjų nereagentinių medžiagų – titano, silicio, kalcio oksidų ir kt. Jie nereaguoja su ozonu.
13. Ar būtina ozonuoti orą patalpose su oro kondicionieriais?
Orui prasiskverbus pro kondicionierius ir šildymo prietaisus, deguonies kiekis ore mažėja, o toksiškų oro komponentų lygis nemažėja. Be to, patys seni oro kondicionieriai yra taršos ir infekcijų šaltinis. „Uždaro kambario sindromas“ - galvos skausmas, nuovargis, dažnos kvėpavimo takų ligos. Tokių patalpų ozonavimas yra tiesiog būtinas.
14. Ar galima dezinfekuoti oro kondicionierių?
Taip tu gali.
15. Ar oro ozonavimas efektyviai pašalina kvapus iš dūmų ir patalpų po remonto (dažų, lako kvapus)?
Taip, tai veiksminga. Apdorojimas turi būti atliekamas kelis kartus, kartu su šlapiu valymu.
16. Kokios koncentracijos ozonas kenkia bakterijoms ir grybeliams namų ore?
50 ozono dalelių koncentracija 100 000 000 oro dalelių žymiai sumažina oro taršą. Ypač stiprus poveikis Pasirodo, kad yra Escherichia coli, salmonelių, stafilokokų, candida, aspergillus.
17. Ar buvo atlikti ozonuoto oro poveikio žmonėms tyrimai?
Visų pirma aprašomas eksperimentas, kuris buvo atliktas per 5 mėnesius su dviem žmonių grupėmis – kontroliniu ir testiniu.
Bandomosios grupės patalpos oras buvo užpildytas ozonu, kurio koncentracija 1000000000 oro dalelių yra 15 ozono dalelių. Visi tiriamieji pažymėjo gerą sveikatą ir dingo dirglumas. Gydytojai pastebėjo padidėjusį deguonies kiekį kraujyje, sustiprėjusią imuninę sistemą, normalizuojantį kraujospūdį, išnykusius daugelį streso simptomų.
18. Ar ozonas kenkia kūno ląstelėms?
Buitinių ozonizatorių sukuriamos ozono koncentracijos slopina virusus ir mikroorganizmus, tačiau nepažeidžia kūno ląstelių, nes Ozonas nepažeidžia odos. Sveikos žmogaus kūno ląstelės turi natūralią apsaugą nuo žalingo oksidacijos poveikio (antioksidantas). Kitaip tariant, ozono veikimas yra selektyvus gyvų organizmų atžvilgiu.
Tai netrukdo naudoti atsargumo priemonių. Ozonavimo proceso metu buvimas patalpoje nepageidautinas, o po ozonavimo patalpa turi būti vėdinama. Ozonizatorius turi būti pastatytas vaikams nepasiekiamoje vietoje arba turi būti užtikrinta, kad jis negalėtų būti įjungtas.
19. Koks ozonizatoriaus našumas?
Įprastu režimu – 200 mg/val., patobulintu režimu – 400 mg/val. Kokia ozono koncentracija patalpoje dėl ozonizatoriaus veikimo? Koncentracija priklauso nuo patalpos tūrio, ozonizatoriaus vietos, oro drėgmės ir temperatūros. Ozonas nėra stabilios dujos ir greitai suyra, todėl ozono koncentracija labai priklauso nuo laiko. Apytiksliai duomenys 0,01 - 0,04 Ррm.
20. Kokios ozono koncentracijos ore laikomos ribojančiomis?
Ozono koncentracija 0,5 - 2,5 РРm (0,0001 mg/l) ribose laikoma saugia.
21. Kam naudojamas vandens ozonavimas?
Ozonas naudojamas dezinfekuoti, pašalinti nešvarumus, kvapą ir vandens spalvą.
1. Skirtingai nei chloruojant ir fluorinant vandenį, ozonuojant į vandenį nepatenka nieko pašalinio (ozonas greitai suyra). Tuo pačiu metu mineralinė sudėtis ir pH išlieka nepakitę.
2. Ozonas pasižymi didžiausiomis dezinfekuojančiomis savybėmis nuo ligų sukėlėjų.
3. Vandenyje esančios organinės medžiagos sunaikinamos, taip užkertant kelią tolimesnis vystymas mikroorganizmai.
4. Dauguma cheminių medžiagų sunaikinamos nesudarant kenksmingų junginių. Tai pesticidai, herbicidai, naftos produktai, plovikliai, sieros ir chloro junginiai, kurie yra kancerogenai.
5. Metalai, įskaitant geležį, manganą, aliuminį ir kt., oksiduojami iki neaktyvių junginių.Oksidai nusėda ir lengvai filtruojami.
6. Greitai irstantis ozonas virsta deguonimi, gerina skonį ir gydomųjų savybių vandens.
23. Koks yra ozonuoto vandens rūgštingumas?
Vandens reakcija yra šiek tiek šarminė, pH = 7,5 - 9,0. Šį vandenį rekomenduojama gerti.
24. Kiek po ozonavimo padidėja deguonies kiekis vandenyje?
Deguonies kiekis vandenyje padidėja 12 kartų.
25. Kaip greitai ozonas skyla ore ir vandenyje?
Ore po 10 min. Ozono koncentracija sumažėja perpus, susidaro deguonis ir vanduo.
Vandenyje po 20-30 min. Ozonas skyla į pusę, sudarydamas hidroksilo grupę ir vandenį.
26. Kaip vandens šildymas veikia deguonies kiekį jame?
Po šildymo deguonies kiekis vandenyje sumažėja.
27. Kas lemia ozono koncentraciją vandenyje?
Ozono koncentracija priklauso nuo priemaišų, temperatūros, vandens rūgštingumo, medžiagos ir talpyklos geometrijos.
28. Kodėl naudojama O 3 molekulė, o ne O 2 ?
Ozonas yra maždaug 10 kartų tirpesnis vandenyje nei deguonis ir gerai išsilaiko. Kuo žemesnė vandens temperatūra, tuo ilgesnis laikymo laikas.
29. Kodėl naudinga gerti deguonies prisotintą vandenį?
Ozono naudojimas padidina gliukozės suvartojimą audiniuose ir organuose, padidina kraujo plazmos prisotinimą deguonimi, sumažina deguonies bado laipsnį ir pagerina mikrocirkuliaciją.
Ozonas teigiamai veikia kepenų ir inkstų metabolizmą. Palaiko širdies raumens veiklą. Sumažina kvėpavimo dažnį ir padidina potvynio tūrį.
30. Kam skirtas buitinis ozonizatorius?
Buitinį ozonizatorių galima naudoti:
oro dezinfekcija ir dezodoravimas gyvenamosiose patalpose, vonios kambariuose ir tualetuose, persirengimo nameliuose, spintose, šaldytuvuose ir kt.;
maisto perdirbimas (mėsa, žuvis, kiaušiniai, daržovės ir vaisiai);
vandens kokybės gerinimas (dezinfekavimas, sodrinimas deguonimi, chloro ir kitų kenksmingų priemaišų pašalinimas);
namų kosmetologija (pleiskanų, spuogų naikinimas, gargaliavimas, dantų valymas, grybelinių ligų šalinimas, ozonuoto aliejaus ruošimas);
naminių gyvūnėlių ir žuvų priežiūra;
glazūra kambariniai augalai ir sėklų apdorojimas;
baltinimas ir spalvos suteikimas skalbiniams;
batų apdirbimas.
31. Koks yra ozono naudojimo medicinos praktikoje poveikis?
Ozonas turi antibakterinį ir antivirusinį poveikį (inaktyvuoja virusus ir naikina sporas).
Ozonas aktyvina ir normalizuoja daugybę biocheminių procesų.
Ozono terapijos poveikis pasižymi:
suaktyvėja detoksikacijos procesai, atsiranda slopinimas
išorinių ir vidinių toksinų aktyvumas;
medžiagų apykaitos procesų aktyvinimas (medžiagų apykaitos procesai);
Padidėjusi mikrocirkuliacija (kraujo tiekimas
pagerinti reologines kraujo savybes (kraujas tampa judrus);
turi ryškų analgezinį poveikį.
32. Kaip ozonas veikia žmogaus imunitetą?
Padidėja ląstelinis ir humoralinis imunitetas. Suaktyvėja fagocitozė, sustiprėja interferonų ir kitų nespecifinių organizmo sistemų sintezė.
33. Kaip ozonavimas veikia medžiagų apykaitos procesus?
Ozono naudojimas padidina gliukozės suvartojimą audiniuose ir organuose, padidina kraujo plazmos prisotinimą deguonimi, sumažina deguonies bado laipsnį ir pagerina mikrocirkuliaciją. Ozonas teigiamai veikia kepenų ir inkstų metabolizmą. Palaiko širdies raumens veiklą. Sumažina kvėpavimo dažnį ir padidina potvynio tūrį.
34. Ozonas susidaro atliekant suvirinimo darbus ir eksploatuojant kopijavimo aparatą. Ar šis ozonas yra kenksmingas?
Taip, tai kenksminga, nes sukuria pavojingų priemaišų. Ozonizatoriaus gaminamas ozonas yra grynas, todėl nekenksmingas.
35. Ar skiriasi pramoniniai, medicininiai ir buitiniai ozonatoriai?
Pramoniniai ozonizatoriai gamina didelę ozono koncentraciją, kuri yra pavojinga naudoti namuose.
Medicininiai ir buitiniai ozonizatoriai yra panašūs veikimo rodikliais, tačiau medicininiai yra skirti ilgesniam nepertraukiamam darbui.
36. Kokios yra lyginamosios dezinfekcijos, naudojant ultravioletinius įrenginius ir ozonizatorius, charakteristikas?
Ozonas savo bakterijų ir virusų naikinimo savybėmis yra 2,5–6 kartus efektyvesnis už ultravioletinius spindulius ir 300–600 kartų už chlorą. Be to, skirtingai nei chloras, ozonas netgi naikina kirminų cistas ir herpeso bei tuberkuliozės virusus.
Ozonas pašalina iš vandens organines ir chemines medžiagas, skaidydamas jas į vandenį, anglies dioksidą, sudarydamas neaktyvių elementų nuosėdas.
Ozonas lengvai oksiduoja geležies ir mangano druskas, sudarydamas netirpias medžiagas, kurios pašalinamos nusodinant arba filtruojant. Dėl to ozonuotas vanduo yra saugus, skaidrus ir gero skonio.
37. Ar galima indus dezinfekuoti naudojant ozoną?
Taip! Naudinga dezinfekuoti vaikiškus indus, konservavimo indus ir t.t.. Norėdami tai padaryti, įdėkite indus į vandens indą, nuleiskite oro kanalą su pertvara. Procedūra trunka 10-15 minučių.
38. Iš kokių medžiagų turėtų būti gaminami indai ozonavimui?
Stiklas, keramika, medis, plastikas, emaliuotas (be drožlių ir įtrūkimų). Nenaudokite metalinių indų, įskaitant aliuminio ir vario indus. Guma neatlaiko sąlyčio su ozonu.
Amerikiečių korporacijos „Green World“ anijoninis ozonizatorius padės ne tik palaikyti, bet ir gerokai pagerinti sveikatą. Jūs turite galimybę savo namuose naudoti nepakeičiamą prietaisą - anijoninį ozonizatorių, kuris apjungia visas tiek oro jonizatoriaus, tiek ozonizatoriaus (daugiafunkcinio...
Automobilio ozonizatorius aprūpintas apšvietimu ir kvapiosiomis medžiagomis. Ozonavimo ir jonizacijos režimus galima įjungti vienu metu. Šiuos režimus taip pat galima įjungti atskirai. Šis ozonizatorius yra nepamainomas ilgų kelionių metu, kai didėja vairuotojo nuovargis, pablogėja regėjimas ir atmintis. Ozonatorius malšina mieguistumą, suteikia energijos dėl...
OZONAS O3 (iš graikų kalbos ozono kvapo) yra alotropinė deguonies modifikacija, kuri gali egzistuoti visose trijose agregacijos būsenose. Ozonas yra nestabilus junginys ir net kambario temperatūroje lėtai skyla į molekulinį deguonį, tačiau ozonas nėra radikalas.
Fizinės savybės
Molekulinė masė = 47,9982 g/mol. Ozono dujų tankis yra 2,144 10-3 g/cm3 esant 1 atm slėgiui ir 29° C temperatūrai.
Ozonas yra ypatinga medžiaga. Jis itin nestabilus ir, didėjant koncentracijai, lengvai disproporcingas pagal bendrą schemą: 2O3 -> 3O2 Dujinėje formoje ozonas turi melsvą atspalvį, pastebimą, kai ore yra 15-20 % ozono.
Ozonas prie normaliomis sąlygomis- aštraus kvapo dujos. Esant labai mažoms koncentracijoms, ozono kvapas suvokiamas kaip maloniai gaivus, tačiau didėjant koncentracijai tampa nemalonus. Sušalusių skalbinių kvapas yra ozono kvapas. Lengva priprasti.
Pagrindinis jo kiekis telkiasi vadinamojoje „ozono juostoje“ 15–30 km aukštyje. Žemės paviršiuje ozono koncentracija yra daug mažesnė ir yra visiškai saugi gyvoms būtybėms; netgi yra nuomonė, kad visiškas jo nebuvimas taip pat neigiamai veikia žmogaus veiklą.
Esant maždaug 10 MAC koncentracijai, ozonas jaučiamas labai gerai, tačiau po kelių minučių jausmas beveik visiškai išnyksta. Tai reikia turėti omenyje dirbant su juo.
Tačiau ozonas taip pat užtikrina gyvybės išsaugojimą Žemėje, nes Ozono sluoksnis sulaiko žalingiausią saulės ultravioletinės spinduliuotės dalį, kurios bangos ilgis mažesnis nei 300 nm gyviems organizmams ir augalams, ir kartu su CO2 sugeria Žemės infraraudonąją spinduliuotę, neleidžiant jai atvėsti.
Ozonas geriau tirpsta vandenyje nei deguonis. Vandenyje ozonas skyla daug greičiau nei dujų fazėje, o priemaišų, ypač metalo jonų, buvimas turi itin didelę įtaką skilimo greičiui.
1 pav. Ozono skilimas į įvairių tipų 20°C temperatūros vanduo (1 – bidistiliatas; 2 – distiliatas; 3 – vandentiekio vanduo; 4 – filtruotas ežero vanduo)
Ozoną gerai adsorbuoja silikagelis ir aliuminio gelis. Esant daliniam ozono slėgiui, pavyzdžiui, 20 mm Hg. Art., o 0°C temperatūroje silikagelis sugeria apie 0,19 % ozono pagal svorį. Esant žemai temperatūrai, adsorbcija pastebimai susilpnėja. Adsorbuotas ozonas yra labai stabilus. Ozono jonizacijos potencialas yra 12,8 eV.
Cheminės ozono savybės
Jie išsiskiria dviem pagrindinėmis savybėmis – nestabilumu ir gebėjimu oksiduoti. Mažomis koncentracijomis sumaišytas su oru, jis suyra gana lėtai, tačiau kylant temperatūrai jo skilimas pagreitėja, o aukštesnėje nei 100 ° C temperatūroje jis tampa labai greitas.
NO2, Cl buvimas ore, taip pat katalizinis metalų oksidų – sidabro, vario, geležies, mangano – poveikis pagreitina ozono skilimą. Ozonas turi tokias stiprias oksidacines savybes, nes vienas iš deguonies atomų labai lengvai atsiskiria nuo jo molekulės. Lengvai virsta deguonimi.
Ozonas oksiduoja daugumą metalų įprastoje temperatūroje. Rūgštiniai vandeniniai ozono tirpalai yra gana stabilūs, šarminiuose tirpaluose ozonas greitai sunaikinamas. Kintamo valentingumo metalai (Mn, Co, Fe ir kt.), daugelis oksidų, peroksidų ir hidroksidų efektyviai ardo ozoną. Dauguma metalinių paviršių yra padengti oksido plėvele, kuri yra aukščiausios metalo valentinės būsenos (pavyzdžiui, PbO2, AgO arba Ag2O3, HgO).
Ozonas oksiduoja visus metalus, išskyrus aukso ir platinos grupės metalus, reaguoja su dauguma kitų elementų, skaido vandenilio halogenidus (išskyrus HF), žemesnius oksidus paverčia aukštesniaisiais ir kt.
Neoksiduoja aukso, platinos, iridžio, 75%Fe + 25%Cr lydinio. Juodąjį švino sulfidą PbS paverčia baltuoju sulfatu PbSO4, arseno anhidridą As2O3 į arseno anhidridą As2O5 ir kt.
Ozono reakcija su kintamo valentingumo metalo jonais (Mn, Cr ir Co) in pastaraisiais metais randa praktinį pritaikymą tarpinių produktų sintezei dažams, vitaminui PP (izonikotino rūgščiai) ir kt. Mangano ir chromo druskų mišiniai rūgštiniame tirpale, kuriame yra oksiduojamo junginio (pavyzdžiui, metilpiridinų), oksiduojami ozonu. Tokiu atveju Cr3+ jonai virsta Cr6+ ir oksiduoja metilpiridinus tik ties metilo grupėmis. Trūkstant metalų druskų, sunaikinama daugiausia aromatinė šerdis.
Ozonas taip pat reaguoja su daugeliu atmosferoje esančių dujų. Vandenilio sulfidas H2S, susijungęs su ozonu, išskiria laisvą sierą, sieros dioksidas SO2 virsta sieros dioksidu SO3; azoto oksidas N2O - į oksidą NO, azoto oksidas NO greitai oksiduojasi iki NO2, savo ruožtu NO2 taip pat reaguoja su ozonu ir galiausiai susidaro N2O5; amoniakas NH3 - į azoto amoniako druską NH4NO3.
Viena iš svarbiausių ozono reakcijų su neorganinėmis medžiagomis yra kalio jodido skilimas. Ši reakcija plačiai naudojama kiekybiniam ozono nustatymui.
Ozonas kai kuriais atvejais reaguoja su kietomis medžiagomis, sudarydamas ozonidus. Išskirti šarminių metalų ir žemės šarminių metalų ozonidai: stroncis, baris ir jų stabilizavimosi temperatūros padidėjimas nurodytose serijose; Ca(O3) 2 yra stabilus esant 238 K, Ba(O3) 2 prie 273 K. Ozonidai suyra, sudarydami superoksidą, pavyzdžiui, NaO3 -> NaO2 + 1/2O2. Įvairūs ozonidai susidaro ir vykstant ozono reakcijoms su organiniais junginiais.
Ozonas oksiduoja daugybę organinių medžiagų, sočiųjų, nesočiųjų ir ciklinių angliavandenilių. Paskelbta daug darbų apie ozono reakcijos su įvairiais aromatiniais angliavandeniliais produktų sudėtį: benzeną, ksileną, naftaleną, fenantreną, antraceną, benzantraceną, difenilaminą, chinoliną, akrilo rūgštį ir kt. Dėl to išblukina indigo ir daugelio kitų organinių dažų spalvą. prie kurių jis naudojamas net audiniams balinti.
Ozono su dviguba C=C jungtimi reakcijos greitis yra 100 000 kartų didesnis nei ozono su viengubu ryšiu reakcijos greitis C-C jungtis. Todėl gumą ir gumą pirmiausia veikia ozonas. Ozonas reaguoja su dviguba jungtimi ir sudaro tarpinį kompleksą:

Ši reakcija vyksta gana greitai net žemesnėje nei 0°C temperatūroje. Sočiųjų junginių atveju ozonas inicijuoja įprastą oksidacijos reakciją:

Įdomi ozono sąveika su kai kuriais organiniais dažais, kurie, esant ozonui ore, stipriai fluorescuoja. Tai, pavyzdžiui, eichrozinas, riboflavinas ir luminolis (triaminoftalhidrazidas), o ypač rodaminas-B ir, panašus į jį, rodaminas-C.
Didelės ozono oksidacinės savybės, naikinančios organines medžiagas ir oksiduojant metalus (ypač geležį) iki netirpios formos, gebėjimas skaidyti vandenyje tirpius dujinius junginius, prisotinti vandeninius tirpalus deguonimi, mažas ozono atsparumas vandenyje ir savaiminis sunaikinimas. pavojingų žmogui savybių – visa tai kartu paverčia ozoną patraukliausia medžiaga buitiniam vandeniui ruošti ir įvairioms nuotekoms valyti.
Ozono sintezė
Ozonas susidaro dujų aplinkoje, kurioje yra deguonies, jei susidaro sąlygos, kurioms esant deguonis disocijuoja į atomus. Tai įmanoma visų formų elektros iškrovose: švytėjimo, lanko, kibirkšties, vainiko, paviršiaus, barjero, be elektrodų ir kt. Pagrindinė disociacijos priežastis yra molekulinio deguonies susidūrimas su elektronais, pagreitintais elektriniame lauke.
Be iškrovos, deguonies disociaciją sukelia UV spinduliuotė, kurios bangos ilgis mažesnis nei 240 nm, ir įvairios didelės energijos dalelės: alfa, beta, gama dalelės, rentgeno spinduliai ir kt. Ozonas taip pat susidaro elektrolizės būdu vandeniui.
Beveik visuose ozono susidarymo šaltiniuose yra grupė reakcijų, dėl kurių ozonas suyra. Jie trukdo formuotis ozonui, tačiau jie tikrai egzistuoja ir į juos reikia atsižvelgti. Tai apima terminį skilimą reaktoriaus tūryje ir ant sienelių, jo reakcijas su radikalais ir sužadintomis dalelėmis, reakcijas su priedais ir priemaišomis, kurios gali liestis su deguonimi ir ozonu.
Visas mechanizmas susideda iš daugybės reakcijų. Tikri įrenginiai, nesvarbu, kokiu principu jie veikia, rodo dideles energijos sąnaudas ozono gamybai. Ozono generatoriaus efektyvumas priklauso nuo galios tipo – bendros ar aktyvios – skaičiuojamas susidarančio ozono masės vienetas.
Barjerinis iškrovimas
Barjerinis išlydis suprantamas kaip išlydis, atsirandantis tarp dviejų dielektrikų arba dielektriko ir metalo. Dėl to, kad dielektrikas nutraukia elektros grandinę, maitinimas tiekiamas tik kintama srove. Pirmąjį ozonizatorių, artimą šiuolaikiniams, 1897 metais pasiūlė Siemens.
Esant mažoms galioms, ozonizatoriaus aušinti nereikia, nes susidariusi šiluma pasišalina deguonies ir ozono srautu. IN pramoninės gamybos Ozonas taip pat sintetinamas lankiniuose ozonizatoriuose (plazmatronuose), švytėjimo ozono generatoriuose (lazeriuose) ir paviršiniuose išlydžiuose.
Fotocheminis metodas
Didžioji dalis Žemėje susidarančio ozono gamtoje susidaro fotochemiškai. IN praktinė veiklaŽmonėms fotocheminės sintezės metodai atlieka mažesnį vaidmenį nei barjerinės iškrovos sintezė. Pagrindinė jų naudojimo sritis yra vidutinės ir mažos ozono koncentracijos gavimas. Tokios ozono koncentracijos reikalingos, pavyzdžiui, bandant gumos gaminių atsparumą įtrūkimams, veikiant atmosferos ozonui. Praktiškai ozonui gaminti šiuo metodu naudojamos gyvsidabrio ir eksimerinės ksenono lempos.
Elektrolitinės sintezės metodas
Pirmasis ozono susidarymo elektrolitiniuose procesuose paminėjimas datuojamas 1907 m. Tačiau iki šių dienų jo susidarymo mechanizmas lieka neaiškus.
Paprastai kaip elektrolitas naudojami vandeniniai perchloro arba sieros rūgšties tirpalai, elektrodai pagaminti iš platinos. O18 pažymėtų rūgščių naudojimas parodė, kad formuojantis ozonui jos neatsisako deguonies. Todėl bendroje diagramoje turėtų būti atsižvelgiama tik į vandens skilimą:
H2O + O2 -> O3 + 2H+ + e-
su galimu tarpiniu jonų ar radikalų susidarymu.
Ozono susidarymas veikiant jonizuojančiai spinduliuotei
Ozonas susidaro per daugybę procesų, apimančių deguonies molekulės sužadinimą šviesa arba elektriniu lauku. Apšvitinus deguonimi jonizuojanti radiacija taip pat gali atsirasti sužadintų molekulių ir stebimas ozono susidarymas. Ozono susidarymas, veikiamas jonizuojančiosios spinduliuotės, dar nebuvo panaudotas ozono sintezei.
Ozono susidarymas mikrobangų lauke
Kai deguonies srautas buvo praleidžiamas per mikrobangų lauką, buvo stebimas ozono susidarymas. Šis procesas mažai ištirtas, nors šiuo reiškiniu pagrįsti generatoriai dažnai naudojami laboratorinėje praktikoje.
Ozono naudojimas kasdieniame gyvenime ir jo poveikis žmonėms
Vandens, oro ir kitų medžiagų ozonavimas
Ozonuotame vandenyje nėra toksiškų halogenometanų – tipiškų vandens sterilizavimo chloru priemaišų. Ozonavimo procesas vykdomas burbulinėse voniose arba maišytuvuose, kuriuose nuo skendinčių medžiagų išvalytas vanduo sumaišomas su ozonuotu oru arba deguonimi. Proceso trūkumas yra greitas O3 sunaikinimas vandenyje (pusėjimo laikas 15-30 minučių).
Ozonavimas taip pat naudojamas Maisto pramonešaldytuvų, sandėlių sterilizavimui, nemalonių kvapų panaikinimui; medicinos praktikoje - atvirų žaizdų dezinfekcijai ir tam tikrų lėtinių ligų (trofinių opų, grybelinių ligų) gydymui, veninio kraujo ozonavimui, fiziologiniams tirpalams.
Šiuolaikiniai ozonizatoriai, kuriuose ozonas gaminamas naudojant elektros išlydį ore arba deguonyje, susideda iš ozono generatorių ir energijos šaltinių ir yra neatskiriama ozonizatorių įrenginių dalis, kuri, be ozonizatorių, apima ir pagalbinius įtaisus.
Šiuo metu ozonas yra dujos, naudojamos vadinamosiose ozono technologijose: geriamojo vandens valymui ir ruošimui, nuotekų valymui (buitinių ir pramoninių nuotekų), išmetamosiose dujose ir kt.
Priklausomai nuo ozono naudojimo technologijos, ozonizatoriaus našumas gali svyruoti nuo gramo frakcijų iki dešimčių kilogramų ozono per valandą. Medicinos instrumentų ir smulkios įrangos sterilizavimui dujomis naudojami specialūs ozonizatoriai. Sterilizacija atliekama dirbtinai sudrėkintoje ozono-deguonies aplinkoje, kuri užpildo sterilizavimo kamerą. Sterilizacijos ciklas susideda iš oro sterilizavimo kameroje pakeitimo drėgnu ozono-deguonies mišiniu, sterilizacijos poveikio etapo ir ozono-deguonies mišinio kameroje pakeitimo mikrobiologiškai išvalytu oru etapo.
Medicinoje ozono terapijai naudojami ozonizatoriai turi platų ozono ir deguonies mišinio koncentracijos reguliavimo diapazoną. Garantuojamas generuojamos ozono-deguonies mišinio koncentracijos tikslumas yra valdomas ozonatoriaus automatikos sistemos ir yra automatiškai palaikomas.
Biologinis ozono poveikis
Biologinis ozono poveikis priklauso nuo jo panaudojimo būdo, dozės ir koncentracijos. Daugelis jo poveikio įvairiuose koncentracijos diapazonuose pasireiškia įvairaus laipsnio. Terapinis ozono terapijos poveikis pagrįstas ozono ir deguonies mišinių naudojimu. Didelis ozono redokso potencialas lemia jo sisteminį (deguonies homeostazės atstatymą) ir vietinį (ryškų dezinfekcinį) gydomąjį poveikį.
Pirmą kartą ozoną kaip antiseptiką užkrėstoms žaizdoms gydyti 1915 metais panaudojo A. Wolffas. Pastaraisiais metais ozono terapija sėkmingai taikoma beveik visose medicinos srityse: skubiosios ir pūlingos chirurgijos, bendrosios ir. infekcinė terapija, ginekologija, urologija, gastroenterologija, dermatologija, kosmetologija ir kt. Ozonas naudojamas dėl unikalaus poveikio organizmui spektro, įskaitant. imunomoduliuojantis, priešuždegiminis, baktericidinis, antivirusinis, fungicidinis ir kt.
Tačiau negalima paneigti, kad ozono panaudojimo medicinoje metodai, nepaisant akivaizdžių daugelio biologinių rodiklių pranašumų, vis dar yra platus pritaikymas negavo. Literatūros duomenimis, didelė ozono koncentracija yra absoliučiai baktericidinė beveik visoms mikroorganizmų padermėms. Todėl ozonas klinikinėje praktikoje naudojamas kaip universalus antiseptikas įvairios etiologijos ir lokalizacijos infekcinių ir uždegiminių židinių sanitarijai.
Literatūroje yra duomenų apie padidėjusį antiseptinių vaistų veiksmingumą po jų ozonavimo gydant ūmias pūlingas chirurgines ligas.
Išvados dėl ozono naudojimo buityje
Visų pirma, būtina besąlygiškai patvirtinti ozono naudojimo praktikoje daugelio medicinos sričių, kaip gydomosios ir dezinfekuojančios, faktą, tačiau apie platų jo naudojimą dar negalima kalbėti.
Ozoną žmonės suvokia su mažiausiais alerginiais šalutiniais poveikiais. Ir net jei literatūroje galima rasti nuorodų apie individualų netoleravimą O3, šių atvejų jokiu būdu negalima lyginti, pavyzdžiui, su chloro turinčiais ir kitais halogenų kilmės antibakteriniais vaistais.
Ozonas yra triatominis deguonis ir yra ekologiškiausias. Kas nežino jo „gaivaus“ kvapo – karštomis vasaros dienomis po perkūnijos?! Bet kuris gyvas organizmas nuolat patiria savo buvimą žemės atmosferoje.
Apžvalga sudaryta remiantis medžiaga iš interneto.
Mokslininkai pirmą kartą sužinojo apie nežinomų dujų egzistavimą, kai pradėjo eksperimentuoti su elektrostatinėmis mašinomis. Tai atsitiko XVII a. Tačiau jie pradėjo tyrinėti naujas dujas tik kito amžiaus pabaigoje. 1785 metais olandų fizikas Martinas van Marumas gavo ozoną leisdamas elektros kibirkštis per deguonį. Ozono pavadinimas atsirado tik 1840 m.; jį išrado šveicarų chemikas Christianas Schönbeinas, kildinamas iš graikiško ozono – kvapo. Cheminė šių dujų sudėtis nesiskyrė nuo deguonies, tačiau buvo daug agresyvesnė. Taigi jis akimirksniu oksidavo bespalvį kalio jodidą, išskirdamas rudą jodą; Schönbein panaudojo šią reakciją ozonui nustatyti pagal popieriaus, įmirkyto kalio jodido ir krakmolo tirpale, mėlynumo laipsnį. Net gyvsidabris ir sidabras, kurie kambario temperatūroje yra neaktyvūs, oksiduojasi esant ozonui.
Paaiškėjo, kad ozono molekulės, kaip ir deguonis, susideda tik iš deguonies atomų, bet ne dviejų, o trijų. Deguonis O2 ir ozonas O3 yra vienintelis pavyzdys, kai iš vieno cheminio elemento susidaro dvi dujinės (įprastomis sąlygomis) paprastos medžiagos. O3 molekulėje atomai išsidėstę kampu, todėl šios molekulės yra polinės. Ozonas gaunamas „prilipus“ laisviesiems deguonies atomams prie O2 molekulių, kurios susidaro iš deguonies molekulių veikiant elektros iškrovoms, ultravioletiniams spinduliams, gama spinduliams, greitiesiems elektronams ir kitoms didelės energijos dalelėms. Visada tvyro ozono kvapas prie veikiančių elektrinių mašinų, kuriose „kibirkščiuoja“ šepečiai, ir šalia baktericidinių gyvsidabrio-kvarcinių lempų, skleidžiančių ultravioletinę šviesą. Tam tikrų cheminių reakcijų metu taip pat išsiskiria deguonies atomai. Ozonas nedideliais kiekiais susidaro vykstant parūgštinto vandens elektrolizei, lėtai oksiduojantis šlapiam baltajam fosforui ore, skaidant junginius, kuriuose yra daug deguonies (KMnO4, K2Cr2O7 ir kt.), fluorui veikiant vandenį. arba koncentruota sieros rūgštis ant bario peroksido. Deguonies atomų liepsnoje visada yra, todėl jei suspausto oro srovę nukreipsite per deguonies degiklio liepsną, ore bus aptiktas būdingas ozono kvapas.
Reakcija 3O2 → 2O3 yra labai endoterminė: norint gauti 1 molį ozono, reikia sunaudoti 142 kJ. Atvirkštinė reakcija įvyksta išleidžiant energiją ir yra atliekama labai lengvai. Atitinkamai, ozonas yra nestabilus. Nesant priemaišų, ozono dujos lėtai skyla esant 70° C temperatūrai ir greitai virš 100° C. Esant katalizatoriams ozono skilimo greitis žymiai padidėja. Tai gali būti dujos (pavyzdžiui, azoto oksidas, chloras) ir daugelis kietųjų medžiagų (netgi indo sienelės). Todėl gryno ozono sunku gauti, o dirbti su juo pavojinga dėl galimo sprogimo.
Nenuostabu, kad daugelį dešimtmečių po ozono atradimo net pagrindinės jo fizinės konstantos buvo nežinomos: ilgą laiką niekas negalėjo gauti gryno ozono. Kaip rašė D.I.Mendelejevas savo vadovėlyje „Chemijos pagrindai“, „naudojant visus ozono dujų paruošimo būdus, jo kiekis deguonyje visada yra nereikšmingas, dažniausiai tik kelias dešimtąsias procentų, retai 2%, ir tik esant labai žemai temperatūrai. 20 proc.“ Tik 1880 m. prancūzų mokslininkai J. Gotfeilas ir P. Chappuis iš gryno deguonies gavo ozoną minus 23 ° C temperatūroje. Paaiškėjo, kad storame sluoksnyje ozonas turi gražią mėlyną spalvą. Lėtai suspaudus atvėsusį ozonuotą deguonį, dujos pasidarė tamsiai mėlynos, o greitai atleidus slėgį temperatūra dar labiau nukrito ir susidarė tamsiai violetiniai skysto ozono lašeliai. Jei dujos nebuvo greitai atvėsintos ar suslėgtos, ozonas akimirksniu, su geltonu blyksniu, pavirto deguonimi.
Vėliau buvo sukurtas patogus ozono sintezės metodas. Jei koncentruotas perchloro, fosforo ar sieros rūgšties tirpalas yra elektrolizuojamas atšaldytu platinos arba švino (IV) oksido anodu, anode išsiskiriančiose dujose bus iki 50 % ozono. Taip pat buvo patobulintos fizinės ozono konstantos. Jis suskystėja daug lengviau nei deguonis - esant -112° C temperatūrai (deguonis - prie -183° C). Esant –192,7° C ozonas sukietėja. Kietas ozonas yra melsvai juodos spalvos.
Eksperimentai su ozonu yra pavojingi. Ozono dujos gali sprogti, jei jų koncentracija ore viršija 9%. Skystas ir kietas ozonas sprogsta dar lengviau, ypač kontaktuodamas su oksiduojančiomis medžiagomis. Ozonas gali būti laikomas žemoje temperatūroje tirpalų pavidalu fluorintuose angliavandeniliuose (freonuose). Tokie sprendimai yra mėlynos spalvos.
Cheminės ozono savybės.
Ozonas pasižymi itin dideliu reaktyvumu. Ozonas yra vienas stipriausių oksidatorių ir šiuo atžvilgiu nusileidžia tik fluorui ir deguonies fluoridui OF2. Aktyvus ozono, kaip oksidatoriaus, principas yra atominis deguonis, susidarantis ozono molekulei irstant. Todėl, veikdama kaip oksidatorius, ozono molekulė, kaip taisyklė, „naudoja“ tik vieną deguonies atomą, o kiti du išsiskiria laisvo deguonies pavidalu, pavyzdžiui, 2KI + O3 + H2O → I2 + 2KOH + O2. Taip pat vyksta daugelio kitų junginių oksidacija. Tačiau yra išimčių, kai ozono molekulė oksidacijai naudoja visus tris turimus deguonies atomus, pavyzdžiui, 3SO2 + O3 → 3SO3; Na2S + O3 → Na2SO3.
Labai svarbus skirtumas tarp ozono ir deguonies yra tas, kad ozonas pasižymi oksidacinėmis savybėmis jau kambario temperatūroje. Pavyzdžiui, PbS ir Pb(OH)2 normaliomis sąlygomis nereaguoja su deguonimi, o esant ozonui sulfidas virsta PbSO4, o hidroksidas – PbO2. Jei į indą su ozonu pilamas koncentruotas amoniako tirpalas, atsiras balti dūmai – tai ozoną oksiduojantis amoniakas, sudarydamas amonio nitritą NH4NO2. Ypač ozonui būdingas gebėjimas „pajuodinti“ sidabro dirbinius, susidarant AgO ir Ag2O3.
Pridėjus vieną elektroną ir tapus neigiamu O3– jonu, ozono molekulė tampa stabilesnė. „Ozono rūgšties druskos“ arba tokių anijonų turintys ozonidai žinomi nuo seno – jas sudaro visi šarminiai metalai, išskyrus litį, o ozonidų stabilumas didėja nuo natrio iki cezio. Taip pat žinomi kai kurie šarminių žemės metalų ozonidai, pavyzdžiui, Ca(O3)2. Jei ozono dujų srautas nukreipiamas į kieto sauso šarmo paviršių, susidaro oranžinė-raudona pluta, kurioje yra ozonidų, pavyzdžiui, 4KOH + 4O3 → 4KO3 + O2 + 2H2O. Tuo pačiu metu kietas šarmas efektyviai suriša vandenį, kuris apsaugo ozonidą nuo greito hidrolizės. Tačiau esant vandens pertekliui, ozonidai greitai suyra: 4KO3+ 2H2O → 4KOH + 5O2. Skilimas vyksta ir sandėliuojant: 2KO3 → 2KO2 + O2. Ozonidai labai gerai tirpsta skystame amoniake, todėl buvo galima juos išskirti gryna forma ir ištirti jų savybes.
Organinės medžiagos, su kuriomis liečiasi ozonas, dažniausiai sunaikinamos. Taigi ozonas, skirtingai nei chloras, gali suskaidyti benzeno žiedą. Dirbdami su ozonu, negalite naudoti guminių vamzdžių ir žarnų - jie akimirksniu taps nesandarūs. Ozono reakcijos su organiniais junginiais išskiria daug energijos. Pavyzdžiui, eteris, alkoholis, terpentinu suvilgyta vata, metanas ir daugelis kitų medžiagų savaime užsiliepsnoja sąlytyje su ozonuotu oru, o sumaišius ozoną su etilenu, įvyksta stiprus sprogimas.
Ozono taikymas.
Ozonas ne visada „degina“ organines medžiagas; kai kuriais atvejais galima atlikti specifines reakcijas su labai praskiestu ozonu. Pavyzdžiui, oleino rūgštį ozonuojant (jos dideliais kiekiais randama augaliniuose aliejuose), susidaro azelaino rūgštis HOOC(CH2)7COOH, iš kurios gaminamos aukštos kokybės tepalinės alyvos, sintetiniai pluoštai ir plastikų plastifikatoriai. Panašiai gaunama adipo rūgštis, kuri naudojama nailono sintezei. 1855 metais Schönbeinas atrado nesočiųjų junginių, turinčių dvigubus C=C ryšius, reakciją su ozonu, tačiau tik 1925 metais vokiečių chemikas H. Staudingeris nustatė šios reakcijos mechanizmą. Ozono molekulė prisijungia prie dvigubos jungties, sudarydama ozonidą - šį kartą organinį, o deguonies atomas pakeičia vieną iš C=C jungčių, o –O–O– grupė užima kitą. Nors kai kurie organiniai ozonidai išskiriami gryna forma (pavyzdžiui, etileno ozonidas), ši reakcija dažniausiai atliekama praskiestame tirpale, nes laisvieji ozonidai yra labai nestabilūs sprogmenys. Nesočiųjų junginių ozonavimo reakcija labai vertinama organinių chemikų; Problemos dėl šios reakcijos dažnai siūlomos net mokyklos varžybose. Faktas yra tas, kad kai ozonidas skyla su vandeniu, susidaro dvi aldehido arba ketono molekulės, kurias lengva atpažinti ir toliau nustatyti pradinio nesočiojo junginio struktūrą. Taigi XX amžiaus pradžioje chemikai nustatė daugelio svarbių organinių junginių, įskaitant natūralius, struktūrą, turinčią C=C jungtis.
Svarbi ozono naudojimo sritis yra geriamojo vandens dezinfekcija. Paprastai vanduo yra chloruotas. Tačiau kai kurios priemaišos vandenyje, veikiamos chloro, virsta junginiais, turinčiais labai nemalonų kvapą. Todėl jau seniai buvo siūloma chlorą pakeisti ozonu. Ozonuotas vanduo neįgauna pašalinio kvapo ar skonio; Kai daug organinių junginių visiškai oksiduojasi ozonu, susidaro tik anglies dioksidas ir vanduo. Ozonas taip pat valo nuotekas. Ozono oksidacijos produktai net tokių teršalų kaip fenoliai, cianidai, aktyviosios paviršiaus medžiagos, sulfitai, chloraminai yra nekenksmingi, bespalviai ir bekvapiai junginiai. Ozono perteklius gana greitai suyra ir susidaro deguonis. Tačiau vandens ozonavimas yra brangesnis nei chloravimas; Be to, ozonas negali būti transportuojamas ir turi būti gaminamas naudojimo vietoje.
Ozonas atmosferoje.
Žemės atmosferoje ozono yra mažai – 4 milijardai tonų, t.y. vidutiniškai tik 1 mg/m3. Ozono koncentracija didėja tolstant nuo Žemės paviršiaus ir pasiekia maksimumą stratosferoje, 20–25 km aukštyje - tai yra „ozono sluoksnis“. Jei visas ozonas iš atmosferos būtų surinktas Žemės paviršiuje esant normaliam slėgiui, susidaręs sluoksnis būtų tik apie 2–3 mm storio. Ir tokie nedideli ozono kiekiai ore iš tikrųjų palaiko gyvybę Žemėje. Ozonas sukuria „apsauginį ekraną“, neleidžiantį Žemės paviršiaus pasiekti kietiems saulės ultravioletiniams spinduliams, kurie kenkia visai gyvai būtybei.
Pastaraisiais dešimtmečiais daug dėmesio buvo skiriama vadinamųjų „ozono skylių“ atsiradimui – vietovėms, kuriose labai sumažėjęs stratosferos ozono lygis. Per tokį „nesandarių“ skydą Žemės paviršių pasiekia atšiauresnė Saulės ultravioletinė spinduliuotė. Štai kodėl mokslininkai ilgą laiką stebėjo ozoną atmosferoje. 1930 metais anglų geofizikas S. Chapmanas, norėdamas paaiškinti nuolatinę ozono koncentraciją stratosferoje, pasiūlė keturių reakcijų schemą (šios reakcijos buvo vadinamos Chapmano ciklu, kuriame M reiškia bet kurį atomą ar molekulę, kuri išneša energijos perteklių). :
О2 → 2О
O + O + M → O2 + M
O + O3 → 2O2
O3 → O2 + O.
Pirmoji ir ketvirtoji šio ciklo reakcijos yra fotocheminės, jos vyksta veikiant saulės spinduliuotei. Norint suskaidyti deguonies molekulę į atomus, reikalinga spinduliuotė, kurios bangos ilgis mažesnis nei 242 nm, o ozonas suyra, kai šviesa absorbuojama 240–320 nm srityje (pastaroji reakcija tiksliai apsaugo mus nuo stiprios ultravioletinės spinduliuotės, nes deguonis neabsorbuoja šioje spektro srityje). Likusios dvi reakcijos yra terminės, t.y. eiti be šviesos įtakos. Labai svarbu, kad trečioji reakcija, vedanti į ozono išnykimą, turėtų aktyvavimo energiją; tai reiškia, kad tokios reakcijos greitis gali būti padidintas veikiant katalizatoriams. Kaip paaiškėjo, pagrindinis ozono skilimo katalizatorius yra azoto oksidas NO. Jis susidaro viršutiniuose atmosferos sluoksniuose iš azoto ir deguonies, veikiamas atšiauriausios saulės spinduliuotės. Patekęs į ozonosferą, jis patenka į dviejų reakcijų ciklą O3 + NO → NO2 + O2, NO2 + O → NO + O2, dėl ko jo kiekis atmosferoje nekinta, o stacionari ozono koncentracija mažėja. Yra ir kitų ciklų, dėl kurių sumažėja ozono kiekis stratosferoje, pavyzdžiui, dalyvaujant chlorui:
Cl + O3 → ClO + O2
ClO + O → Cl + O2.
Ozoną taip pat ardo dulkės ir dujos, kurios dideliais kiekiais patenka į atmosferą ugnikalnių išsiveržimų metu. Pastaruoju metu buvo teigiama, kad ozonas taip pat veiksmingai naikina iš žemės plutos išsiskiriantį vandenilį. Visų ozono susidarymo ir skilimo reakcijų derinys lemia tai, kad vidutinė ozono molekulės gyvenimo trukmė stratosferoje yra apie tris valandas.
Manoma, kad be natūralių, yra ir dirbtinių veiksnių, kurie veikia ozono sluoksnį. Gerai žinomas pavyzdys yra freonai, kurie yra chloro atomų šaltiniai. Freonai yra angliavandeniliai, kuriuose vandenilio atomai yra pakeisti fluoro ir chloro atomais. Jie naudojami šaldymo technologijoje ir aerozolinių balionėlių užpildymui. Galiausiai freonai patenka į orą ir su oro srovėmis lėtai kyla vis aukščiau ir aukščiau, galiausiai pasiekdami ozono sluoksnį. Skildami saulės spinduliuotės įtakoje, patys freonai pradeda kataliziškai skaidyti ozoną. Kol kas tiksliai nežinoma, kiek freonai yra kalti dėl „ozono skylės“, ir, nepaisant to, jau seniai imtasi priemonių jų naudojimui apriboti.
Skaičiavimai rodo, kad per 60–70 metų ozono koncentracija stratosferoje gali sumažėti 25 proc. O tuo pačiu padidės ozono koncentracija gruntiniame sluoksnyje – troposferoje, o tai irgi blogai, nes ozonas ir jo virsmo produktai ore yra nuodingi. Pagrindinis ozono šaltinis troposferoje yra stratosferos ozono pernešimas su oro masėmis į apatinius sluoksnius. Kasmet į gruntinį sluoksnį patenka maždaug 1,6 milijardo tonų ozono. Ozono molekulės gyvavimo laikas apatinėje atmosferos dalyje yra daug ilgesnis - daugiau nei 100 dienų, nes ozoną ardančios ultravioletinės saulės spinduliuotės intensyvumas žemesniame sluoksnyje yra mažesnis. Paprastai troposferoje ozono yra labai mažai: gryname gryname ore jo koncentracija vidutiniškai siekia tik 0,016 μg/l. Ozono koncentracija ore priklauso ne tik nuo aukščio virš jūros lygio, bet ir nuo reljefo. Taigi ozono virš vandenynų visada yra daugiau nei sausumoje, nes ten ozonas skyla lėčiau. Matavimai Sočyje parodė, kad ore prie jūros pakrantės yra 20% daugiau ozono nei miške, esančiame 2 km nuo kranto.
Šiuolaikiniai žmonės įkvepia žymiai daugiau ozono nei jų protėviai. Pagrindinė to priežastis – ore padidėjęs metano ir azoto oksidų kiekis. Taigi metano kiekis atmosferoje nuolat didėjo nuo XIX amžiaus vidurio, kai buvo pradėtos naudoti gamtinės dujos. Atmosferoje, užterštoje azoto oksidais, metanas patenka į sudėtingą virsmų grandinę, kurioje dalyvauja deguonis ir vandens garai, kurių rezultatas gali būti išreikštas lygtimi CH4 + 4O2 → HCHO + H2O + 2O3. Kiti angliavandeniliai taip pat gali veikti kaip metanas, pavyzdžiui, esantys automobilių išmetamosiose dujose nepilno benzino degimo metu. Dėl to per pastaruosius dešimtmečius ozono koncentracija didžiųjų miestų ore išaugo dešimt kartų.
Visada buvo manoma, kad perkūnijos metu ozono koncentracija ore smarkiai padidėja, nes žaibas skatina deguonies pavertimą ozonu. Tiesą sakant, padidėjimas yra nežymus, ir jis atsiranda ne per perkūniją, o kelias valandas prieš ją. Perkūnijos metu ir kelias valandas po jos ozono koncentracija mažėja. Tai paaiškinama tuo, kad prieš perkūniją vyksta stiprus vertikalus oro masių maišymasis, todėl iš viršutinių sluoksnių atsiranda papildomas ozono kiekis. Be to, prieš perkūniją padidėja elektrinio lauko stiprumas, susidaro sąlygos vainikiniam išlydžiui susidaryti įvairių objektų, pavyzdžiui, šakų, galiukuose. Tai taip pat prisideda prie ozono susidarymo. Ir tada, kai vystosi perkūnijos debesis, po juo kyla galingos aukštyn kylančios oro srovės, kurios sumažina ozono kiekį tiesiai po debesimi.
Įdomus klausimas yra apie ozono kiekį spygliuočių miškų ore. Pavyzdžiui, G. Remy „Neorganinės chemijos kurse“ galite perskaityti, kad „ozonuotas spygliuočių miškų oras“ yra fikcija. Ar taip yra? Žinoma, joks augalas negamina ozono. Tačiau augalai, ypač spygliuočiai, į orą išskiria daug lakiųjų organinių junginių, tarp jų ir terpenų klasės nesočiuosius angliavandenilius (terpentine jų yra daug). Taigi karštą dieną pušis išskiria 16 mikrogramų terpenų per valandą kiekvienam gramui sausos spyglių masės. Terpenus išskiria ne tik spygliuočiai, bet ir kai kurie lapuočių medžiai, tarp jų tuopos ir eukaliptai. O kai kurie atogrąžų medžiai per valandą gali išskirti 45 mcg terpenų 1 g sausos lapų masės. Dėl to per vieną hektarą spygliuočių miško per parą gali išsiskirti iki 4 kg organinių medžiagų, o iš lapuočių – apie 2 kg. Miškingas Žemės plotas yra milijonai hektarų, ir visi jie per metus išskiria šimtus tūkstančių tonų įvairių angliavandenilių, įskaitant terpenus. O angliavandeniliai, kaip parodyta metano pavyzdyje, veikiami saulės spinduliuotės ir esant kitoms priemaišoms, prisideda prie ozono susidarymo. Kaip parodė eksperimentai, terpenai tinkamomis sąlygomis iš tiesų labai aktyviai dalyvauja atmosferos fotocheminių reakcijų cikle, kai susidaro ozonas. Taigi ozonas spygliuočių miške – visai ne fikcija, o eksperimentinis faktas.
Ozonas ir sveikata.
Kaip gera pasivaikščioti po perkūnijos! Oras švarus ir gaivus, jo gaivinančios srovės tarsi be jokių pastangų teka į plaučius. „Kvepia ozonu“, – tokiais atvejais jie dažnai sako. „Labai naudinga sveikatai“. Ar taip yra?
Kadaise ozonas buvo laikomas naudingu sveikatai. Bet jei jo koncentracija viršija tam tikrą ribą, tai gali sukelti daug nemalonių pasekmių. Priklausomai nuo koncentracijos ir įkvėpimo laiko, ozonas sukelia pokyčius plaučiuose, dirgina akių ir nosies gleivinę, skauda galvą, svaigsta galva, sumažėja kraujospūdis; Ozonas mažina organizmo atsparumą bakterinėms kvėpavimo takų infekcijoms. Didžiausia leistina koncentracija ore yra tik 0,1 μg/l, vadinasi, ozonas yra daug pavojingesnis nei chloras! Kelias valandas praleidus patalpoje, kurioje ozono koncentracija siekia vos 0,4 μg/l, gali pasireikšti krūtinės skausmas, kosulys, nemiga, sumažėti regėjimo aštrumas. Jei ilgą laiką kvėpuosite ozonu, kurio koncentracija didesnė nei 2 μg/l, pasekmės gali būti sunkesnės – net suvirpėti ir sumažėti širdies veikla. Kai ozono kiekis yra 8–9 μg/l, per kelias valandas atsiranda plaučių edema, kuri gali būti mirtina. Tačiau tokius mažus medžiagos kiekius paprastai sunku išanalizuoti naudojant įprastinius cheminius metodus. Laimei, ozono buvimą žmogus jaučia net ir esant labai mažoms koncentracijoms – apie 1 µg/l, kai krakmolo jodo popierius dar nemėlynuoja. Vieniems mažos koncentracijos ozono kvapas primena chloro kvapą, kitiems – sieros dioksido, tretiems – česnako kvapą.
Toksiškas ne tik pats ozonas. Jam dalyvaujant ore, susidaro, pavyzdžiui, peroksiacetilnitratas (PAN) CH3–CO–OONO2 – medžiaga, kuri stipriai dirgina, įskaitant ašarojimą, apsunkina kvėpavimą, o didesnė koncentracija sukelia širdies paralyžių. PAN yra vienas iš vadinamojo fotocheminio smogo, susidarančio vasarą užterštame ore, komponentų (šis žodis kilęs iš angliško dūmų – dūmai ir migla – rūkas). Ozono koncentracija smoge gali siekti 2 µg/l, o tai 20 kartų viršija didžiausią leistiną ribą. Taip pat reikėtų atsižvelgti į tai, kad bendras ozono ir azoto oksidų poveikis ore yra dešimtis kartų stipresnis nei kiekvienos medžiagos atskirai. Nenuostabu, kad didžiuosiuose miestuose tokio smogo pasekmės gali būti katastrofiškos, ypač jei virš miesto esantis oras nėra prapučiamas „skersvėjų“ ir susidaro sąstingio zona. Taigi 1952 metais Londone per kelias dienas nuo smogo mirė daugiau nei 4000 žmonių. O smogas Niujorke 1963 metais pražudė 350 žmonių. Tokijuje ir kituose dideliuose miestuose buvo panašių istorijų. Nuo atmosferos ozono kenčia ne tik žmonės. Pavyzdžiui, amerikiečių mokslininkai įrodė, kad vietovėse, kuriose ore yra daug ozono, automobilių padangų ir kitų gumos gaminių tarnavimo laikas gerokai sutrumpėja.
Kaip sumažinti ozono kiekį žemės sluoksnyje? Vargu ar realu sumažinti metano išmetimą į atmosferą. Kitas būdas yra sumažinti azoto oksidų išmetimą, be kurio negali vykti ozono susidarymo reakcijų ciklas. Šis kelias taip pat nelengvas, nes azoto oksidus išmeta ne tik automobiliai, bet ir (daugiausia) šiluminės elektrinės.
Ozono šaltiniai yra ne tik gatvėse. Susidaro rentgeno kabinetuose, kineziterapijos kabinetuose (jo šaltinis – gyvsidabrio-kvarco lempos), eksploatuojant kopijavimo įrangą (kopijuoklius), lazerinius spausdintuvus (čia jo susidarymo priežastis – aukštos įtampos iškrova). Ozonas yra neišvengiamas perhidrolio ir argono lankinio suvirinimo gamybos palydovas. Norint sumažinti žalingą ozono poveikį, šalia ultravioletinių lempų būtina turėti vėdinimo įrangą ir gerą patalpos vėdinimą.
Ir vis dėlto vargu ar teisinga ozoną laikyti absoliučiai kenksmingu sveikatai. Viskas priklauso nuo jo koncentracijos. Tyrimai parodė, kad tamsoje grynas oras šviečia labai silpnai; Švytėjimo priežastis yra oksidacijos reakcijos, susijusios su ozonu. Švytėjimas buvo pastebėtas ir purtant vandenį kolboje, į kurią anksčiau buvo įvestas ozonuotas deguonis. Šis švytėjimas visada siejamas su nedideliu organinių priemaišų kiekiu ore ar vandenyje. Kai grynas oras susimaišė su žmogaus iškvepiamu kvėpavimu, švytėjimo intensyvumas padidėjo dešimt kartų! Ir tai nenuostabu: iškvepiamame ore rasta etileno, benzeno, acetaldehido, formaldehido, acetono, skruzdžių rūgšties mikropriemaišų. Juos „išryškina“ ozonas. Tuo pačiu „pasenęs“, t.y. visiškai be ozono, nors ir labai švarus, oras nešviečia, o žmogus jį suvokia kaip „užpūstą“. Tokį orą galima palyginti su distiliuotu vandeniu: jis labai švarus, praktiškai be priemaišų, o gerti – žalinga. Taigi visiškas ozono nebuvimas ore, matyt, ir žmogui nepalankus, nes jame didėja mikroorganizmų kiekis ir kaupiasi kenksmingos medžiagos bei nemalonūs kvapai, kuriuos ozonas sunaikina. Taigi išryškėja reguliaraus ir ilgalaikio patalpų vėdinimo poreikis, net jei joje nėra žmonių: juk patekęs į patalpą ozonas joje ilgai neužsibūna - iš dalies suyra, o didžiąja dalimi nusėda. (adsorbuojasi) ant sienų ir kitų paviršių. Sunku pasakyti, kiek ozono turėtų būti patalpoje. Tačiau minimaliomis koncentracijomis ozonas tikriausiai yra būtinas ir naudingas.
Ilja Leensonas