الخصائص الفيزيائية للأوزون مميزة للغاية: إنه غاز أزرق ينفجر بسهولة. يزن لتر الأوزون حوالي 2 جرام ، بينما يزن الهواء 1.3 جرام. لذلك ، الأوزون أثقل من الهواء. درجة انصهار الأوزون هي 192.7 درجة مئوية. هذا الأوزون "المذاب" هو سائل أزرق غامق. الأوزون "آيس" له لون أزرق غامق مع صبغة بنفسجية ويصبح معتمًا عند سماكة تزيد عن 1 مم. درجة غليان الأوزون هي 112 درجة مئوية. في الحالة الغازية ، يكون الأوزون غير مغناطيسي ، أي لا يملك الخواص المغناطيسية، وفي الحالة السائلة يكون ضعيفًا مغناطيسيًا. تبلغ قابلية ذوبان الأوزون في الماء الذائب 15 مرة أكبر من ذوبان الأكسجين وحوالي 1.1 جم / لتر. يذيب لتر من حمض الأسيتيك 2.5 جرام من الأوزون في درجة حرارة الغرفة. كما أنه يذوب جيدًا في الزيوت الأساسية ، زيت التربنتين ، رابع كلوريد الكربون. تشعر برائحة الأوزون بتركيزات أعلى من 15 ميكروغرام / م 3 من الهواء. في الحد الأدنى من التركيزات ، يُنظر إليه على أنه "رائحة نضارة" ، وفي التركيزات الأعلى تكتسب مسحة مزعجة حادة.
يتكون الأوزون من الأكسجين وفقًا للصيغة التالية: 3O2 + 68 kcal → 2O3. أمثلة كلاسيكية لتكوين الأوزون: تحت تأثير البرق أثناء عاصفة رعدية ؛ تتعرض لأشعة الشمس في الغلاف الجوي العلوي. يمكن أيضًا تكوين الأوزون أثناء أي عمليات مصحوبة بإطلاق الأكسجين الذري ، على سبيل المثال ، أثناء تحلل بيروكسيد الهيدروجين. يرتبط التركيب الصناعي للأوزون باستخدام التفريغ الكهربائي في درجات حرارة منخفضة. قد تختلف تقنيات إنتاج الأوزون عن بعضها البعض. لذلك ، للحصول على الأوزون المستخدم للأغراض الطبية ، يتم استخدام الأكسجين الطبي النقي فقط (بدون شوائب). عادةً ما يكون فصل الأوزون المتكون عن شوائب الأكسجين أمرًا صعبًا بسبب الاختلافات في الخصائص الفيزيائية (يسيل الأوزون بسهولة أكبر). إذا لم تكن هناك حاجة إلى معلمات نوعية وكمية معينة للتفاعل ، فإن الحصول على الأوزون لا يمثل أي صعوبات معينة.
جزيء O3 غير مستقر ويتحول بسرعة إلى O2 مع إطلاق الحرارة. بتركيزات منخفضة وبدون شوائب غريبة ، يتحلل الأوزون ببطء ، بتركيزات عالية - مع حدوث انفجار. يشتعل الكحول على الفور عند ملامسته له. التسخين والتلامس مع الأوزون بكميات ضئيلة من ركيزة الأكسدة (المواد العضوية ، بعض المعادن أو أكاسيدها) يسرع بشكل حاد من تحللها. يمكن تخزين الأوزون لفترة طويلة عند -78 درجة مئوية في وجود عامل استقرار (كمية صغيرة من HNO3) ، وكذلك في أوعية مصنوعة من الزجاج أو بعض البلاستيك أو المعادن الثمينة.
الأوزون هو أقوى عامل مؤكسد. يكمن سبب هذه الظاهرة في حقيقة أنه في عملية الاضمحلال يتكون الأكسجين الذري. هذا الأكسجين أكثر عدوانية بكثير من الأكسجين الجزيئي ، لأنه في جزيء الأكسجين ، لا يمكن ملاحظة نقص الإلكترونات على المستوى الخارجي بسبب استخدامها الجماعي للمدار الجزيئي.
في القرن الثامن عشر ، لوحظ أن الزئبق في وجود الأوزون يفقد بريقه ويلتصق بالزجاج ؛ مؤكسد. وعندما يمر الأوزون عبر محلول مائي من يوديد البوتاسيوم ، يبدأ إطلاق اليود الغازي. نفس "الحيل" مع الأكسجين النقي لم تنجح. في وقت لاحق ، تم اكتشاف خصائص الأوزون ، والتي تم تبنيها على الفور من قبل البشرية: تبين أن الأوزون مادة عضوية مطهرة ممتازة ، وسرعان ما تمت إزالتها من الأوزون من أي أصل من الماء (العطور ومستحضرات التجميل ، والسوائل البيولوجية) ، وأصبحت تستخدم على نطاق واسع في الصناعة و الحياة اليومية ، وقد أثبتت نفسها كبديل لحفر الأسنان.
في القرن الحادي والعشرين ، يتزايد ويتطور استخدام الأوزون في جميع مجالات حياة الإنسان ونشاطه ، وبالتالي فإننا نشهد تحوله من أداة غريبة إلى أداة مألوفة للعمل اليومي. OZONE O3 ، شكل متآصل من الأكسجين.
استلام و الخصائص الفيزيائيةالأوزون.
أدرك العلماء لأول مرة وجود غاز غير معروف عندما بدأوا في تجربة الآلات الكهروستاتيكية. حدث ذلك في القرن السابع عشر. لكنهم بدأوا في دراسة الغاز الجديد فقط في نهاية القرن المقبل. في عام 1785 ، ابتكر الفيزيائي الهولندي مارتن فان ماروم الأوزون عن طريق تمرير شرارات كهربائية عبر الأكسجين. ظهر اسم الأوزون فقط في عام 1840 ؛ تم اختراعه من قبل الكيميائي السويسري كريستيان شونباين ، مستمدًا إياه من الأوزون اليوناني ، رائحته. لم يختلف التركيب الكيميائي لهذا الغاز عن الأكسجين ، ولكنه كان أكثر عدوانية. لذلك ، قام على الفور بأكسدة يوديد البوتاسيوم عديم اللون مع إطلاق اليود البني ؛ استخدم Shenbein هذا التفاعل لتحديد الأوزون من خلال درجة زرقة الورق المشبع بمحلول يوديد البوتاسيوم والنشا. حتى الزئبق والفضة ، غير النشطين في درجة حرارة الغرفة ، يتأكسدان في وجود الأوزون.
اتضح أن جزيئات الأوزون ، مثل الأكسجين ، تتكون فقط من ذرات الأكسجين ، ليس فقط من ذرتين ، ولكن من ثلاث. الأكسجين O2 والأوزون O3 - المثال الوحيد لتكوين غازين (في ظل الظروف العادية) بواسطة عنصر كيميائي واحد مواد بسيطة. في جزيء O3 ، توجد الذرات بزاوية ، لذلك تكون هذه الجزيئات قطبية. ينتج الأوزون نتيجة "الالتصاق" بجزيئات O2 من ذرات الأكسجين الحرة ، والتي تتكون من جزيئات الأكسجين تحت تأثير التفريغ الكهربائي والأشعة فوق البنفسجية وأشعة جاما والإلكترونات السريعة والجسيمات الأخرى عالية الطاقة. تنبعث رائحة الأوزون دائمًا بالقرب من الآلات الكهربائية العاملة ، حيث تتألق الفرشاة بالقرب من مصابيح الزئبق والكوارتز التي تنبعث منها الأشعة فوق البنفسجية. يتم إطلاق ذرات الأكسجين أيضًا أثناء بعض تفاعلات كيميائية. يتكون الأوزون بكميات صغيرة أثناء التحليل الكهربائي للماء المحمض ، وأثناء الأكسدة البطيئة للفوسفور الأبيض الرطب في الهواء ، وأثناء تحلل المركبات ذات المحتوى العالي من الأكسجين (KMnO4 ، K2Cr2O7 ، وما إلى ذلك) ، تحت تأثير الفلور على الماء أو على بيروكسيد الباريوم لحمض الكبريتيك المركز. توجد ذرات الأكسجين دائمًا في اللهب ، لذلك إذا وجهت الطائرة هواء مضغوطعبر لهب موقد الأكسجين ، سوف توجد رائحة الأوزون المميزة في الهواء.
يكون التفاعل 3O2 → 2O3 ماصًا للحرارة بدرجة عالية: يجب إنفاق 142 كيلو جول لإنتاج 1 مول من الأوزون. يستمر التفاعل العكسي مع إطلاق الطاقة ويتم تنفيذه بسهولة بالغة. تبعا لذلك ، الأوزون غير مستقر. في حالة عدم وجود شوائب ، يتحلل الأوزون الغازي ببطء عند درجة حرارة 70 درجة مئوية وبسرعة أعلى من 100 درجة مئوية.يزداد معدل تحلل الأوزون بشكل كبير في وجود المحفزات. يمكن أن تكون غازات (على سبيل المثال ، أكسيد النيتريك والكلور) والعديد من المواد الصلبة (حتى جدران الأوعية). لذلك يصعب الحصول على أوزون نقي ، والعمل معه خطر بسبب احتمالية حدوث انفجار.
ليس من المستغرب أنه لعقود عديدة بعد اكتشاف الأوزون ، حتى ثوابته الفيزيائية الأساسية كانت غير معروفة: لفترة طويلة لم يتمكن أحد من الحصول على أوزون نقي. كما كتب D.I Mendeleev في كتابه المدرسي أساسيات الكيمياء ، "بالنسبة لجميع طرق تحضير الأوزون الغازي ، فإن محتواه من الأكسجين يكون دائمًا ضئيلًا ، وعادة ما يكون فقط بضعة أعشار في المائة ، ونادرًا 2٪ ، وفقط في درجة حرارة منخفضةتصل إلى 20٪. فقط في عام 1880 ، حصل العالمان الفرنسيان J. Gotfeil و P. Chappui على الأوزون من الأكسجين النقي عند درجة حرارة أقل من 23 درجة مئوية. واتضح أن طبقة الأوزون السميكة لها لون أزرق جميل. عندما تم ضغط الأكسجين المعالج بالأوزون المبرد ببطء ، تحول الغاز إلى اللون الأزرق الداكن ، وبعد الإطلاق السريع للضغط ، انخفضت درجة الحرارة بشكل أكبر وتشكلت قطرات الأوزون السائل الأرجواني الداكن. إذا لم يتم تبريد الغاز أو ضغطه بسرعة ، فإن الأوزون على الفور ، مع وميض أصفر ، يتحول إلى أكسجين.
في وقت لاحق ، تم تطوير طريقة ملائمة لتخليق الأوزون. إذا تعرض محلول مركز من حمض البيركلوريك أو الفوسفوريك أو حمض الكبريتيك للتحليل الكهربائي باستخدام أنود مبرد مصنوع من البلاتين أو أكسيد الرصاص (IV) ، فإن الغاز المنطلق عند الأنود سيحتوي على نسبة تصل إلى 50٪ من الأوزون. كما تم تنقيح الثوابت الفيزيائية للأوزون. يسيل أخف بكثير من الأكسجين - عند درجة حرارة -112 درجة مئوية (أكسجين - عند -183 درجة مئوية). عند -192.7 درجة مئوية ، يتصلب الأوزون. الأوزون الصلب لونه أزرق-أسود.
التجارب مع الأوزون خطيرة. الأوزون الغازي قادر على الانفجار إذا تجاوز تركيزه في الهواء 9٪. ينفجر الأوزون السائل والصلب بسهولة أكبر ، خاصة عند ملامسته للمواد المؤكسدة. يمكن تخزين الأوزون في درجات حرارة منخفضة في شكل محاليل في الهيدروكربونات المفلورة (الفريونات). هذه الحلول زرقاء اللون.
الخصائص الكيميائية للأوزون.
يتميز الأوزون بفاعلية عالية للغاية. الأوزون هو أحد أقوى العوامل المؤكسدة وهو أقل شأنا في هذا الصدد من الفلور وفلوريد الأكسجين OF2. المبدأ النشط للأوزون كعامل مؤكسد هو الأكسجين الذري ، والذي يتكون أثناء تحلل جزيء الأوزون. لذلك ، يعمل جزيء الأوزون كعامل مؤكسد ، كقاعدة عامة ، "يستخدم" ذرة أكسجين واحدة فقط ، بينما يتم إطلاق الاثنين الآخرين في شكل أكسجين حر ، على سبيل المثال ، 2KI + O3 + H2O → I2 + 2KOH + O2. تتأكسد العديد من المركبات الأخرى بنفس الطريقة. ومع ذلك ، هناك استثناءات عندما يستخدم جزيء الأوزون جميع ذرات الأكسجين الثلاثة التي يحتوي عليها للأكسدة ، على سبيل المثال ، 3SO2 + O3 → 3SO3 ؛ Na2S + O3 → Na2SO3.
الفرق المهم للغاية بين الأوزون والأكسجين هو أن الأوزون يعرض خصائص مؤكسدةبالفعل في درجة حرارة الغرفة. على سبيل المثال ، لا يتفاعل PbS و Pb (OH) 2 مع الأكسجين في ظل الظروف العادية ، بينما في وجود الأوزون ، يتم تحويل الكبريتيد إلى PbSO4 ، والهيدروكسيد إلى PbO2. إذا تم سكب محلول مركز من الأمونيا في وعاء به الأوزون ، فسيظهر دخان أبيض - هذا الأوزون قد أدى إلى أكسدة الأمونيا لتكوين نتريت الأمونيوم NH4NO2. السمة المميزة للأوزون هي القدرة على "اسوداد" العناصر الفضية بتكوين AgO و Ag2O3.
من خلال ربط إلكترون واحد وتحويله إلى أيون سالب O3- ، يصبح جزيء الأوزون أكثر استقرارًا. تُعرف "أملاح الأوزون" أو الأوزون التي تحتوي على مثل هذه الأنيونات لفترة طويلة - تتكون من جميع المعادن القلوية باستثناء الليثيوم ، ويزيد استقرار الأوزون من الصوديوم إلى السيزيوم. بعض الأوزونيدات من الفلزات القلوية الأرضية معروفة أيضًا ، على سبيل المثال Ca (O3) 2. إذا تم توجيه تيار من الأوزون الغازي إلى سطح قلوي جاف صلب ، تتشكل قشرة برتقالية حمراء تحتوي على أوزونيدات ، على سبيل المثال ، 4KOH + 4O3 → 4KO3 + O2 + 2H2O. في الوقت نفسه ، تعمل القلويات الصلبة على ربط الماء بشكل فعال ، مما يمنع الأوزون من التحلل المائي الفوري. ومع ذلك ، مع وجود فائض من الماء ، تتحلل الأوزون بسرعة: 4KO3 + 2H2O → 4KOH + 5O2. يحدث التحلل أيضًا أثناء التخزين: 2KO3 → 2KO2 + O2. الأوزون شديد الذوبان في الأمونيا السائلة ، مما جعل من الممكن عزلها في شكلها النقي ودراسة خصائصها.
المواد العضوية التي يتلامس معها الأوزون ، عادة ما تدمر. لذلك ، فإن الأوزون ، على عكس الكلور ، قادر على تقسيم حلقة البنزين. عند العمل مع الأوزون ، لا يمكنك استخدام الأنابيب والخراطيم المطاطية - سوف "تتسرب" على الفور. يتفاعل الأوزون مع المركبات العضوية بإطلاق كمية كبيرة من الطاقة. على سبيل المثال ، يشتعل الأثير والكحول والصوف القطني المبلل بزيت التربنتين والميثان والعديد من المواد الأخرى تلقائيًا عند ملامسته للهواء المعالج بالأوزون ، ويؤدي خلط الأوزون مع الإيثيلين إلى انفجار قوي.
استخدام الأوزون.
الأوزون لا "يحرق" المواد العضوية دائمًا ؛ في عدد من الحالات ، من الممكن إجراء تفاعلات محددة مع الأوزون المخفف للغاية. على سبيل المثال ، عند استخدام حمض الأوليك بالأوزون (يوجد بكميات كبيرة في الزيوت النباتية) يتم تشكيل حمض الأزيليك (HOOC (CH2) 7COOH ، والذي يستخدم لإنتاج زيوت تشحيم عالية الجودة وألياف تركيبية ومواد ملدنة للبلاستيك. وبالمثل ، يتم الحصول على حمض الأديبيك ، والذي يستخدم في تصنيع النايلون. في عام 1855 ، اكتشف شونباين تفاعل المركبات غير المشبعة التي تحتوي على روابط C = C المزدوجة مع الأوزون ، ولكن لم يؤسس الكيميائي الألماني H. Staudinger حتى عام 1925 آلية هذا التفاعل. ينضم جزيء الأوزون إلى الرابطة المزدوجة بتكوين الأوزون - هذه المرة عضوي ، وتحل ذرة الأكسجين محل إحدى روابط C \ u003d C ، وتحل مجموعة -O-O- مكان الأخرى. على الرغم من عزل بعض الأوزون العضوي في صورة نقية (على سبيل المثال ، أوزونيد الإيثيلين) ، يتم إجراء هذا التفاعل عادةً في محلول مخفف ، نظرًا لأن الأوزون غير مستقر للغاية في الحالة الحرة. المتفجرات. يحظى تفاعل الأوزون للمركبات غير المشبعة باحترام كبير بين الكيميائيين العضويين ؛ غالبًا ما يتم تقديم المهام مع رد الفعل هذا حتى على الأولمبياد المدرسة. الحقيقة هي أنه عندما يتحلل الأوزونيد بالماء ، يتم تكوين جزيئين من الألدهيد أو الكيتون ، مما يسهل التعرف عليه وإثبات بنية المركب الأصلي غير المشبع. وهكذا ، في بداية القرن العشرين ، أنشأ الكيميائيون بنية العديد من المركبات العضوية المهمة ، بما في ذلك المركبات الطبيعية ، التي تحتوي على روابط C = C.
أحد المجالات المهمة لتطبيق الأوزون هو تطهير مياه الشرب. عادة الماء مكلور. ومع ذلك ، يتم تحويل بعض الشوائب الموجودة في الماء تحت تأثير الكلور إلى مركبات ذات رائحة كريهة للغاية. لذلك ، تم اقتراح استبدال الكلور بالأوزون منذ فترة طويلة. لا يكتسب الماء المعالج بالأوزون رائحة أو طعمًا غريبًا ؛ عندما تتأكسد العديد من المركبات العضوية تمامًا بالأوزون ، يتشكل ثاني أكسيد الكربون والماء فقط. تنقية مع الأوزون و مياه الصرف الصحي. تعتبر منتجات أكسدة الأوزون حتى من الملوثات مثل الفينولات والسيانيدات والمواد الخافضة للتوتر السطحي والكبريتيت والكلورامين مركبات غير ضارة بدون لون ورائحة. الأوزون الزائد يتحلل بسرعة مع تكوين الأكسجين. ومع ذلك ، فإن المعالجة بالأوزون في الماء أغلى من المعالجة بالكلور ؛ بالإضافة إلى ذلك ، لا يمكن نقل الأوزون ويجب إنتاجه في الموقع.
الأوزون في الغلاف الجوي.
لا يوجد الكثير من الأوزون في الغلاف الجوي للأرض - 4 مليارات طن ، أي في المتوسط 1 مجم / م 3 فقط. يزداد تركيز الأوزون مع المسافة من سطح الأرض ويصل إلى الحد الأقصى في الستراتوسفير ، على ارتفاع 20-25 كم - هذه هي "طبقة الأوزون". إذا تم جمع كل الأوزون من الغلاف الجوي بالقرب من سطح الأرض عند الضغط الطبيعي ، فسيتم الحصول على طبقة بسماكة حوالي 2-3 مم فقط. وهذه الكميات الصغيرة من الأوزون في الهواء توفر الحياة على الأرض. يقوم الأوزون بإنشاء "شاشة واقية" لا تسمح لأشعة الشمس فوق البنفسجية القاسية بالوصول إلى سطح الأرض ، والتي تضر بكل الكائنات الحية.
في العقود الأخيرة ، تم إيلاء الكثير من الاهتمام لظهور ما يسمى ب "ثقوب الأوزون" - وهي مناطق ذات محتوى منخفض بشكل كبير من أوزون الستراتوسفير. من خلال مثل هذا الدرع "المتسرب" ، تصل الأشعة فوق البنفسجية الأشد قسوة إلى سطح الأرض. لذلك ، كان العلماء يراقبون الأوزون في الغلاف الجوي لفترة طويلة. في عام 1930 ، اقترح عالم الجيوفيزياء الإنجليزي S. Chapman مخططًا من أربعة تفاعلات لشرح التركيز الثابت للأوزون في الستراتوسفير (تسمى هذه التفاعلات دورة تشابمان ، حيث تعني M أي ذرة أو جزيء يحمل الطاقة الزائدة):
O + O + M → O2 + M.
O + O3 → 2O2
O3 → O2 + O.
تكون التفاعلات الأولى والرابعة من هذه الدورة كيميائية ضوئية ، وهي تحت تأثير الإشعاع الشمسي. لتحلل جزيء الأكسجين إلى ذرات ، يلزم إشعاع بطول موجي أقل من 242 نانومتر ، بينما يتحلل الأوزون عند امتصاص الضوء في منطقة 240-320 نانومتر (التفاعل الأخير يحمينا فقط من الأشعة فوق البنفسجية الصلبة ، لأن الأكسجين لا تمتص في هذه المنطقة الطيفية). التفاعلان المتبقيان حراريان ، أي اذهب دون عمل الضوء. من المهم جدًا أن يكون للتفاعل الثالث الذي يؤدي إلى اختفاء الأوزون طاقة تنشيط ؛ هذا يعني أنه يمكن زيادة معدل مثل هذا التفاعل بفعل المحفزات. كما اتضح ، فإن المحفز الرئيسي لانحلال الأوزون هو أكسيد النيتريك NO. يتكون في الغلاف الجوي العلوي من النيتروجين والأكسجين تحت تأثير أشد أشعة الشمس. بمجرد دخوله إلى طبقة الأوزون ، فإنه يدخل في دورة من تفاعلين O3 + NO → NO2 + O2 ، NO2 + O → NO + O2 ، ونتيجة لذلك لا يتغير محتواه في الغلاف الجوي ، وينخفض تركيز الأوزون الثابت. هناك دورات أخرى تؤدي إلى انخفاض محتوى الأوزون في الستراتوسفير ، على سبيل المثال بمشاركة الكلور:
Cl + O3 → ClO + O2
ClO + O → Cl + O2.
الأوزون يتم تدميره أيضًا بواسطة الغبار والغازات التي في بأعداد كبيرةأطلق في الغلاف الجوي أثناء الانفجارات البركانية. في في الآونة الأخيرةتم اقتراح أن الأوزون فعال أيضًا في تدمير الهيدروجين المنطلق منه قشرة الأرض. تؤدي مجمل جميع تفاعلات تكوين وتحلل الأوزون إلى حقيقة أن متوسط عمر جزيء الأوزون في الستراتوسفير يبلغ حوالي ثلاث ساعات.
من المفترض أنه بالإضافة إلى العوامل الطبيعية ، هناك أيضًا عوامل اصطناعية تؤثر على طبقة الأوزون. ومن الأمثلة المعروفة الفريونات ، وهي مصادر لذرات الكلور. الفريونات عبارة عن هيدروكربونات يتم فيها استبدال ذرات الهيدروجين بذرات الفلور والكلور. يتم استخدامها في التبريد ولملء علب الهباء الجوي. في النهاية ، تدخل الفريونات في الهواء وترتفع ببطء أعلى وأعلى مع التيارات الهوائية ، لتصل أخيرًا إلى طبقة الأوزون. تتحلل تحت تأثير الإشعاع الشمسي ، وتبدأ الفريونات نفسها في تحلل الأوزون بشكل تحفيزي. لم يُعرف بعد بالضبط إلى أي مدى يقع اللوم على الفريونات في "ثقوب الأوزون" ، ومع ذلك ، فقد تم اتخاذ تدابير منذ فترة طويلة للحد من استخدامها.
تظهر الحسابات أنه في 60-70 سنة يمكن أن ينخفض تركيز الأوزون في الستراتوسفير بنسبة 25٪. وفي الوقت نفسه ، سيزداد تركيز الأوزون في الطبقة السطحية - التروبوسفير ، وهو أمر سيئ أيضًا ، لأن الأوزون ونواتج تحولاته في الهواء سامة. المصدر الرئيسي للأوزون في طبقة التروبوسفير هو انتقال أوزون الستراتوسفير بالكتل الهوائية إلى الطبقات السفلى. يدخل حوالي 1.6 مليار طن إلى طبقة الأوزون الأرضية سنويًا. عمر جزيء الأوزون في الجزء السفلي من الغلاف الجوي أطول بكثير - أكثر من 100 يوم ، حيث يوجد في الطبقة السطحية كثافة أقل من الأشعة فوق البنفسجية الشمسية التي تدمر الأوزون. عادة ، يوجد القليل جدًا من الأوزون في طبقة التروبوسفير: في الهواء النقي النقي ، يبلغ متوسط تركيزه 0.016 ميكروغرام / لتر فقط. لا يعتمد تركيز الأوزون في الهواء على الارتفاع فحسب ، بل يعتمد أيضًا على التضاريس. وبالتالي ، يوجد دائمًا قدر أكبر من الأوزون فوق المحيطات منه فوق اليابسة ، نظرًا لأن الأوزون يتحلل بشكل أبطأ هناك. أظهرت القياسات في سوتشي أن الهواء في ساحل البحريحتوي على أوزون 20٪ أكثر مما هو عليه في غابة على بعد 2 كم من الساحل.
يتنفس البشر المعاصرون كمية من الأوزون أكثر بكثير من أسلافهم. والسبب الرئيسي لذلك هو زيادة كمية الميثان وأكاسيد النيتروجين في الهواء. وهكذا ، فإن محتوى الميثان في الغلاف الجوي يتزايد باستمرار منذ منتصف القرن التاسع عشر ، عندما بدأ استخدام الغاز الطبيعي. في جو ملوث بأكاسيد النيتروجين ، يدخل الميثان في سلسلة معقدة من التحولات التي تتضمن الأكسجين وبخار الماء ، ويمكن التعبير عن نتيجة ذلك بالمعادلة CH4 + 4O2 → HCHO + H2O + 2O3. يمكن أن تعمل الهيدروكربونات الأخرى أيضًا كميثان ، على سبيل المثال ، تلك الموجودة في غازات عادم السيارات أثناء احتراق غير كاملالغازولين. نتيجة لذلك ، في هواء المدن الكبيرة على مدى العقود الماضية ، زاد تركيز الأوزون عشرة أضعاف.
كان من المعتقد دائمًا أنه خلال العاصفة الرعدية ، يزداد تركيز الأوزون في الهواء بشكل كبير ، حيث يساهم البرق في تحويل الأكسجين إلى أوزون. في الواقع ، الزيادة طفيفة ، ولا تحدث أثناء عاصفة رعدية ، بل قبل عدة ساعات من حدوثها. خلال العاصفة الرعدية ولعدة ساعات بعد ذلك ، ينخفض تركيز الأوزون. يفسر ذلك حقيقة أن الاختلاط الرأسي القوي يحدث قبل عاصفة رعدية. الكتل الهوائية، بحيث يأتي الأوزون الإضافي من الطبقات العليا. بالإضافة إلى ذلك ، قبل حدوث عاصفة رعدية ، تزداد شدة المجال الكهربائي ، ويتم تهيئة الظروف لتكوين تفريغ إكليلي عند نقاط أجسام مختلفة ، على سبيل المثال ، أطراف الفروع. كما أنه يساهم في تكوين الأوزون. ثم مع التطور سحابة الرعدتنشأ تحته تيارات هوائية قوية تصاعدية ، مما يقلل من محتوى الأوزون مباشرة تحت السحابة.
سؤال مثير للاهتمام حول محتوى الأوزون في الهواء الغابات الصنوبرية. على سبيل المثال ، في الدورة التدريبية الكيمياء غير العضويةيمكن قراءة جي ريمي أن "الهواء المعالج بالأوزون للغابات الصنوبرية" هو خيال. هو كذلك؟ لا يوجد نبات ينبعث منه الأوزون ، بالطبع. لكن النباتات ، وخاصة الصنوبريات ، تنبعث منها الكثير من المركبات العضوية المتطايرة في الهواء ، بما في ذلك الهيدروكربونات غير المشبعة من فئة التربين (يوجد الكثير منها في زيت التربنتين). لذلك ، في يوم حار ، تطلق شجرة الصنوبر 16 ميكروغرامًا من التربينات في الساعة لكل جرام من الوزن الجاف للإبر. تتميز Terpenes ليس فقط بالصنوبريات ، ولكن أيضًا ببعض الأشجار المتساقطة ، من بينها الحور والأوكالبتوس. وبعض الأشجار الاستوائية قادرة على إطلاق 45 ميكروغرامًا من التربينات لكل 1 جرام من كتلة الأوراق الجافة في الساعة. نتيجة لذلك ، يمكن أن يطلق هكتار واحد من الغابات الصنوبرية ما يصل إلى 4 كجم من المواد العضوية يوميًا ، وحوالي 2 كجم من الغابات المتساقطة الأوراق. تبلغ مساحة الغابات على الأرض ملايين الهكتارات ، وكلها تطلق مئات الآلاف من الأطنان من الهيدروكربونات المختلفة ، بما في ذلك التربينات ، سنويًا. والهيدروكربونات كما ظهر في مثال الميثان تحت تأثير الإشعاع الشمسي وفي وجود شوائب أخرى تساهم في تكوين الأوزون. أظهرت التجارب أنه في ظل الظروف المناسبة ، تشارك التربينات بنشاط كبير في دورة التفاعلات الكيميائية الضوئية في الغلاف الجوي مع تكوين الأوزون. لذا فإن الأوزون في الغابة الصنوبرية ليس اختراعًا على الإطلاق ، ولكنه حقيقة تجريبية.
الأوزون والصحة.
يا لها من متعة أن تمشي بعد عاصفة رعدية! الهواء نظيف ومنعش ، ويبدو أن نفثاته المنعشة تتدفق إلى الرئتين دون أي جهد. "إنها تشبه رائحة الأوزون" ، كما يقولون غالبًا في مثل هذه الحالات. "جيد جدًا للصحة." هو كذلك؟
ذات مرة ، كان الأوزون يعتبر بالتأكيد مفيدًا للصحة. ولكن إذا تجاوز تركيزه حدًا معينًا ، فقد يتسبب في الكثير من العواقب غير السارة. اعتمادًا على تركيز ووقت الاستنشاق ، يتسبب الأوزون في حدوث تغيرات في الرئتين ، وتهيج الأغشية المخاطية للعينين والأنف ، والصداع ، والدوخة ، وانخفاض ضغط الدم. الأوزون يقلل من مقاومة الجسم للالتهابات البكتيرية في الجهاز التنفسي. تركيزه الأقصى المسموح به في الهواء هو 0.1 ميكروغرام / لتر فقط ، مما يعني أن الأوزون أخطر بكثير من الكلور! إذا كنت تقضي عدة ساعات في الداخل مع تركيز الأوزون البالغ 0.4 ميكروغرام / لتر فقط ، فقد تظهر آلام في الصدر ، وسعال ، وأرق ، وتقل حدة البصر. إذا استنشقت الأوزون لفترة طويلة بتركيز يزيد عن 2 ميكروغرام / لتر ، فقد تكون العواقب أكثر خطورة - تصل إلى الذهول وانخفاض نشاط القلب. مع محتوى الأوزون من 8-9 ميكروغرام / لتر ، تحدث الوذمة الرئوية بعد بضع ساعات ، وهو أمر محفوف مميت. لكن عادة ما يصعب تحليل مثل هذه الكميات الضئيلة من مادة بالطرق الكيميائية التقليدية. لحسن الحظ ، يشعر الشخص بوجود الأوزون بالفعل بتركيزات منخفضة جدًا - حوالي 1 ميكروغرام / لتر ، حيث لن يتحول ورق اليود النشوي إلى اللون الأزرق. بالنسبة لبعض الناس ، فإن رائحة الأوزون بتركيزات صغيرة تشبه رائحة الكلور ، بالنسبة للآخرين - لثاني أكسيد الكبريت ، ولآخرين - رائحة الثوم.
ليس الأوزون نفسه سامًا فقط. مع مشاركته في الهواء ، على سبيل المثال ، يتم تكوين نترات البيروكسي أسيتيل (PAN) CH3-CO-OONO2 - مادة لها تأثير قوي ، بما في ذلك المسيل للدموع ، مما يجعل التنفس صعبًا ، وفي التركيزات العالية تسبب شلل القلب. PAN هو أحد مكونات ما يسمى بالضباب الكيميائي الضوئي الذي يتكون في الصيف في هواء ملوث (هذه الكلمة مشتقة من الدخان الإنجليزي - الدخان والضباب - الضباب). يمكن أن يصل تركيز الأوزون في الضباب الدخاني إلى 2 ميكروغرام / لتر ، وهو ما يزيد 20 مرة عن الحد الأقصى المسموح به. يجب أيضًا مراعاة أن التأثير المشترك لأكاسيد الأوزون والنيتروجين في الهواء أقوى بعشر مرات من كل مادة على حدة. ليس من المستغرب أن عواقب مثل هذا الضباب الدخاني في المدن الكبرىيمكن أن تكون كارثية ، خاصة إذا لم يكن الهواء فوق المدينة منفوخًا بواسطة "المسودات" وتشكلت منطقة راكدة. لذلك ، في لندن عام 1952 ، مات أكثر من 4000 شخص بسبب الضباب الدخاني في غضون أيام قليلة. تسبب الضباب الدخاني في نيويورك عام 1963 في مقتل 350 شخصًا. كانت قصص مماثلة في طوكيو ، وقصص أخرى مدن أساسيه. ليس فقط الناس يعانون من الأوزون الجوي. أظهر الباحثون الأمريكيون ، على سبيل المثال ، أنه في المناطق التي تحتوي على نسبة عالية من الأوزون في الهواء ، يتم تقليل عمر خدمة إطارات السيارات ومنتجات المطاط الأخرى بشكل كبير.
كيف تقلل من محتوى الأوزون في طبقة الأرض؟ إن تقليل انبعاثات الميثان في الغلاف الجوي ليس بالأمر الواقعي. لا تزال هناك طريقة أخرى - لتقليل انبعاثات أكاسيد النيتروجين ، والتي بدونها لا يمكن لدورة التفاعلات المؤدية إلى الأوزون أن تستمر. هذا المسار ليس سهلاً أيضًا ، لأن أكاسيد النيتروجين لا تنبعث فقط من السيارات ، ولكن أيضًا (بشكل أساسي) عن طريق محطات الطاقة الحرارية.
مصادر الأوزون ليست فقط في الشارع. يتم تشكيلها في غرف الأشعة السينية ، في غرف العلاج الطبيعي (مصدرها مصابيح الزئبق الكوارتز) ، أثناء تشغيل آلات التصوير (آلات التصوير) ، طابعات الليزر (هنا سبب تكوينها هو تفريغ عالي الجهد). الأوزون هو رفيق لا مفر منه لإنتاج perhydrol ، الأرجون قوس اللحام. لتقليل الآثار الضارة للأوزون ، من الضروري تجهيز غطاء المحرك بمصابيح الأشعة فوق البنفسجية ، والتهوية الجيدة للغرفة.
ومع ذلك ، فمن غير الصحيح اعتبار الأوزون ، بالطبع ، ضارًا بالصحة. كل هذا يتوقف على تركيزه. أظهرت الدراسات أن الهواء النقي يضيء بشكل ضعيف جدًا في الظلام. سبب التوهج هو تفاعل أكسدة يشمل الأوزون. لوحظ الوهج أيضًا عندما تم اهتزاز الماء في دورق ، حيث تم ملء الأكسجين المعالج بالأوزون بشكل أولي. يرتبط هذا التوهج دائمًا بوجود كميات صغيرة من الشوائب العضوية في الهواء أو الماء. عند مزج الهواء النقي مع الزفير ، زادت شدة التوهج عشرة أضعاف! وهذا ليس مفاجئًا: تم العثور على شوائب دقيقة من الإيثيلين والبنزين والأسيتالديهيد والفورمالديهايد والأسيتون وحمض الفورميك في هواء الزفير. يتم "تسليط الضوء عليها" بواسطة الأوزون. في نفس الوقت ، "قديم" ، أي خالية تمامًا من الأوزون ، على الرغم من أنها نظيفة جدًا ، إلا أن الهواء لا يسبب وهجًا ، ويشعر الشخص بأنه "قديم". يمكن مقارنة هذا الهواء بالماء المقطر: فهو نقي جدًا ، ولا يحتوي عمليًا على شوائب ، وشربه ضار. لذا فإن الغياب التام للأوزون في الهواء ، على ما يبدو ، هو أيضًا غير موات للبشر ، لأنه يزيد من محتوى الكائنات الحية الدقيقة فيه ، ويؤدي إلى تراكم المواد الضارة والروائح الكريهة التي تدمر الأوزون. وبالتالي ، تتضح الحاجة إلى تهوية منتظمة وطويلة المدى للمباني ، حتى لو لم يكن هناك أشخاص فيها: بعد كل شيء ، فإن الأوزون الذي دخل الغرفة لا يبقى فيه لفترة طويلة - إنه يتحلل جزئيًا ، ويستقر إلى حد كبير (يمتص) على الجدران والأسطح الأخرى. من الصعب تحديد كمية الأوزون في الغرفة. ومع ذلك ، في الحد الأدنى من التركيزات ، قد يكون الأوزون ضروريًا ومفيدًا.
وبالتالي ، فإن الأوزون هو قنبلة موقوتة. إذا تم استخدامه بشكل صحيح ، فسيخدم البشرية ، ولكن بمجرد استخدامه لأغراض أخرى ، فإنه سيؤدي على الفور إلى كارثة عالميةوستتحول الأرض إلى كوكب مثل المريخ.
عندما تمر شرارات كهربائية عبر الأكسجين أو الهواء ، تظهر رائحة مميزة ، والسبب في ذلك هو تكوين مادة جديدة - الأوزون. يمكن الحصول على الأوزون من الأكسجين الجاف النقي تمامًا ؛ ومن ثم فإنه يترتب على ذلك أنه يتكون فقط من الأكسجين ويمثل تعديله المتآصل.
الكتلة الجزيئية للأوزون هي 48. الكتلة الذرية للأكسجين هي 16 ؛ لذلك ، يتكون جزيء الأوزون من ثلاث ذرات أكسجين.
للحصول على الأوزون ، يتم استخدام تأثير التصريفات الكهربائية الهادئة على الأكسجين. تسمى الأجهزة التي تخدم هذا الغرض بالأوزون.
أرز. 110- مخطط بنية جزيء الأوزون.

أرز. 111- مخطط مدارات ذرة الأكسجين المركزية في جزيء الأوزون.
في ظل الظروف العادية ، يعتبر الأوزون غازًا. يمكن فصله عن الأكسجين عن طريق التبريد القوي ؛ يتكثف الأوزون في سائل أزرق يغلي عند.
إن قابلية ذوبان الأوزون في الماء أكبر بكثير من ذوبان الأكسجين: 100 حجم من الماء يذيب 49 حجمًا من الأوزون.
يمكن التعبير عن تكوين الأوزون من الأكسجين بالمعادلة
الذي يتبع منه أن المحتوى الحراري القياسي لتكوين الأوزون موجب ومتساوٍ. بالإضافة إلى ذلك ، كما تظهر معاملات المعادلة ، في سياق هذا التفاعل ، يتم الحصول على جزيئين من ثلاثة جزيئات غازية ، أي تقل انتروبيا النظام. نتيجة لذلك ، فإن التغيير القياسي في طاقة جيبس في التفاعل قيد الدراسة إيجابي أيضًا (163). وبالتالي ، فإن تفاعل تحويل الأكسجين إلى أوزون لا يمكن أن يستمر تلقائيًا: الطاقة مطلوبة لتنفيذه. التفاعل العكسي - اضمحلال الأوزون - يستمر تلقائيًا ، حيث تقل طاقة جيبس خلال هذه العملية. بمعنى آخر ، الأوزون مادة غير مستقرة.
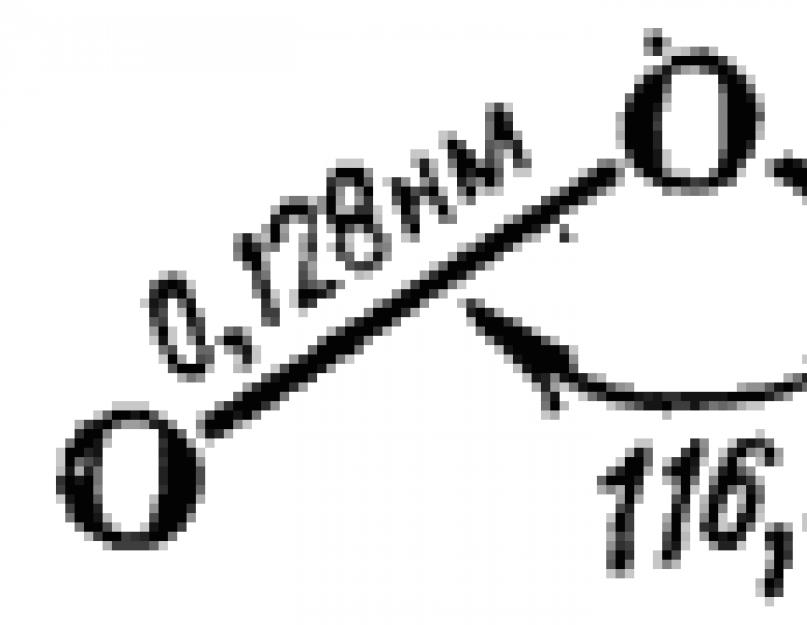
يتكون جزيء الأوزون على شكل مثلث متساوي الساقين. يظهر هيكلها بشكل تخطيطي في الشكل. 110. يشير قرب الزاوية عند قمة المثلث إلى 120 درجة إلى أن ذرة الأكسجين المركزية هنا في حالة تهجين. وفقًا لهذا ، من وجهة نظر طريقة النظام المنسق ، يمكن وصف تكوين الجزيء على النحو التالي.
يتداخل الهجين-المداري للذرة المركزية ، الذي يحتوي على إلكترون واحد (الشكل 111 ، على اليسار) ، مع -orbital إحدى ذرات الأكسجين المتطرفة ، مما يؤدي إلى تكوين a -bond. يتم توجيه -orbital للذرة المركزية ، التي لا تشارك في التهجين ، بشكل عمودي على مستوى الجزيء ويحتوي أيضًا على إلكترون غير مزدوج ، يتداخل مع نفس الموقع-المداري لنفس ذرة الأكسجين المتطرفة ، مما يؤدي إلى التكوين من عقد. أخيرًا ، العمل كمتبرع لزوج إلكترون يشغل واحدًا من الهجين-أوربيتال(الشكل 111 ، على اليمين) ، تتشكل ذرة الأكسجين المركزية ، وفقًا لطريقة متلقي المتبرع ، وهي رابطة مع ذرة الأكسجين المتطرفة الأخرى.
يتوافق الهيكل الناتج مع مخطط التكافؤ A ، حيث تشير النقاط إلى أزواج وحيدة من الإلكترونات ، و- و -bonds يتم تمييزها بالأحرف.

وفقًا للمخطط A ، فإن روابط ذرة الأكسجين المركزية مع الذرتين المتطرفتين ليست متكافئة - إحداهما مزدوجة والأخرى بسيطة. ومع ذلك ، فإن نفس طول هذه الروابط (الشكل 110) يشير إلى تكافؤهم. لذلك ، جنبًا إلى جنب مع المخطط A ، يمكن وصف بنية جزيء الأوزون بنفس السبب من خلال المخطط B. من وجهة نظر طريقة تراكب مخططات التكافؤ (انظر الفقرة 44) ، وهذا يعني أنه في الواقع بنية جزيء الأوزون جزيء الأوزون هو وسيط بين المخططين A و B ويمكن تمثيله في شكل:
هنا ، تشير الخطوط المنقطة إلى عدم تمركز زوج الإلكترون ، أي الانتماء إلى جميع ذرات الأكسجين الثلاثة. لذلك ، فإن -Bond في جزيء الأوزون هو ثلاثة مراكز.
يؤدي النظر في بنية جزيء الأوزون من وجهة نظر طريقة MO أيضًا إلى استنتاج مفاده أن المدار الجزيئي الترابط ثلاثي المراكز يتكون هنا.
الأوزون هو أحد أقوى العوامل المؤكسدة. يؤكسد جميع المعادن باستثناء الذهب والبلاتين ، وكذلك معظم المعادن غير المعدنية. إنه يحول الأكاسيد السفلية إلى أكاسيد أعلى ، وكبريتيدات المعادن إلى كبريتاتهم. خلال معظم هذه التفاعلات ، يفقد جزيء الأوزون ذرة أكسجين واحدة ويتحول إلى جزيء.
من محلول يوديد البوتاسيوم ، يطلق الأوزون اليود:
إذا تم وضع قطعة من الورق مبللة بمحلول KI والنشا في الهواء المحتوي على الأوزون ، فإنها تتحول على الفور إلى اللون الأزرق. يستخدم هذا التفاعل لاكتشاف الأوزون.
كعامل مؤكسد قوي ، الأوزون يقتل البكتيريا وبالتالي يستخدم لتطهير المياه وتطهير الهواء.
الأوزون سام. الحد الأقصى المسموح به هو محتواه في الهواء يساوي. في هذا التركيز ، رائحته محسوسة. في الطبقة السطحية للغلاف الجوي ، يقع محتوى الأوزون عادةً ضمن الحدود التي يتشكل فيها أثناء التفريغ الكهربائي.
1. ماذا نعرف عن OZONE؟
الأوزون (من رائحة الأوزون اليونانية) هو غاز أزرق ذو رائحة نفاذة ، وهو عامل مؤكسد قوي. الأوزون هو تآصل من الأكسجين. الصيغة الجزيئية لـ O3. إنه أثقل 2.5 مرة من الأكسجين. يتم استخدامه لتطهير الماء والغذاء والهواء.
تكنولوجيا
استنادًا إلى تقنية الأوزون التاجي ، تم تطوير جهاز أوزون أنيون متعدد الوظائف من Green World ، والذي يستخدم الأوزون للتطهير والتعقيم.
خصائص الأوزون العنصر الكيميائي
الأوزون الاسم العلميالتي O3 ، يتم الحصول عليها في عملية الجمع بين ثلاث ذرات أكسجين ، ولها وظائف مؤكسدة عالية ، وهي فعالة في التطهير والتطهير. إنه قادر على تدمير معظم البكتيريا في الماء والهواء. يعتبر مطهرًا ومطهرًا فعالًا. الأوزون هو عنصر مهم في الغلاف الجوي. يحتوي غلافنا الجوي على 0.01 جزء في المليون - 0.04 جزء في المليون من الأوزون ، مما يوازن مستويات البكتيريا في الطبيعة. ينتج الأوزون بشكل طبيعي أيضًا عن طريق تصريفات البرق أثناء العواصف الرعدية. أثناء التفريغ الكهربائي للبرق ، تنبعث رائحة حلوة لطيفة نسميها الهواء النقي.
جزيئات الأوزون غير مستقرة وتتحلل بسرعة كبيرة إلى جزيئات الأكسجين. هذه الجودة تجعل الأوزون قيمة لتنقية الغاز والمياه. تتحد جزيئات الأوزون مع جزيئات المواد الأخرى وتتحلل ، ونتيجة لذلك فإنها تؤكسد المركبات العضوية وتحولها إلى ثاني أكسيد الكربون والماء. نظرًا لأن الأوزون يتحلل بسهولة إلى جزيئات الأكسجين ، فهو أقل سمية بشكل ملحوظ من المطهرات الأخرى مثل الكلور. ويسمى أيضًا "أنقى مادة مؤكسدة ومطهر".
خصائص الأوزون - تقتل الكائنات الحية الدقيقة
1. يقتل البكتيريا
أ) يقتل معظم بكتيريا القولونية والمكورات العنقودية في الهواء
ب) يقتل 99.7٪ من بكتيريا القولونية و 99.9٪ من المكورات العنقودية على سطح الأشياء
ج) يقتل 100٪ من ميكروبات بكتيريا القولونية والمكورات العنقودية والسالمونيلا في مركبات الفوسفات
د) يقتل 100٪ من بكتيريا القولون في الماء
2. يدمر جراثيم البكتيريا
أ) يدمر جراثيم قصيرة
ب) القدرة على تدمير البكتيريا الموجودة في الهواء
ج) يقتل 99.999٪ من الجراثيم في الماء
3. يقضي على الفيروسات
أ) يدمر 99.99٪ HBsAg و 100٪ HAg
ب) يقضي على فيروس الانفلونزا في الهواء
ج) يدمر فيروس PVI والتهاب الكبد A في الماء خلال ثوانٍ أو دقائق
د) يدمر فيروس SA-11 في الماء
ه) عندما يصل تركيز الأوزون في مصل الدم إلى 4 مجم / لتر ، فإنه قادر على تدمير فيروس نقص المناعة البشرية في 106cd50 / مل
أ) يقتل 100٪ الرشاشيات المبرقشة والبنسليوم
ب) يقتل 100٪ من رشاشيات النيجر ، fusariumoxysporumf.sp.melonogea و fusariumoxysporumf.sp. ليكوبيرسيسي
ج) يقتل الرشاشيات السوداء وبكتيريا المبيضات
2. كيف يتكون الأوزون في الطبيعة؟
يتكون من الأكسجين الجزيئي (O2) أثناء التفريغ الكهربائي أو تحت تأثير الأشعة فوق البنفسجية. هذا ملحوظ بشكل خاص في الأماكن الغنية بالأكسجين: في الغابة ، في المنطقة الساحلية أو بالقرب من الشلال. عند التعرض لأشعة الشمس ، يتحول الأكسجين الموجود في قطرة ماء إلى أوزون. تشم أيضًا رائحة الأوزون بعد عاصفة رعدية ، عندما يتكون من تفريغ كهربائي.
3. لماذا يبدو الهواء أنظف بعد عاصفة رعدية؟
يعمل الأوزون على أكسدة الشوائب من المواد العضوية ويطهر الهواء ، مما يعطي نضارة لطيفة (رائحة العواصف الرعدية). تظهر رائحة الأوزون المميزة بتركيزات 10-7٪.
4. ما هو الأوزون؟ ما هو تأثيره على الحياة على هذا الكوكب؟
تقع الكتلة الرئيسية للأوزون في الغلاف الجوي على ارتفاع من 10 إلى 50 كم مع أقصى تركيز على ارتفاع 20-25 كم ، مكونة طبقة تسمى طبقة الأوزون.
يعكس الأوزون الأشعة فوق البنفسجية الصلبة ، ويحمي الكائنات الحية من الآثار الضارة للإشعاع. بفضل تكوين "الأوزون من أكسجين الهواء ، أصبحت الحياة على الأرض ممكنة.
5. متى تم اكتشاف الأوزون وما هو تاريخ استخدامه؟
تم وصف الأوزون لأول مرة في عام 1785. الفيزيائي الهولندي ماك فان ماروم.
في عام 1832 الأستاذ. نشر شونباين من جامعة بازل كتاب "الإنتاج الكيميائي للأوزون". أطلق عليها اسم "الأوزون" من الكلمة اليونانية "الرائحة".
في عام 1857 صمم Werner von Siemens أول تركيب تقني لتنقية مياه الشرب. منذ ذلك الحين ، جعل الأوزون من الممكن الحصول على مياه نقية صحية.
بحلول عام 1977 يوجد أكثر من 1000 محطة معالجة بالأوزون لمياه الشرب حول العالم. حاليًا ، يتم معالجة 95٪ من مياه الشرب في أوروبا بالأوزون. أصبح الأوزون واسع الانتشار في كندا والولايات المتحدة الأمريكية. في روسيا ، هناك العديد من المحطات الكبيرة التي تُستخدم للمعالجة اللاحقة لمياه الشرب ، وتحضير المياه لحمامات السباحة ، والمعالجة العميقة لمياه الصرف في إعادة تدوير إمدادات المياه لغسيل السيارات.
تم استخدام الأوزون لأول مرة كمطهر خلال الحرب العالمية الأولى.
منذ عام 1935 بدأ في استخدام المستقيم من خليط الأوزون والأكسجين لعلاج أمراض الأمعاء المختلفة (التهاب المستقيم والبواسير والتهاب القولون التقرحي والناسور والقمع الكائنات الحية الدقيقة المسببة للأمراضواستعادة الجراثيم المعوية).
أتاحت دراسة تأثير الأوزون استخدامه في الممارسة الجراحية للآفات المعدية ، وعلاج السل ، والالتهاب الرئوي ، والتهاب الكبد ، وعدوى الهربس ، وفقر الدم ، إلخ.
في موسكو عام 1992. بتوجيه من العالم الفخري من الاتحاد الروسي ، دكتوراه في الطب. Zmyzgovoy A.V. تم إنشاء "المركز العلمي والعملي للعلاج بالأوزون" ، حيث يستخدم الأوزون لعلاج مجموعة واسعة من الأمراض. يستمر تطوير طرق فعالة غير ضارة للتعرض باستخدام الأوزون. اليوم ، يعتبر الأوزون شائعًا و أداة فعالةتطهير المياه والهواء وتنقية الغذاء. أيضًا ، تُستخدم مخاليط الأكسجين والأوزون في علاج الأمراض المختلفة والتجميل والعديد من مجالات الإدارة.
6. هل يمكنك تنفس الأوزون؟ هل الأوزون غاز ضار؟
في الواقع ، يعتبر استنشاق تركيزات عالية من الأوزون أمرًا خطيرًا ، فقد يؤدي إلى حرق الغشاء المخاطي لأعضاء الجهاز التنفسي.
الأوزون عامل مؤكسد قوي. هنا تكمن خصائصه الإيجابية والضارة. كل هذا يتوقف على التركيز ، أي من نسبة الأوزون في الهواء. عملها كالنار ... بكميات صغيرة تدعمها وتداويها ، وبكميات كبيرة يمكنها تدميرها.
7. متى يتم استخدام تركيزات منخفضة وعالية من الأوزون؟
تُستخدم تركيزات عالية نسبيًا للتطهير ، بينما لا تتسبب التركيزات المنخفضة من الأوزون في إتلاف بنية البروتين وتعزز الشفاء.
8. ما هو تأثير الأوزون على الفيروسات؟
يقوم الأوزون بقمع (تثبيط) الفيروس خارج الخلية وداخلها ، مما يؤدي إلى تدمير غلافها جزئيًا. تتوقف عملية تكاثرها وتعطل قدرة الفيروسات على الاتصال بخلايا الجسم.
9. كيف تتجلى خاصية الأوزون القاتلة للجراثيم عند تعرضها للكائنات الحية الدقيقة؟
عند تعرض الكائنات الحية الدقيقة للأوزون ، بما في ذلك الخميرة ، يتضرر غشاء الخلية محليًا ، مما يؤدي إلى موتها أو عدم قدرتها على التكاثر. لوحظ زيادة في حساسية الكائنات الحية الدقيقة للمضادات الحيوية.
أظهرت التجارب أن الأوزون الغازي يقتل تقريبًا جميع أنواع البكتيريا والفيروسات والعفن والفطريات التي تشبه الخميرة والبروتوزوا. الأوزون بتركيزات من 1 إلى 5 ملجم / لتر يؤدي إلى موت 99.9٪ من الإشريكية القولونية والمكورات العقدية والمخاطية والمكورات النباتية والإشريكية والزائفة الزنجارية والبروتيوس والكلبسيلا وما إلى ذلك خلال 4-20 دقيقة.
10. كيف يعمل الأوزون في الطبيعة غير الحية؟
يتفاعل الأوزون مع معظم المواد العضوية وغير العضوية. في عملية التفاعلات ، يتكون الأكسجين والماء وأكاسيد الكربون وأكاسيد عالية من عناصر أخرى. كل هذه المنتجات لا تلوث بيئةولا تؤدي إلى تكون مواد مسرطنة بعكس مركبات الكلور والفلور.
11. هل يمكن أن تكون المركبات المتكونة في أماكن المعيشة أثناء عملية الأوزون في الهواء خطيرة؟
تؤدي تركيزات الأوزون الناتجة عن جهاز الأوزون المنزلي إلى تكوين مركبات غير ضارة في المناطق السكنية. نتيجة الأوزون للغرفة ، هناك زيادة في محتوى الأكسجين في الهواء وتنقية من الفيروسات والبكتيريا.
12. ما هي المركبات التي تتكون نتيجة الأوزون في الهواء الداخلي؟
تتفاعل معظم المركبات التي تحيط بنا مع الأوزون لتشكيل مركبات غير ضارة.
يتحلل معظمهم إلى ثاني أكسيد الكربون والماء والأكسجين الحر. في بعض الحالات ، تتشكل مركبات غير نشطة (غير ضارة) (أكاسيد). هناك أيضًا ما يسمى بالمواد غير التفاعلية - أكاسيد التيتانيوم والسيليكون والكالسيوم ، إلخ. لا تتفاعل مع الأوزون.
13. هل من الضروري جعل الهواء بالأوزون في الغرف المكيفة؟
بعد مرور الهواء عبر مكيفات الهواء وأجهزة التدفئة ، ينخفض محتوى الأكسجين في الهواء ولا ينخفض مستوى المكونات السامة في الهواء. بالإضافة إلى أن مكيفات الهواء القديمة هي نفسها مصدر للتلوث والعدوى. "متلازمة الغرفة المغلقة" - صداع ، تعب ، مشاكل تنفسية متكررة. إن استخدام الأوزون لمثل هذه الأماكن ضروري ببساطة.
14. هل يمكن تطهير المكيف؟
نعم تستطيع.
15. هل استخدام الأوزون في الهواء فعال للتخلص من روائح الأماكن والأماكن التي تحتوي على دخان بعد الإصلاح (روائح الدهان والورنيش)؟
نعم ، إنها فعالة. يجب إجراء المعالجة عدة مرات ، جنبًا إلى جنب مع التنظيف الرطب.
16. ما تركيزات الأوزون المضرة للبكتيريا والفطريات في هواء المنزل؟
تركيز 50 جزيء أوزون لكل 1،000،000،000 جزيء هواء يقلل بشكل كبير من تلوث الهواء. خاصة تأثير قويتبين أنها الإشريكية القولونية ، السالمونيلا ، المكورات العنقودية الذهبية ، المبيضات ، الرشاشيات.
17. هل تم إجراء أي بحث حول تأثيرات الهواء المعالج بالأوزون على البشر؟
على وجه الخصوص ، تم وصف تجربة أجريت لمدة 5 أشهر مع مجموعتين من الأشخاص - التحكم والاختبار.
كان الهواء في غرفة مجموعة الاختبار مملوءًا بالأوزون بتركيز 15 جسيمًا من الأوزون لكل 1،000،000،000 جسيم من الهواء. لاحظ جميع الموضوعات صحة جيدة ، واختفاء التهيج. وأشار الأطباء إلى زيادة محتوى الأكسجين في الدم ، وتقوية جهاز المناعة ، وتطبيع الضغط ، واختفاء العديد من أعراض الإجهاد.
18. هل الأوزون ضار بخلايا الجسم؟
إن تركيزات الأوزون الناتجة عن عوامل الأوزون المنزلية تكبح الفيروسات والكائنات الحية الدقيقة ، ولكنها لا تلحق الضرر بخلايا الجسم ، لأن. الأوزون لا يضر الجلد. تمتلك الخلايا السليمة في جسم الإنسان دفاعًا طبيعيًا ضد الآثار الضارة للأكسدة (مضادات الأكسدة). بمعنى آخر ، تأثير الأوزون انتقائي بالنسبة للكائنات الحية.
هذا لا يمنع من تطبيق التدابير الاحترازية. أثناء عملية الأوزون ، التواجد في الغرفة أمر غير مرغوب فيه ، وبعد عملية الأوزون ، يجب تهوية الغرفة. يجب وضع عامل الأوزون في مكان لا يمكن للأطفال الوصول إليه أو يجب أن يكون من المستحيل تشغيله.
19. ما هو أداء جهاز الأوزون؟
في ظل الوضع العادي - 200 مجم / ساعة ، مع زيادة - 400 مجم / ساعة. ما هو تركيز الأوزون في الغرفة نتيجة تشغيل عامل الأوزون؟ يعتمد التركيز على حجم الغرفة وموقع جهاز الأوزون ورطوبة الهواء ودرجة الحرارة. الأوزون ليس غازًا مستقرًا ويتحلل بسرعة ، لذا فإن تركيز الأوزون يعتمد بشكل كبير على الوقت. البيانات الإرشادية 0.01 - 0.04 جزء في المليون.
20. ما هي تركيزات الأوزون في الهواء التي تعتبر مقيدة؟
تعتبر تركيزات الأوزون في حدود 0.5 - 2.5 جزء في المليون (0.0001 ملغم / لتر) آمنة.
21. لماذا يتم استخدام ماء الأوزون؟
يستخدم الأوزون للتطهير وإزالة الشوائب والرائحة ولون المياه.
1. على عكس المعالجة بالكلور والفلورة للمياه ، لا يتم إدخال أي شيء دخيل في الماء أثناء عملية الأوزون (يتحلل الأوزون بسرعة). في الوقت نفسه ، يظل التركيب المعدني ودرجة الحموضة دون تغيير.
2. يحتوي الأوزون على أكبر خصائص التطهير ضد مسببات الأمراض.
3. تدمير المواد العضوية في الماء وبالتالي منعها مزيد من التطويرالكائنات الدقيقة.
4. بدون تكوين مركبات ضارة ، يتم تدمير معظم المواد الكيميائية. وتشمل هذه المبيدات الحشرية ومبيدات الأعشاب والمنتجات البترولية والمنظفات ومركبات الكبريت والكلور ، وهي مواد مسرطنة.
5. تتأكسد المعادن إلى مركبات غير نشطة ، بما في ذلك الحديد والمنغنيز والألمنيوم ، إلخ. تترسب الأكاسيد ويمكن ترشيحها بسهولة.
6. الأوزون المتحلل بسرعة يتحول إلى أكسجين ، مما يحسن الطعم و الخصائص الطبيةماء.
23. ما هو مؤشر حموضة الماء الذي خضع لعملية الأوزون؟
يحتوي الماء على درجة حموضة قلوية قليلاً = 7.5 - 9.0. ينصح بهذه المياه للشرب.
24. ما مقدار زيادة محتوى الأكسجين في الماء بعد الأوزون؟
يزيد محتوى الأكسجين في الماء 12 مرة.
25. ما مدى سرعة تحلل الأوزون في الهواء ، في الماء؟
في الهواء بعد 10 دقائق. يتم تقليل تركيز الأوزون بمقدار النصف ، مكونًا الأكسجين والماء.
في الماء بعد 20-30 دقيقة. ينقسم الأوزون إلى نصفين ، مكونًا مجموعة الهيدروكسيل والماء.
26. كيف يؤثر تسخين المياه على محتوى الأكسجين فيه؟
ينخفض محتوى الأكسجين في الماء بعد التسخين.
27- ما الذي يحدد تركيز الأوزون في الماء؟
يعتمد تركيز الأوزون على الشوائب ودرجة الحرارة وحموضة الماء وهندسة المواد والحاويات.
28. لماذا يتم استخدام جزيء O 3 وليس O 2 ?
الأوزون قابل للذوبان في الماء أكثر بحوالي 10 مرات من الأكسجين وهو محفوظ بدرجة عالية. كلما انخفضت درجة حرارة الماء ، زاد وقت التخزين.
29. لماذا من الجيد شرب الماء المؤكسج؟
يزيد استخدام الأوزون من استهلاك الجلوكوز في الأنسجة والأعضاء ، ويزيد من تشبع بلازما الدم بالأكسجين ، ويقلل من درجة تجويع الأكسجين ، ويحسن دوران الأوعية الدقيقة.
للأوزون تأثير إيجابي على التمثيل الغذائي للكبد والكلى. يدعم عمل عضلة القلب. يقلل من معدل التنفس ويزيد من حجم المد والجزر.
30. ما هو الأوزون المنزلي؟
يمكن استخدام جهاز الأوزون المنزلي من أجل:
تطهير وإزالة الروائح الكريهة من الهواء في أماكن المعيشة ، في الحمامات وغرف المرحاض ، تغيير المنازل ، والخزائن ، والثلاجات ، وما إلى ذلك ؛
تجهيز الأغذية (اللحوم والأسماك والبيض والخضروات والفواكه) ؛
تحسين جودة المياه (التطهير ، وإثراء الأكسجين ، وإزالة الكلور والشوائب الضارة الأخرى) ؛
التجميل المنزلي (القضاء على قشرة الرأس ، حب الشباب ، الغرغرة ، تنظيف الأسنان بالفرشاة ، القضاء على الأمراض الفطرية ، تحضير الزيت المعالج بالأوزون) ؛
رعاية الحيوانات الأليفة والأسماك ؛
سطح أملس النباتات الداخليةومعالجة البذور.
التبييض وإعطاء الكتان اللون ؛
تجهيز الأحذية.
31. ما هو تأثير استخدام الأوزون في الممارسة الطبية؟
للأوزون تأثير مضاد للجراثيم ومضاد للفيروسات (تعطيل الفيروسات وتدمير الجراثيم).
يقوم الأوزون بتنشيط وتطبيع عدد من العمليات الكيميائية الحيوية.
يتميز التأثير الناتج عن العلاج بالأوزون بما يلي:
تفعيل عمليات إزالة السموم ، هناك قمع
نشاط السموم الخارجية والداخلية.
تفعيل عمليات التمثيل الغذائي (عمليات التمثيل الغذائي) ؛
زيادة دوران الأوعية الدقيقة (إمداد الدم
تحسين الخصائص الريولوجية للدم (يصبح الدم متحركًا) ؛
له تأثير مسكن واضح.
32. كيف يؤثر الأوزون على مناعة الإنسان؟
يزيد من المناعة الخلوية والخلوية. يتم تنشيط البلعمة ، ويتم تحسين تركيب الإنترفيرون وأنظمة الجسم الأخرى غير المحددة.
33. كيف يؤثر الأوزون على عمليات التمثيل الغذائي؟
يزيد استخدام الأوزون من استهلاك الجلوكوز في الأنسجة والأعضاء ، ويزيد من تشبع بلازما الدم بالأكسجين ، ويقلل من درجة تجويع الأكسجين ، ويحسن دوران الأوعية الدقيقة. للأوزون تأثير إيجابي على التمثيل الغذائي للكبد والكلى. يدعم عمل عضلة القلب. يقلل من معدل التنفس ويزيد من حجم المد والجزر.
34- يتكون الأوزون أثناء اللحام وأثناء تشغيل آلة التصوير. هل هذا الأوزون ضار؟
نعم إنه مضر ، حيث تتكون في هذه الحالة شوائب خطيرة. الأوزون الذي ينتجه عامل الأوزون نقي وبالتالي فهو غير ضار.
35. هل هناك فرق بين عوامل الأوزون الصناعية والطبية والمنزلية؟
تعطي مركبات الأوزون الصناعية تركيزًا عاليًا من الأوزون ، وهو خطير للاستخدام المنزلي.
أجهزة الأوزون الطبية والمنزلية متقاربة من حيث الأداء ، ولكن الأدوية الطبية مصممة لفترة أطول من التشغيل المستمر.
36. ما هي الخصائص المقارنة للتطهير عند استخدام وحدات الأشعة فوق البنفسجية وأجهزة الأوزون؟
الأوزون 2.5 - 6 مرات أكثر فعالية من الأشعة فوق البنفسجية و 300 - 600 مرة أكثر فعالية من الكلور من حيث قدرته على تدمير البكتيريا والفيروسات. في الوقت نفسه ، على عكس الكلور ، يدمر الأوزون حتى أكياس الديدان وفيروس الهربس والسل.
يزيل الأوزون المواد العضوية والكيميائية من الماء ، ويحللها إلى ماء ، وثاني أكسيد الكربون ، مكونًا راسبًا من العناصر غير النشطة.
يؤكسد الأوزون الحديد وأملاح المنغنيز بسهولة ، مكونًا مواد غير قابلة للذوبان يتم إزالتها عن طريق الترسيب أو الترشيح. ونتيجة لذلك ، فإن المياه المعالجة بالأوزون آمنة ونقية وممتعة للذوق.
37. هل يمكنك تطهير الأطباق بالأوزون؟
نعم! من الجيد تطهير أطباق الأطفال ، وأطباق التعليب ، وما إلى ذلك. للقيام بذلك ، ضع الأطباق في وعاء به ماء ، وقم بخفض مجرى الهواء باستخدام مقسم. العملية لمدة 10-15 دقيقة.
38- ما هي المواد التي يجب أن تصنع منها أواني الأوزون؟
زجاج ، سيراميك ، خشب ، بلاستيك ، مطلي بالمينا (بدون شقوق أو شقوق). لا تستخدم الأواني المعدنية ، بما في ذلك الألمنيوم والنحاس. المطاط لا يتحمل ملامسة الأوزون.
سيساعدك جهاز الأوزون الأنيوني من شركة Green World الأمريكية ليس فقط في الحفاظ على صحتك ، ولكن أيضًا على تحسينها بشكل كبير. لديك الفرصة لاستخدام جهاز لا غنى عنه في منزلك - جهاز أوزون أنيون ، والذي يجمع بين جميع الصفات والوظائف لكل من مؤين الهواء ومؤين الأوزون (متعدد الوظائف ...
جهاز الأوزون للسيارة مزود بإضاءة ومعطر. يمكن تشغيل وضعي الأوزون والتأين في نفس الوقت. يمكن أيضًا تمكين هذه الأوضاع بشكل فردي. لا غنى عن عامل الأوزون هذا في الرحلات الطويلة ، عندما يزداد إجهاد السائق وتتدهور الرؤية والذاكرة. يعمل معالج الأوزون على التخلص من النعاس ، ويعطي قوة بسبب تدفق ...
OZONE O3 (من رائحة الأوزون اليونانية) هو تعديل متآصل للأكسجين يمكن أن يوجد في جميع حالات التجميع الثلاث. الأوزون مركب غير مستقر ، وحتى في درجة حرارة الغرفة يتحلل ببطء إلى أكسجين جزيئي ، لكن الأوزون ليس جذريًا.
الخصائص الفيزيائية
الوزن الجزيئي = 47.9982 جم / مول. تبلغ كثافة الأوزون الغازي 2.144 10-3 جم / سم 3 عند ضغط 1 ضغط جوي و 29 درجة مئوية.
الأوزون مادة خاصة. إنه غير مستقر للغاية ، ومع زيادة التركيز ، فإنه لا يتناسب بسهولة وفقًا للمخطط العام: 2O3 -> 3O2. في الشكل الغازي ، يكون للأوزون لون مزرق ، يمكن ملاحظته عندما يكون محتوى الأوزون في الهواء 15-20٪.
الأوزون في الظروف الطبيعية- غاز ذو رائحة نفاذة. في التركيزات المنخفضة جدًا ، يُنظر إلى رائحة الأوزون على أنها نضارة لطيفة ، ولكن مع زيادة التركيز تصبح غير سارة. رائحة الغسيل المجمد هي رائحة الأوزون. من السهل التعود عليها.
وتتركز الكمية الرئيسية في ما يسمى "حزام الأوزون" على ارتفاع 15-30 كم. على سطح الأرض ، يكون تركيز الأوزون أقل بكثير وهو آمن تمامًا للكائنات الحية ؛ حتى أن هناك رأيًا مفاده أن الغياب التام له يؤثر أيضًا سلبًا على أداء الشخص.
بتركيزات تبلغ حوالي 10 MPC ، يشعر الأوزون بشكل جيد للغاية ، ولكن بعد بضع دقائق يختفي الشعور تمامًا تقريبًا. يجب أن يؤخذ هذا في الاعتبار عند العمل معها.
ومع ذلك ، يضمن الأوزون أيضًا الحفاظ على الحياة على الأرض ، لأنه. تحتفظ طبقة الأوزون بأكثرها ضررًا للكائنات الحية والنباتات جزءًا من الأشعة فوق البنفسجية للشمس بطول موجة أقل من 300 نانومتر ، إلى جانب ثاني أكسيد الكربون يمتص الأشعة تحت الحمراء للأرض ، مما يمنع تبريدها.
الأوزون قابل للذوبان أكثر من الأكسجين في الماء. في الماء ، يتحلل الأوزون بشكل أسرع بكثير من الطور الغازي ، ووجود الشوائب ، وخاصة أيونات المعادن ، له تأثير كبير بشكل استثنائي على معدل التحلل.
رسم بياني 1. تحلل الأوزون إلى أنواع مختلفةالماء عند درجة حرارة 20 درجة مئوية (1 - نواتج شطف ؛ 2 - نواتج التقطير ؛ 3 - ماء الصنبور ؛ 4 - مياه البحيرة المفلترة)
يتم امتصاص الأوزون جيدًا بواسطة هلام السيليكا وهلام الألومينا. عند الضغط الجزئي للأوزون ، على سبيل المثال 20 ملم زئبق. الفن ، وعند 0 درجة مئوية ، يمتص هلام السيليكا حوالي 0.19٪ أوزون بالوزن. في درجات الحرارة المنخفضة ، يضعف الامتصاص بشكل ملحوظ. في حالة الامتصاص ، يكون الأوزون مستقرًا جدًا. قدرة التأين للأوزون هي 12.8 فولت.
الخصائص الكيميائية للأوزون
وهي تختلف في سمتين رئيسيتين - عدم الاستقرار والقدرة على التأكسد. يختلط مع الهواء بتركيزات صغيرة ، ويتحلل ببطء نسبيًا ، ولكن مع ارتفاع درجة الحرارة ، يتسارع تحللها ويصبح سريعًا جدًا عند درجات حرارة أعلى من 100 درجة مئوية.
إن وجود NO2 ، Cl في الهواء ، وكذلك التأثير الحفاز لأكاسيد المعادن - الفضة والنحاس والحديد والمنغنيز - يسرع من تحلل الأوزون. يتمتع الأوزون بخصائص مؤكسدة قوية لأن إحدى ذرات الأكسجين تنفصل بسهولة عن جزيءها. يمر بسهولة في الأكسجين.
يعمل الأوزون على أكسدة معظم المعادن في درجات الحرارة العادية. المحاليل المائية الحمضية للأوزون مستقرة تمامًا ؛ في المحاليل القلوية ، يتم تدمير الأوزون بسرعة. معادن التكافؤ المتغيرة (Mn ، Co ، Fe ، إلخ) ، العديد من الأكاسيد ، البيروكسيدات والهيدروكسيدات تدمر الأوزون بشكل فعال. يتم تغطية معظم الأسطح المعدنية بغشاء أكسيد في أعلى حالة تكافؤ للمعدن (على سبيل المثال ، PbO2 ، AgO أو Ag2O3 ، HgO).
يعمل الأوزون على أكسدة جميع المعادن ، باستثناء معادن مجموعة الذهب والبلاتين ، ويتفاعل مع معظم العناصر الأخرى ، ويتحلل هاليدات الهيدروجين (باستثناء HF) ، ويحول الأكاسيد المنخفضة إلى أكاسيد أعلى ، إلخ.
لا يؤكسد الذهب والبلاتين والإيريديوم 75٪ حديد + 25٪ كروم سبيكة. يحول كبريتيد الرصاص الأسود PbS إلى كبريتات بيضاء PbSO4 ، أنهيدريد الزرنيخ As2O3 إلى الزرنيخ As2O5 ، إلخ.
تفاعل الأوزون مع أيونات المعادن ذات التكافؤ المتغير (Mn ، Cr و Co) في السنوات الاخيرةيجد تطبيقًا عمليًا لتخليق المواد الوسيطة للأصباغ ، فيتامين PP (حمض أيزونيكوتينيك) ، إلخ. تتأكسد مخاليط من أملاح المنغنيز والكروم في محلول حمضي يحتوي على مركب مؤكسد (على سبيل المثال ، ميثيل بيريدين) بواسطة الأوزون. في هذه الحالة ، تمر أيونات Cr3 + إلى Cr6 + وتؤكسد ميثيل بيريدين فقط في مجموعات الميثيل. في حالة عدم وجود أملاح معدنية ، يتم تدمير النواة العطرية في الغالب.
يتفاعل الأوزون أيضًا مع العديد من الغازات الموجودة في الغلاف الجوي. عندما يقترن كبريتيد الهيدروجين مع الأوزون ، فإنه يطلق الكبريت الحر ، ويتحول أنهيدريد الكبريت SO2 إلى كبريتيد SO3 ؛ أكسيد النيتروز N2O - إلى NO ، يتأكسد أكسيد النيتريك NO بسرعة إلى NO2 ، وبدوره يتفاعل NO2 أيضًا مع الأوزون ، وفي النهاية يتشكل N2O5 ؛ الأمونيا NH3 - إلى ملح نيتروجين أمونيوم NH4NO3.
من أهم تفاعلات الأوزون مع المواد غير العضوية تحلل يوديد البوتاسيوم. يستخدم هذا التفاعل على نطاق واسع في التحديد الكمي للأوزون.
في بعض الحالات ، يتفاعل الأوزون أيضًا مع المواد الصلبة ، مكونًا الأوزون. أوزونيدات الفلزات القلوية ، الفلزات القلوية الأرضية: تم عزل السترونشيوم ، الباريوم ، وتزداد درجة حرارة استقرارها في السلسلة المشار إليها ؛ Ca (O3) 2 مستقر عند 238 كلفن ، Ba (O3) 2 عند 273 كلفن تتحلل الأوزون لتكوين أكسيد فوقي ، على سبيل المثال NaO3 -> NaO2 + 1 / 2O2. تتشكل أيضًا مركبات الأوزون المختلفة في تفاعلات الأوزون مع المركبات العضوية.
يؤكسد الأوزون العديد من المواد العضوية ، الهيدروكربونات المشبعة وغير المشبعة والحلقة. تم نشر العديد من الأعمال حول دراسة تكوين نواتج تفاعل الأوزون مع الهيدروكربونات العطرية المختلفة: البنزين ، والزيلين ، والنفثالين ، والفينانثرين ، والأنثراسين ، والبنزانثراسين ، والديفينيل أمين ، والكينولين ، وحمض الأكريليك ، وما إلى ذلك. الأصباغ ، بسبب استخدامه حتى في تبييض الأقمشة.
معدل تفاعل الأوزون مع الرابطة المزدوجة C = C هو 100000 مرة أسرع من معدل تفاعل الأوزون مع واحد اتصال C-C. لذلك ، يتأثر المطاط والمطاط بشكل أساسي بالأوزون. يتفاعل الأوزون مع الرابطة المزدوجة لتكوين مركب وسيط:

يحدث هذا التفاعل بسرعة كبيرة بالفعل عند درجات حرارة أقل من 0 درجة مئوية. في حالة المركبات المشبعة ، يكون الأوزون هو البادئ في تفاعل الأكسدة المعتاد:

المثير للاهتمام هو تفاعل الأوزون مع بعض الأصباغ العضوية ، والتي تتألق بقوة في وجود الأوزون في الهواء. هذه ، على سبيل المثال ، eichrosine و riboflavin و luminol (triaminophthalhydrazide) ، وخاصةً rhodamine-B ، ومثلها ، rhodamine-C.
الخصائص المؤكسدة العالية للأوزون ، تدمير المواد العضوية والمعادن المؤكسدة (خاصة الحديد) إلى شكل غير قابل للذوبان ، والقدرة على تحلل المركبات الغازية القابلة للذوبان في الماء ، وتشبع المحاليل المائية بالأكسجين ، وانخفاض ثبات الأوزون في الماء والتدمير الذاتي من خصائصه الخطرة على البشر - كل هذا مجتمعة يجعل الأوزون المادة الأكثر جاذبية لإعداد المياه المنزلية ومعالجة النفايات السائلة المختلفة.
تخليق الأوزون
يتكون الأوزون في وسط غازي يحتوي على الأكسجين إذا نشأت ظروف ينفصل فيها الأكسجين إلى ذرات. هذا ممكن في جميع أشكال التفريغ الكهربائي: التوهج ، القوس ، الشرارة ، الهالة ، السطح ، الحاجز ، الكهربائي ، إلخ. السبب الرئيسي للتفكك هو اصطدام الأكسجين الجزيئي بالإلكترونات المتسارعة في مجال كهربائي.
بالإضافة إلى التفريغ ، يحدث تفكك الأكسجين بسبب الأشعة فوق البنفسجية التي يقل طولها الموجي عن 240 نانومتر والعديد من الجسيمات عالية الطاقة: جسيمات ألفا وبيتا وجاما والأشعة السينية وما إلى ذلك. ينتج الأوزون أيضًا عن طريق التحليل الكهربائي للماء.
في جميع مصادر تكوين الأوزون تقريبًا ، توجد مجموعة من التفاعلات ، ونتيجة لذلك يتحلل الأوزون. إنها تتدخل في تكوين الأوزون ، لكنها موجودة بالفعل ، ويجب أخذها في الاعتبار. يشمل ذلك التحلل الحراري في حجم المفاعل وعلى جدرانه ، وتفاعلاته مع الجذور والجسيمات المثارة ، والتفاعلات مع المواد المضافة والشوائب التي يمكن أن تتلامس مع الأكسجين والأوزون.
تتكون الآلية الكاملة من عدد كبير من ردود الفعل. تُظهر التركيبات الحقيقية ، بغض النظر عن المبدأ الذي تعمل عليه ، تكاليف طاقة عالية لإنتاج الأوزون. تعتمد كفاءة مولد الأوزون على الطاقة - الكاملة أو النشطة - التي يتم حسابها لكل وحدة كتلة من الأوزون المتولد.
تصريف الحاجز
يُفهم تفريغ الحاجز على أنه تفريغ يحدث بين عازلين أو عازل ومعدن. نظرًا لحقيقة أن الدائرة الكهربائية مقطوعة بواسطة عازل ، يتم توفير الطاقة فقط عن طريق التيار المتردد. لأول مرة ، تم اقتراح جهاز أوزون قريب من الحديثة في عام 1897 من قبل شركة سيمنز.
عند الطاقة المنخفضة ، لا يمكن تبريد جهاز الأوزون ، حيث يتم نقل الحرارة المنبعثة مع تدفق الأكسجين والأوزون. في المنتجات الصناعيةيتم تصنيع الأوزون أيضًا في أجهزة الأوزون القوسية (البلازماترونات) ، في مولدات الأوزون المتوهجة (الليزر) والتفريغ السطحي.
طريقة الكيمياء الضوئية
يتم إنتاج معظم الأوزون المنتج على الأرض في الطبيعة عن طريق العمليات الكيميائية الضوئية. في الأنشطة العمليةفي البشر ، تلعب طرق التخليق الكيميائي الضوئي دورًا أقل من التوليفات في تفريغ الحاجز. المجال الرئيسي لاستخدامها هو الحصول على تركيزات متوسطة ومنخفضة من الأوزون. تركيزات الأوزون هذه مطلوبة ، على سبيل المثال ، عند اختبار منتجات المطاط لمقاومة التشقق تحت تأثير الأوزون الجوي. في الممارسة العملية ، لإنتاج الأوزون بهذه الطريقة ، يتم استخدام مصابيح الزئبق ومصابيح الزينون.
طريقة التوليف الالكتروليتي
يعود أول ذكر لتشكيل الأوزون في عمليات التحليل الكهربائي إلى عام 1907. ومع ذلك ، لا تزال آلية تكوينه غير واضحة حتى الآن.
عادة ، يتم استخدام المحاليل المائية لحمض البيركلوريك أو حمض الكبريتيك كإلكتروليت ، وتصنع الأقطاب الكهربائية من البلاتين. أظهر استخدام الأحماض المصنفة بـ O18 أنها لا تتخلى عن الأكسجين أثناء تكوين الأوزون. لذلك ، يجب أن يأخذ المخطط الإجمالي في الاعتبار فقط تحلل الماء:
H2O + O2 -> O3 + 2H + + e-
مع احتمال تكوين وسيط للأيونات أو الجذور.
تكوين الأوزون تحت تأثير الإشعاع المؤين
يتكون الأوزون في عدد من العمليات المصحوبة بإثارة جزيء الأكسجين إما بالضوء أو بواسطة مجال كهربائي. عندما تشع بالأكسجين إشعاعات أيونيةيمكن أن تحدث الجزيئات المثارة أيضًا ويلاحظ تكوين الأوزون. لم يتم استخدام تكوين الأوزون تحت تأثير الإشعاع المؤين لتخليق الأوزون.
تكوين الأوزون في مجال الميكروويف
عندما تم تمرير الأكسجين النفاث عبر مجال الميكروويف ، لوحظ تكوين الأوزون. تمت دراسة هذه العملية قليلاً ، على الرغم من أن المولدات القائمة على هذه الظاهرة غالبًا ما تستخدم في الممارسة المختبرية.
استخدام الأوزون في الحياة اليومية وأثره على الإنسان
الأوزون من الماء والهواء والمواد الأخرى
لا يحتوي الماء المعالج بالأوزون على هالوميثان سامة - شوائب نموذجية لتعقيم المياه بالكلور. يتم تنفيذ عملية الأوزون في حمامات الفقاعات أو الخلاطات ، حيث يتم خلط الماء المنقى من المعلق مع الهواء المعالج بالأوزون أو الأكسجين. عيب هذه العملية هو التدمير السريع لـ O3 في الماء (نصف العمر 15-30 دقيقة).
يستخدم الأوزون أيضًا في الصناعات الغذائيةلتعقيم الثلاجات والمستودعات والقضاء على الرائحة الكريهة ؛ في الممارسة الطبية - لتطهير الجروح المفتوحة وعلاج بعض الأمراض المزمنة (القرحة الغذائية ، الأمراض الفطرية) ، أوزون الدم الوريدي ، المحاليل الفسيولوجية.
تتكون أجهزة الأوزون الحديثة ، التي يتم الحصول فيها على الأوزون عن طريق التفريغ الكهربائي في الهواء أو في الأكسجين ، من مولدات الأوزون وإمدادات الطاقة وهي جزء لا يتجزأ من تركيبات الأوزون ، والتي تشمل ، بالإضافة إلى أجهزة الأوزون ، الأجهزة المساعدة.
حاليًا ، الأوزون هو غاز يستخدم في ما يسمى بتقنيات الأوزون: تنقية وتحضير مياه الشرب ، ومعالجة مياه الصرف الصحي (مياه الصرف الصحي المنزلية والصناعية) ، ونفايات الغاز ، وما إلى ذلك.
اعتمادًا على تقنية استخدام الأوزون ، يمكن أن تتراوح إنتاجية مولد الأوزون من كسور جرام إلى عشرات الكيلوجرامات من الأوزون في الساعة. تستخدم أجهزة الأوزون الخاصة لتعقيم الأدوات الطبية والمعدات الصغيرة بالغاز. يتم التعقيم في بيئة الأوزون والأكسجين المبللة صناعياً والتي تملأ غرفة التعقيم. تتكون دورة التعقيم من مرحلة استبدال الهواء في غرفة التعقيم بخليط الأوزون والأكسجين المبلل ومرحلة التعقيم ومرحلة استبدال خليط الأوزون والأكسجين في الغرفة بهواء منقى ميكروبيولوجيًا.
للأوزون المستخدمة في الطب لعلاج الأوزون مجموعة واسعة من التنظيم لتركيز خليط الأوزون والأكسجين. يتم التحكم في الدقة المضمونة للتركيز الناتج لخليط الأوزون والأكسجين عن طريق نظام أتمتة الأوزون ويتم صيانتها تلقائيًا.
التأثير البيولوجي للأوزون
يعتمد التأثير البيولوجي للأوزون على طريقة تطبيقه وجرعته وتركيزه. تظهر العديد من آثاره في نطاقات تركيز مختلفة في درجات متفاوته. أساس التأثير العلاجي للعلاج بالأوزون هو استخدام مخاليط الأوزون والأكسجين. تسبب إمكانات الأكسدة العالية للأوزون تأثيرها العلاجي الجهازي (استعادة توازن الأكسجين) والتأثير العلاجي المحلي (المطهر الواضح).
تم استخدام الأوزون لأول مرة كعامل مطهر بواسطة A. Wolff في عام 1915 لعلاج الجروح المصابة. في السنوات الأخيرة ، تم استخدام العلاج بالأوزون بنجاح في جميع مجالات الطب تقريبًا: في حالات الطوارئ والجراحة القيحية ، والجراحة العامة والجراحة. العلاج المعدي، أمراض النساء ، المسالك البولية ، أمراض الجهاز الهضمي ، الأمراض الجلدية ، التجميل ، إلخ. يرجع استخدام الأوزون إلى مجموعة فريدة من التأثيرات على الجسم ، بما في ذلك. مناعي ، مضاد للالتهابات ، مبيد للجراثيم ، مضاد للفيروسات ، مبيد للفطريات ، إلخ.
ومع ذلك ، لا يمكن إنكار أن طرق استخدام الأوزون في الطب ، على الرغم من المزايا الواضحة في العديد من المؤشرات البيولوجية ، لا تزال قائمة تطبيق واسعلم استلم. وفقًا لبيانات الأدبيات ، فإن التركيزات العالية من الأوزون هي مبيد للجراثيم تمامًا لجميع سلالات الكائنات الحية الدقيقة تقريبًا. لذلك ، يتم استخدام الأوزون في الممارسة السريرية كمطهر عالمي في إعادة تأهيل البؤر المعدية والالتهابية لمختلف المسببات والتوطين.
توجد في الأدبيات بيانات عن زيادة فعالية المستحضرات المطهرة بعد الأوزون في علاج الأمراض الجراحية القيحية الحادة.
استنتاجات بشأن الاستخدام المحلي للأوزون
بادئ ذي بدء ، من الضروري التأكيد دون قيد أو شرط على حقيقة استخدام الأوزون في ممارسة الشفاء في العديد من مجالات الطب ، كعامل علاجي ومطهر ، لكن لا يزال من غير الممكن الحديث عن استخدامه على نطاق واسع.
ينظر إلى الأوزون من قبل شخص لديه أقل مظاهر الحساسية السلبية. وحتى إذا كان بالإمكان العثور في الأدبيات على ذكر التعصب الفردي لـ O3 ، فلا يمكن مقارنة هذه الحالات ، على سبيل المثال ، بالأدوية المحتوية على الكلور والأدوية المضادة للبكتيريا المهلجنة الأخرى.
الأوزون هو أكسجين ثلاثي الذرات وهو الأكثر صداقة للبيئة. من منا لا يعرف رائحة "النضارة" - في أيام الصيف الحارة بعد عاصفة رعدية ؟! إن وجوده المستمر في الغلاف الجوي للأرض يمر به أي كائن حي.
تستند المراجعة إلى مواد من الإنترنت.
أدرك العلماء لأول مرة وجود غاز غير معروف عندما بدأوا في تجربة الآلات الكهروستاتيكية. حدث ذلك في القرن السابع عشر. لكنهم بدأوا في دراسة الغاز الجديد فقط في نهاية القرن المقبل. في عام 1785 ، ابتكر الفيزيائي الهولندي مارتن فان ماروم الأوزون عن طريق تمرير شرارات كهربائية عبر الأكسجين. ظهر اسم الأوزون فقط في عام 1840 ؛ تم اختراعه من قبل الكيميائي السويسري كريستيان شونباين ، مستمدًا إياه من الأوزون اليوناني ، رائحته. لم يختلف التركيب الكيميائي لهذا الغاز عن الأكسجين ، ولكنه كان أكثر عدوانية. لذلك ، قام على الفور بأكسدة يوديد البوتاسيوم عديم اللون مع إطلاق اليود البني ؛ استخدم Shenbein هذا التفاعل لتحديد الأوزون من خلال درجة زرقة الورق المشبع بمحلول يوديد البوتاسيوم والنشا. حتى الزئبق والفضة ، غير النشطين في درجة حرارة الغرفة ، يتأكسدان في وجود الأوزون.
اتضح أن جزيئات الأوزون ، مثل الأكسجين ، تتكون فقط من ذرات الأكسجين ، ليس فقط من ذرتين ، ولكن من ثلاث. يعتبر الأكسجين O2 والأوزون O3 المثال الوحيد لتكوين مادتين غازيتين بسيطتين (في ظل الظروف العادية) بواسطة عنصر كيميائي واحد. في جزيء O3 ، توجد الذرات بزاوية ، لذلك تكون هذه الجزيئات قطبية. ينتج الأوزون نتيجة "الالتصاق" بجزيئات O2 من ذرات الأكسجين الحرة ، والتي تتكون من جزيئات الأكسجين تحت تأثير التفريغ الكهربائي والأشعة فوق البنفسجية وأشعة جاما والإلكترونات السريعة والجسيمات الأخرى عالية الطاقة. تنبعث رائحة الأوزون دائمًا بالقرب من الآلات الكهربائية العاملة ، حيث تتألق الفرشاة بالقرب من مصابيح الزئبق والكوارتز التي تنبعث منها الأشعة فوق البنفسجية. يتم إطلاق ذرات الأكسجين أيضًا أثناء بعض التفاعلات الكيميائية. يتكون الأوزون بكميات صغيرة أثناء التحليل الكهربائي للماء المحمض ، وأثناء الأكسدة البطيئة للفوسفور الأبيض الرطب في الهواء ، وأثناء تحلل المركبات ذات المحتوى العالي من الأكسجين (KMnO4 ، K2Cr2O7 ، وما إلى ذلك) ، تحت تأثير الفلور على الماء أو على بيروكسيد الباريوم لحمض الكبريتيك المركز. توجد ذرات الأكسجين دائمًا في اللهب ، لذلك إذا وجهت تيارًا من الهواء المضغوط عبر لهب موقد الأكسجين ، فستجد رائحة الأوزون المميزة في الهواء.
يكون التفاعل 3O2 → 2O3 ماصًا للحرارة بدرجة عالية: يجب إنفاق 142 كيلو جول لإنتاج 1 مول من الأوزون. يستمر التفاعل العكسي مع إطلاق الطاقة ويتم تنفيذه بسهولة بالغة. تبعا لذلك ، الأوزون غير مستقر. في حالة عدم وجود شوائب ، يتحلل الأوزون الغازي ببطء عند درجة حرارة 70 درجة مئوية وبسرعة أعلى من 100 درجة مئوية. يزداد معدل تحلل الأوزون بشكل كبير في وجود المحفزات. يمكن أن تكون غازات (على سبيل المثال ، أكسيد النيتريك والكلور) والعديد من المواد الصلبة (حتى جدران الأوعية). لذلك يصعب الحصول على أوزون نقي ، والعمل معه خطر بسبب احتمالية حدوث انفجار.
ليس من المستغرب أنه لعقود عديدة بعد اكتشاف الأوزون ، حتى ثوابته الفيزيائية الأساسية كانت غير معروفة: لفترة طويلة لم يتمكن أحد من الحصول على أوزون نقي. كما كتب D.I Mendeleev في كتابه المدرسي أساسيات الكيمياء ، "بالنسبة لجميع طرق تحضير الأوزون الغازي ، فإن محتواه من الأكسجين يكون دائمًا ضئيلًا ، عادةً فقط بضعة أعشار بالمائة ، ونادرًا 2٪ ، وفقط في درجات حرارة منخفضة جدًا يصل إلى 20٪. " فقط في عام 1880 ، حصل العالمان الفرنسيان J. Gotfeil و P. Chappui على الأوزون من الأكسجين النقي عند درجة حرارة أقل من 23 درجة مئوية. واتضح أن طبقة الأوزون السميكة لها لون أزرق جميل. عندما تم ضغط الأكسجين المعالج بالأوزون المبرد ببطء ، تحول الغاز إلى اللون الأزرق الداكن ، وبعد الإطلاق السريع للضغط ، انخفضت درجة الحرارة بشكل أكبر وتشكلت قطرات الأوزون السائل الأرجواني الداكن. إذا لم يتم تبريد الغاز أو ضغطه بسرعة ، فإن الأوزون على الفور ، مع وميض أصفر ، يتحول إلى أكسجين.
في وقت لاحق ، تم تطوير طريقة ملائمة لتخليق الأوزون. إذا تعرض محلول مركز من حمض البيركلوريك أو الفوسفوريك أو حمض الكبريتيك للتحليل الكهربائي باستخدام أنود مبرد مصنوع من البلاتين أو أكسيد الرصاص (IV) ، فإن الغاز المنطلق عند الأنود سيحتوي على نسبة تصل إلى 50٪ من الأوزون. كما تم تنقيح الثوابت الفيزيائية للأوزون. يسيل أخف بكثير من الأكسجين عند -112 درجة مئوية (أكسجين عند -183 درجة مئوية). يصلب طبقة الأوزون عند درجة حرارة -192.7 درجة مئوية. الأوزون الصلب لونه أزرق-أسود.
التجارب مع الأوزون خطيرة. الأوزون الغازي قادر على الانفجار إذا تجاوز تركيزه في الهواء 9٪. ينفجر الأوزون السائل والصلب بسهولة أكبر ، خاصة عند ملامسته للمواد المؤكسدة. يمكن تخزين الأوزون في درجات حرارة منخفضة في شكل محاليل في الهيدروكربونات المفلورة (الفريونات). هذه الحلول زرقاء اللون.
الخصائص الكيميائية للأوزون.
يتميز الأوزون بفاعلية عالية للغاية. الأوزون هو أحد أقوى العوامل المؤكسدة وهو أقل شأنا في هذا الصدد من الفلور وفلوريد الأكسجين OF2. المبدأ النشط للأوزون كعامل مؤكسد هو الأكسجين الذري ، والذي يتكون أثناء تحلل جزيء الأوزون. لذلك ، يعمل جزيء الأوزون كعامل مؤكسد ، كقاعدة عامة ، "يستخدم" ذرة أكسجين واحدة فقط ، بينما يتم إطلاق الاثنين الآخرين في شكل أكسجين حر ، على سبيل المثال ، 2KI + O3 + H2O → I2 + 2KOH + O2. تتأكسد العديد من المركبات الأخرى بنفس الطريقة. ومع ذلك ، هناك استثناءات عندما يستخدم جزيء الأوزون جميع ذرات الأكسجين الثلاثة التي يحتوي عليها للأكسدة ، على سبيل المثال ، 3SO2 + O3 → 3SO3 ؛ Na2S + O3 → Na2SO3.
الفرق المهم للغاية بين الأوزون والأكسجين هو أن الأوزون يعرض خصائص مؤكسدة حتى في درجة حرارة الغرفة. على سبيل المثال ، لا يتفاعل PbS و Pb (OH) 2 مع الأكسجين في ظل الظروف العادية ، بينما في وجود الأوزون ، يتم تحويل الكبريتيد إلى PbSO4 ، والهيدروكسيد إلى PbO2. إذا تم سكب محلول مركز من الأمونيا في وعاء به الأوزون ، فسيظهر دخان أبيض - هذه هي الأمونيا المؤكسدة بالأوزون لتكوين نتريت الأمونيوم NH4NO2. السمة المميزة للأوزون هي القدرة على "اسوداد" العناصر الفضية بتكوين AgO و Ag2O3.
من خلال ربط إلكترون واحد وتحويله إلى أيون سالب O3– ، يصبح جزيء الأوزون أكثر استقرارًا. تُعرف "أملاح الأوزون" أو الأوزون التي تحتوي على مثل هذه الأنيونات لفترة طويلة - تتكون من جميع المعادن القلوية باستثناء الليثيوم ، ويزيد استقرار الأوزون من الصوديوم إلى السيزيوم. بعض الأوزونيدات من الفلزات القلوية الأرضية معروفة أيضًا ، على سبيل المثال Ca (O3) 2. إذا تم توجيه تيار من الأوزون الغازي إلى سطح قلوي جاف صلب ، تتشكل قشرة برتقالية حمراء تحتوي على أوزونيدات ، على سبيل المثال ، 4KOH + 4O3 → 4KO3 + O2 + 2H2O. في الوقت نفسه ، تعمل القلويات الصلبة على ربط الماء بشكل فعال ، مما يمنع الأوزون من التحلل المائي الفوري. ومع ذلك ، مع وجود فائض من الماء ، تتحلل الأوزون بسرعة: 4KO3 + 2H2O → 4KOH + 5O2. يحدث التحلل أيضًا أثناء التخزين: 2KO3 → 2KO2 + O2. الأوزون شديد الذوبان في الأمونيا السائلة ، مما جعل من الممكن عزلها في شكلها النقي ودراسة خصائصها.
المواد العضوية التي يتلامس معها الأوزون ، عادة ما تدمر. لذلك ، فإن الأوزون ، على عكس الكلور ، قادر على تقسيم حلقة البنزين. عند العمل مع الأوزون ، لا يمكنك استخدام الأنابيب والخراطيم المطاطية - سوف "تتسرب" على الفور. يتفاعل الأوزون مع المركبات العضوية بإطلاق كمية كبيرة من الطاقة. على سبيل المثال ، يشتعل الأثير والكحول والصوف القطني المبلل بزيت التربنتين والميثان والعديد من المواد الأخرى تلقائيًا عند ملامسته للهواء المعالج بالأوزون ، ويؤدي خلط الأوزون مع الإيثيلين إلى انفجار قوي.
استخدام الأوزون.
الأوزون لا "يحرق" المواد العضوية دائمًا ؛ في عدد من الحالات ، من الممكن إجراء تفاعلات محددة مع الأوزون المخفف للغاية. على سبيل المثال ، ينتج حمض الأوليك بالأوزون (الموجود بكميات كبيرة في الزيوت النباتية) حمض الأزيليك HOOC (CH2) 7COOH ، والذي يستخدم لإنتاج زيوت تشحيم عالية الجودة ، وألياف تركيبية ، وملدنات للبلاستيك. وبالمثل ، يتم الحصول على حمض الأديبيك ، والذي يستخدم في تصنيع النايلون. في عام 1855 ، اكتشف شونباين تفاعل المركبات غير المشبعة التي تحتوي على روابط C = C المزدوجة مع الأوزون ، ولكن لم يؤسس الكيميائي الألماني H. Staudinger حتى عام 1925 آلية هذا التفاعل. يضيف جزيء الأوزون إلى الرابطة المزدوجة لتشكيل أوزونيد ، هذه المرة عضوي ، وتحل ذرة الأكسجين محل إحدى روابط C = C ، وتحل المجموعة О محل الأخرى. على الرغم من عزل بعض الأوزون العضوي في صورة نقية (على سبيل المثال ، أوزونيد الإيثيلين) ، يتم إجراء هذا التفاعل عادةً في محلول مخفف ، نظرًا لأن الأوزون في الحالة الحرة عبارة عن متفجرات غير مستقرة للغاية. يحظى تفاعل الأوزون للمركبات غير المشبعة باحترام كبير بين الكيميائيين العضويين ؛ غالبًا ما يتم عرض مشاكل رد الفعل هذا حتى في الألعاب الأولمبية المدرسية. الحقيقة هي أنه عندما يتحلل الأوزونيد بالماء ، يتم تكوين جزيئين من الألدهيد أو الكيتون ، مما يسهل التعرف عليه وإثبات بنية المركب الأصلي غير المشبع. وهكذا ، في بداية القرن العشرين ، أنشأ الكيميائيون بنية العديد من المركبات العضوية المهمة ، بما في ذلك المركبات الطبيعية ، التي تحتوي على روابط C = C.
أحد المجالات المهمة لتطبيق الأوزون هو تطهير مياه الشرب. عادة الماء مكلور. ومع ذلك ، يتم تحويل بعض الشوائب الموجودة في الماء تحت تأثير الكلور إلى مركبات ذات رائحة كريهة للغاية. لذلك ، تم اقتراح استبدال الكلور بالأوزون منذ فترة طويلة. لا يكتسب الماء المعالج بالأوزون رائحة أو طعمًا غريبًا ؛ عندما تتأكسد العديد من المركبات العضوية تمامًا بالأوزون ، يتشكل ثاني أكسيد الكربون والماء فقط. تنقية باستخدام الأوزون ومياه الصرف. تعتبر منتجات أكسدة الأوزون حتى من الملوثات مثل الفينولات والسيانيدات والمواد الخافضة للتوتر السطحي والكبريتيت والكلورامين مركبات غير ضارة بدون لون ورائحة. الأوزون الزائد يتحلل بسرعة مع تكوين الأكسجين. ومع ذلك ، فإن المعالجة بالأوزون في الماء أغلى من المعالجة بالكلور ؛ بالإضافة إلى ذلك ، لا يمكن نقل الأوزون ويجب إنتاجه في الموقع.
الأوزون في الغلاف الجوي.
لا يوجد الكثير من الأوزون في الغلاف الجوي للأرض - 4 مليارات طن ، أي في المتوسط 1 مجم / م 3 فقط. يزداد تركيز الأوزون مع المسافة من سطح الأرض ويصل إلى الحد الأقصى في الستراتوسفير ، على ارتفاع 20-25 كم - هذه هي "طبقة الأوزون". إذا تم جمع كل الأوزون من الغلاف الجوي بالقرب من سطح الأرض عند الضغط العادي ، فسيتم الحصول على طبقة بسماكة حوالي 2-3 مم فقط. وهذه الكميات الصغيرة من الأوزون في الهواء توفر الحياة على الأرض. يقوم الأوزون بإنشاء "شاشة واقية" لا تسمح لأشعة الشمس فوق البنفسجية القاسية بالوصول إلى سطح الأرض ، والتي تضر بكل الكائنات الحية.
في العقود الأخيرة ، تم إيلاء الكثير من الاهتمام لظهور ما يسمى ب "ثقوب الأوزون" - وهي مناطق ذات محتوى منخفض بشكل كبير من أوزون الستراتوسفير. من خلال مثل هذا الدرع "المتسرب" ، تصل الأشعة فوق البنفسجية الأشد قسوة إلى سطح الأرض. لذلك ، كان العلماء يراقبون الأوزون في الغلاف الجوي لفترة طويلة. في عام 1930 ، اقترح عالم الجيوفيزياء الإنجليزي S. Chapman مخططًا من أربعة تفاعلات لشرح التركيز الثابت للأوزون في الستراتوسفير (تسمى هذه التفاعلات دورة تشابمان ، حيث تعني M أي ذرة أو جزيء يحمل الطاقة الزائدة):
O2 → 2O
O + O + M → O2 + M.
O + O3 → 2O2
O3 → O2 + O.
تكون التفاعلات الأولى والرابعة من هذه الدورة كيميائية ضوئية ، وهي تحت تأثير الإشعاع الشمسي. لتحلل جزيء الأكسجين إلى ذرات ، يلزم إشعاع بطول موجي أقل من 242 نانومتر ، بينما يتحلل الأوزون عند امتصاص الضوء في منطقة 240-320 نانومتر (التفاعل الأخير يحمينا فقط من الأشعة فوق البنفسجية الصلبة ، لأن الأكسجين لا تمتص في هذه المنطقة الطيفية). التفاعلان المتبقيان حراريان ، أي اذهب دون عمل الضوء. من المهم جدًا أن يكون للتفاعل الثالث الذي يؤدي إلى اختفاء الأوزون طاقة تنشيط ؛ هذا يعني أنه يمكن زيادة معدل مثل هذا التفاعل بفعل المحفزات. كما اتضح ، فإن المحفز الرئيسي لانحلال الأوزون هو أكسيد النيتريك NO. يتكون في الغلاف الجوي العلوي من النيتروجين والأكسجين تحت تأثير أشد أشعة الشمس. بمجرد دخوله إلى طبقة الأوزون ، فإنه يدخل في دورة من تفاعلين O3 + NO → NO2 + O2 ، NO2 + O → NO + O2 ، ونتيجة لذلك لا يتغير محتواه في الغلاف الجوي ، وينخفض تركيز الأوزون الثابت. هناك دورات أخرى تؤدي إلى انخفاض محتوى الأوزون في الستراتوسفير ، على سبيل المثال بمشاركة الكلور:
Cl + O3 → ClO + O2
ClO + O → Cl + O2.
كما يتم تدمير الأوزون بسبب الغبار والغازات التي تدخل الغلاف الجوي بكميات كبيرة أثناء الانفجارات البركانية. في الآونة الأخيرة ، تم اقتراح أن الأوزون فعال أيضًا في تدمير الهيدروجين المنبعث من قشرة الأرض. تؤدي مجمل جميع تفاعلات تكوين وتحلل الأوزون إلى حقيقة أن متوسط عمر جزيء الأوزون في الستراتوسفير يبلغ حوالي ثلاث ساعات.
من المفترض أنه بالإضافة إلى العوامل الطبيعية ، هناك أيضًا عوامل اصطناعية تؤثر على طبقة الأوزون. ومن الأمثلة المعروفة الفريونات ، وهي مصادر لذرات الكلور. الفريونات عبارة عن هيدروكربونات يتم فيها استبدال ذرات الهيدروجين بذرات الفلور والكلور. يتم استخدامها في التبريد ولملء علب الهباء الجوي. في النهاية ، تدخل الفريونات في الهواء وترتفع ببطء أعلى وأعلى مع التيارات الهوائية ، لتصل أخيرًا إلى طبقة الأوزون. تتحلل تحت تأثير الإشعاع الشمسي ، وتبدأ الفريونات نفسها في تحلل الأوزون بشكل تحفيزي. لم يُعرف بعد بالضبط إلى أي مدى يقع اللوم على الفريونات في "ثقوب الأوزون" ، ومع ذلك ، فقد تم اتخاذ تدابير منذ فترة طويلة للحد من استخدامها.
تظهر الحسابات أنه في 60-70 سنة يمكن أن ينخفض تركيز الأوزون في الستراتوسفير بنسبة 25٪. وفي الوقت نفسه ، سيزداد تركيز الأوزون في الطبقة السطحية - التروبوسفير ، وهو أمر سيئ أيضًا ، لأن الأوزون ونواتج تحولاته في الهواء سامة. المصدر الرئيسي للأوزون في طبقة التروبوسفير هو انتقال أوزون الستراتوسفير بالكتل الهوائية إلى الطبقات السفلى. يدخل حوالي 1.6 مليار طن إلى طبقة الأوزون الأرضية سنويًا. عمر جزيء الأوزون في الجزء السفلي من الغلاف الجوي أطول بكثير - أكثر من 100 يوم ، حيث يوجد في الطبقة السطحية كثافة أقل من الأشعة فوق البنفسجية الشمسية التي تدمر الأوزون. عادة ، يوجد القليل جدًا من الأوزون في طبقة التروبوسفير: في الهواء النقي النقي ، يبلغ متوسط تركيزه 0.016 ميكروغرام / لتر فقط. لا يعتمد تركيز الأوزون في الهواء على الارتفاع فحسب ، بل يعتمد أيضًا على التضاريس. وبالتالي ، يوجد دائمًا قدر أكبر من الأوزون فوق المحيطات منه فوق اليابسة ، نظرًا لأن الأوزون يتحلل بشكل أبطأ هناك. أظهرت القياسات في سوتشي أن الهواء بالقرب من ساحل البحر يحتوي على أوزون أكثر بنسبة 20٪ مما هو عليه في الغابة على بعد كيلومترين من الساحل.
يتنفس البشر المعاصرون كمية من الأوزون أكثر بكثير من أسلافهم. والسبب الرئيسي لذلك هو زيادة كمية الميثان وأكاسيد النيتروجين في الهواء. وهكذا ، فإن محتوى الميثان في الغلاف الجوي يتزايد باستمرار منذ منتصف القرن التاسع عشر ، عندما بدأ استخدام الغاز الطبيعي. في جو ملوث بأكاسيد النيتروجين ، يدخل الميثان في سلسلة معقدة من التحولات التي تتضمن الأكسجين وبخار الماء ، ويمكن التعبير عن نتيجة ذلك بالمعادلة CH4 + 4O2 → HCHO + H2O + 2O3. يمكن أن تعمل الهيدروكربونات الأخرى أيضًا كميثان ، على سبيل المثال ، تلك الموجودة في غازات عادم السيارات أثناء الاحتراق غير الكامل للبنزين. نتيجة لذلك ، في هواء المدن الكبيرة على مدى العقود الماضية ، زاد تركيز الأوزون عشرة أضعاف.
كان من المعتقد دائمًا أنه خلال العاصفة الرعدية ، يزداد تركيز الأوزون في الهواء بشكل كبير ، حيث يساهم البرق في تحويل الأكسجين إلى أوزون. في الواقع ، الزيادة طفيفة ، ولا تحدث أثناء عاصفة رعدية ، بل قبل عدة ساعات من حدوثها. خلال العاصفة الرعدية ولعدة ساعات بعد ذلك ، ينخفض تركيز الأوزون. ويفسر ذلك حقيقة أنه قبل حدوث عاصفة رعدية ، هناك اختلاط رأسي قوي للكتل الهوائية ، بحيث تأتي كمية إضافية من الأوزون من الطبقات العليا. بالإضافة إلى ذلك ، قبل حدوث عاصفة رعدية ، تزداد شدة المجال الكهربائي ، ويتم تهيئة الظروف لتكوين تفريغ إكليلي عند نقاط أجسام مختلفة ، على سبيل المثال ، أطراف الفروع. كما أنه يساهم في تكوين الأوزون. وبعد ذلك ، مع تطور السحب الرعدية ، تنشأ تيارات هوائية قوية صاعدة تحتها ، مما يقلل محتوى الأوزون مباشرة تحت السحابة.
سؤال مثير للاهتمام حول محتوى الأوزون في هواء الغابات الصنوبرية. على سبيل المثال ، في دورة الكيمياء غير العضوية لجي ريمي ، يمكن للمرء أن يقرأ أن "الهواء المعالج بالأوزون للغابات الصنوبرية" هو خيال. هو كذلك؟ لا يوجد نبات ينبعث منه الأوزون ، بالطبع. لكن النباتات ، وخاصة الصنوبريات ، تنبعث منها الكثير من المركبات العضوية المتطايرة في الهواء ، بما في ذلك الهيدروكربونات غير المشبعة من فئة التربين (يوجد الكثير منها في زيت التربنتين). لذلك ، في يوم حار ، تطلق شجرة الصنوبر 16 ميكروغرامًا من التربينات في الساعة لكل جرام من الوزن الجاف للإبر. تتميز Terpenes ليس فقط بالصنوبريات ، ولكن أيضًا ببعض الأشجار المتساقطة ، من بينها الحور والأوكالبتوس. وبعض الأشجار الاستوائية قادرة على إطلاق 45 ميكروغرامًا من التربينات لكل 1 جرام من كتلة الأوراق الجافة في الساعة. نتيجة لذلك ، يمكن أن يطلق هكتار واحد من الغابات الصنوبرية ما يصل إلى 4 كجم من المواد العضوية يوميًا ، وحوالي 2 كجم من الغابات المتساقطة الأوراق. تبلغ مساحة الغابات على الأرض ملايين الهكتارات ، وكلها تطلق مئات الآلاف من الأطنان من الهيدروكربونات المختلفة ، بما في ذلك التربينات ، سنويًا. والهيدروكربونات كما ظهر في مثال الميثان تحت تأثير الإشعاع الشمسي وفي وجود شوائب أخرى تساهم في تكوين الأوزون. أظهرت التجارب أنه في ظل الظروف المناسبة ، تشارك التربينات بنشاط كبير في دورة التفاعلات الكيميائية الضوئية في الغلاف الجوي مع تكوين الأوزون. لذا فإن الأوزون في الغابة الصنوبرية ليس اختراعًا على الإطلاق ، ولكنه حقيقة تجريبية.
الأوزون والصحة.
يا لها من متعة أن تمشي بعد عاصفة رعدية! الهواء نظيف ومنعش ، ويبدو أن نفثاته المنعشة تتدفق إلى الرئتين دون أي جهد. "إنها تشبه رائحة الأوزون" ، كما يقولون غالبًا في مثل هذه الحالات. "جيد جدًا للصحة." هو كذلك؟
ذات مرة ، كان الأوزون يعتبر بالتأكيد مفيدًا للصحة. ولكن إذا تجاوز تركيزه حدًا معينًا ، فقد يتسبب في الكثير من العواقب غير السارة. اعتمادًا على تركيز ووقت الاستنشاق ، يتسبب الأوزون في حدوث تغيرات في الرئتين ، وتهيج الأغشية المخاطية للعينين والأنف ، والصداع ، والدوخة ، وانخفاض ضغط الدم. الأوزون يقلل من مقاومة الجسم للالتهابات البكتيرية في الجهاز التنفسي. تركيزه الأقصى المسموح به في الهواء هو 0.1 ميكروغرام / لتر فقط ، مما يعني أن الأوزون أخطر بكثير من الكلور! إذا كنت تقضي عدة ساعات في الداخل مع تركيز الأوزون البالغ 0.4 ميكروغرام / لتر فقط ، فقد تظهر آلام في الصدر ، وسعال ، وأرق ، وتقل حدة البصر. إذا استنشقت الأوزون لفترة طويلة بتركيز يزيد عن 2 ميكروغرام / لتر ، فقد تكون العواقب أكثر خطورة - تصل إلى الذهول وانخفاض نشاط القلب. مع محتوى الأوزون من 8-9 ميكروغرام / لتر ، تحدث الوذمة الرئوية بعد بضع ساعات ، وهي محفوفة بالموت. لكن عادة ما يصعب تحليل مثل هذه الكميات الضئيلة من مادة بالطرق الكيميائية التقليدية. لحسن الحظ ، يشعر الشخص بوجود الأوزون حتى بتركيزات منخفضة جدًا - حوالي 1 ميكروغرام / لتر ، حيث لن يتحول ورق اليود النشوي إلى اللون الأزرق. بالنسبة لبعض الناس ، تشبه رائحة الأوزون بتركيزات صغيرة رائحة الكلور ، بالنسبة للآخرين - ثاني أكسيد الكبريت ، بالنسبة للآخرين - الثوم.
ليس الأوزون نفسه سامًا فقط. مع مشاركته في الهواء ، على سبيل المثال ، يتم تكوين نترات البيروكسي أسيتيل (PAN) CH3-CO-OONO2 - مادة لها تأثير قوي ، بما في ذلك المسيل للدموع ، مما يجعل التنفس صعبًا ، وفي التركيزات العالية تسبب شلل القلب. PAN هو أحد مكونات ما يسمى بالضباب الكيميائي الضوئي الذي يتكون في الصيف في هواء ملوث (هذه الكلمة مشتقة من الدخان الإنجليزي - الدخان والضباب - الضباب). يمكن أن يصل تركيز الأوزون في الضباب الدخاني إلى 2 ميكروغرام / لتر ، وهو ما يزيد 20 مرة عن الحد الأقصى المسموح به. يجب أيضًا مراعاة أن التأثير المشترك لأكاسيد الأوزون والنيتروجين في الهواء أقوى بعشر مرات من كل مادة على حدة. ليس من المستغرب أن تكون عواقب مثل هذا الضباب الدخاني في المدن الكبيرة كارثية ، خاصة إذا لم يكن الهواء فوق المدينة منفوخًا بـ "المسودات" وتشكلت منطقة راكدة. لذلك ، في لندن عام 1952 ، مات أكثر من 4000 شخص بسبب الضباب الدخاني في غضون أيام قليلة. تسبب الضباب الدخاني في نيويورك عام 1963 في مقتل 350 شخصًا. كانت قصص مماثلة في طوكيو والمدن الكبرى الأخرى. ليس فقط الناس يعانون من الأوزون الجوي. أظهر الباحثون الأمريكيون ، على سبيل المثال ، أنه في المناطق التي تحتوي على نسبة عالية من الأوزون في الهواء ، يتم تقليل عمر خدمة إطارات السيارات ومنتجات المطاط الأخرى بشكل كبير.
كيف تقلل من محتوى الأوزون في طبقة الأرض؟ إن تقليل انبعاثات الميثان في الغلاف الجوي ليس بالأمر الواقعي. لا تزال هناك طريقة أخرى - لتقليل انبعاثات أكاسيد النيتروجين ، والتي بدونها لا يمكن لدورة التفاعلات المؤدية إلى الأوزون أن تستمر. هذا المسار ليس سهلاً أيضًا ، لأن أكاسيد النيتروجين لا تنبعث فقط من السيارات ، ولكن أيضًا (بشكل أساسي) عن طريق محطات الطاقة الحرارية.
مصادر الأوزون ليست فقط في الشارع. يتم تشكيلها في غرف الأشعة السينية ، في غرف العلاج الطبيعي (مصدرها مصابيح الزئبق الكوارتز) ، أثناء تشغيل آلات التصوير (آلات التصوير) ، طابعات الليزر (هنا سبب تكوينها هو تفريغ عالي الجهد). الأوزون هو رفيق لا مفر منه لإنتاج بيرهيدرول ، لحام الأرغون القوسي. لتقليل الآثار الضارة للأوزون ، من الضروري تجهيز غطاء المحرك بمصابيح الأشعة فوق البنفسجية ، والتهوية الجيدة للغرفة.
ومع ذلك ، فمن غير الصحيح اعتبار الأوزون ضارًا بشكل غير مشروط بالصحة. كل هذا يتوقف على تركيزه. أظهرت الدراسات أن الهواء النقي يضيء بشكل ضعيف جدًا في الظلام. سبب التوهج هو تفاعلات الأكسدة بمشاركة الأوزون. لوحظ الوهج أيضًا عندما تم اهتزاز الماء في دورق ، حيث تم ملء الأكسجين المعالج بالأوزون بشكل أولي. يرتبط هذا التوهج دائمًا بوجود كميات صغيرة من الشوائب العضوية في الهواء أو الماء. عند مزج الهواء النقي مع الزفير ، زادت شدة التوهج عشرة أضعاف! وهذا ليس مفاجئًا: تم العثور على شوائب دقيقة من الإيثيلين والبنزين والأسيتالديهيد والفورمالديهايد والأسيتون وحمض الفورميك في هواء الزفير. يتم "تسليط الضوء عليها" بواسطة الأوزون. في نفس الوقت ، "قديم" ، أي خالية تمامًا من الأوزون ، على الرغم من أنها نظيفة جدًا ، إلا أن الهواء لا يسبب وهجًا ، ويشعر الشخص بأنه "قديم". يمكن مقارنة هذا الهواء بالماء المقطر: فهو نقي جدًا ، ولا يحتوي عمليًا على شوائب ، وشربه ضار. لذا فإن الغياب التام للأوزون في الهواء ، على ما يبدو ، هو أيضًا غير موات للبشر ، لأنه يزيد من محتوى الكائنات الحية الدقيقة فيه ، ويؤدي إلى تراكم المواد الضارة والروائح الكريهة التي تدمر الأوزون. وبالتالي ، تتضح الحاجة إلى تهوية منتظمة وطويلة المدى للمباني ، حتى لو لم يكن هناك أشخاص فيها: بعد كل شيء ، فإن الأوزون الذي دخل الغرفة لا يبقى فيه لفترة طويلة - إنه يتحلل جزئيًا ، ويستقر إلى حد كبير (يمتص) على الجدران والأسطح الأخرى. من الصعب تحديد كمية الأوزون في الغرفة. ومع ذلك ، في الحد الأدنى من التركيزات ، قد يكون الأوزون ضروريًا ومفيدًا.
ايليا لينسون