الألدهيدات وخصائصها الكيميائية
الألدهيدات هي تلك المواد العضوية التي تحتوي جزيئاتها على مجموعة كربونيل مرتبطة بذرة هيدروجين واحدة على الأقل وجذر هيدروكربوني.
يتم تحديد الخصائص الكيميائية للألدهيدات مسبقًا في جزيئاتها من خلال وجود مجموعة الكربونيل. في هذا الصدد ، يمكن ملاحظة تفاعلات الإضافة في جزيء مجموعة الكاربونيل.
لذلك ، على سبيل المثال ، إذا قمت بأخذ بخار الفورمالديهايد ومررته مع الهيدروجين فوق محفز نيكل مسخن ، فسيتم إضافة الهيدروجين وسيتم تحويل الفورمالديهايد إلى كحول ميثيل. بالإضافة إلى ذلك ، فإن الطبيعة القطبية لهذه الرابطة تؤدي أيضًا إلى حدوث تفاعل من الألدهيدات مثل إضافة الماء.
والآن دعونا نلقي نظرة على كل سمات التفاعلات الناتجة عن إضافة الماء. وتجدر الإشارة إلى أن مجموعة الهيدروكسيل تضاف إلى ذرة الكربون في مجموعة الكاربونيل ، والتي تحمل شحنة موجبة جزئية بسبب زوج الإلكترون لذرة الأكسجين.

مع هذه الإضافة ، تكون التفاعلات التالية مميزة:
أولاً ، تحدث الهدرجة وتتشكل الكحولات الأولية RCH2OH.
ثانيًا ، يتم إضافة الكحوليات وتشكيل نصفي R-CH (OH) - أو. وفي وجود كلوريد الهيدروجين حمض الهيدروكلوريك ، الذي يعمل كمحفز ، ومع وجود فائض من الكحول ، نلاحظ تكوين الأسيتال RCH (OR) 2 ؛
ثالثًا ، يضاف هيدرو كبريتيت الصوديوم NaHSO3 وتتشكل مشتقات ألدهيدات هيدروسلفيت. أثناء أكسدة الألدهيدات ، يمكن للمرء أن يلاحظ تفاعلات خاصة مثل التفاعل مع محلول الأمونيا من أكسيد الفضة (I) ومع هيدروكسيد النحاس (II) وتكوين الأحماض الكربوكسيلية.
تتميز بلمرة الألدهيدات بتفاعلات خاصة مثل البلمرة الخطية والدائرية.
إذا تحدث عنها الخواص الكيميائيةآه الألدهيدات ، يجب أن نذكر أيضًا تفاعل الأكسدة. تتضمن هذه التفاعلات تفاعل "المرآة الفضية" ورد فعل إشارة المرور.
يمكنك ملاحظة رد الفعل غير المعتاد لـ "المرآة الفضية" من خلال الاحتفاظ بها في الفصل تجربة مثيرة للاهتمام. للقيام بذلك ، تحتاج إلى أنبوب اختبار مغسول جيدًا ، حيث يجب أن تصب فيه بضع مليلتر من محلول الأمونيا من أكسيد الفضة ، ثم أضف أربع أو خمس قطرات من الفورمالين إليه. الخطوة التالية في هذه التجربة هي وضع أنبوب الاختبار في دورق به ماء ساخنوبعد ذلك يمكنك أن ترى كيف تظهر طبقة لامعة على جدران أنبوب الاختبار. هذا الطلاء الناتج هو راسب من الفضة المعدنية.

وهنا ما يسمى برد فعل "إشارة المرور":

الخصائص الفيزيائية للألدهيدات
لنبدأ الآن في النظر إلى الخصائص الفيزيائية للألدهيدات. ما هي خصائص هذه المواد؟ وتجدر الإشارة إلى أن عددًا من الألدهيدات البسيطة عبارة عن غازات عديمة اللون ، والأكثر تعقيدًا تكون على شكل سائل ، ولكن الألدهيدات الأعلى هي مواد صلبة. كلما زاد الوزن الجزيئي للألدهيدات ، زادت نقطة الغليان. لذلك ، على سبيل المثال ، يصل propionaldehyde إلى نقطة غليان عند 48.8 درجة ، لكن كحول البروبيل يغلي عند 97.8 درجة مئوية.
إذا تحدثنا عن كثافة الألدهيدات ، فعندئذ أقل من واحد. على سبيل المثال ، تميل ألدهيد الخل والفورميك إلى الذوبان جيدًا في الماء ، في حين أن الألدهيدات الأكثر تعقيدًا لديها قدرة أضعف على الذوبان.
الألدهيدات ، التي تنتمي إلى أدنى فئة ، لها نسبة حادة و رائحة كريهة، والصلبة وغير القابلة للذوبان في الماء ، على العكس من ذلك ، تتميز برائحة الأزهار اللطيفة.
إيجاد الألدهيدات في الطبيعة
في الطبيعة ، يوجد ممثلو مجموعات مختلفة من الألدهيدات في كل مكان. هم موجودون في الأجزاء الخضراء من النباتات. هذه واحدة من أبسط مجموعات الألدهيدات ، والتي تشمل الفورميك ألدهيد CH2O.
هناك أيضًا ألدهيدات ذات تركيبة أكثر تعقيدًا. هذه الأنواع تشمل الفانيلين أو سكر العنب.
ولكن نظرًا لأن الألدهيدات لديها القدرة على الدخول بسهولة في جميع أنواع التفاعلات ، فإنها تميل إلى الأكسدة والتقليل ، ويمكن القول بثقة أن الألدهيدات قادرة جدًا على التفاعلات المختلفة وبالتالي في شكل نقيهم نادرون للغاية. ولكن يمكن العثور على مشتقاتها في كل مكان ، سواء في البيئة النباتية أو الحيوانية.

تطبيق الألدهيدات
توجد مجموعة الألدهيد في عدد من المواد الطبيعية. هم السمة المميزة، على الأقل الكثير منهم ، هي الرائحة. لذلك ، على سبيل المثال ، يمتلك ممثلو الألدهيدات الأعلى روائح مختلفة ويشكلون جزءًا من الزيوت الأساسية. حسنًا ، كما تعلم بالفعل ، توجد هذه الزيوت في النباتات الزهرية والحارة والعطرة والفواكه والفواكه. لقد وجدوا استخدامًا واسع النطاق في تصنيع السلع الصناعية وفي صناعة العطور.
يمكن العثور على الألدهيد الأليفاتي CH3 (CH2) 7C (H) = O في الزيوت الأساسية للحمضيات. هذه الألدهيدات لها رائحة برتقالية وتستخدم في الصناعات الغذائية، كعامل منكه ، وكذلك في مستحضرات التجميل والعطور والمواد الكيميائية المنزلية ، كعطر.
ألدهيد الفورميك هو غاز عديم اللون له رائحة نفاذة وقابلة للذوبان في الماء بسهولة. يسمى هذا المحلول المائي من الفورمالين أيضًا بالفورمالين. الفورمالديهايد مادة شديدة السمية ، لكنها تستخدم في الطب في صورة مخففة كمطهر. يستخدم لتطهير الأدوات ومحلولها الضعيف لغسل الجلد بالتعرق الشديد.
بالإضافة إلى ذلك ، يستخدم الفورمالديهايد في دباغة الجلود ، حيث يتمتع بقدرة على الاندماج مع المواد البروتينية الموجودة في الجلد.
في الزراعةأثبت الفورمالديهايد نفسه في معالجة الحبوب قبل البذر. يتم استخدامه لإنتاج المواد البلاستيكية الضرورية جدًا للتكنولوجيا والاحتياجات المحلية.
ألدهيد الخل هو سائل عديم اللون له رائحة التفاح الفاسد وقابل للذوبان في الماء بسهولة. يتم استخدامه لإنتاج حامض الخليك ومواد أخرى. ولكن منذ ذلك الحين مادة سامةيمكن أن يسبب تسمم الجسم أو التهاب الأغشية المخاطية للعينين والجهاز التنفسي.
الأدوية العضوية
ندرس الأدوية مقسمة إلى مجموعات حسب التصنيف الكيميائي. ميزة هذا التصنيف هي القدرة على تحديد ودراسة الأنماط العامة في تطوير طرق الحصول على الأدوية التي تشكل مجموعة ، وطرق التحليل الصيدلاني على أساس الخواص الفيزيائية والكيميائية للمواد ، وإقامة علاقة بين التركيب الكيميائي و العمل الدوائي.
تنقسم جميع الأدوية إلى مواد عضوية وغير عضوية. يتم تصنيف المواد غير العضوية ، بدورها ، وفقًا لموضع العناصر في PS. وتنقسم العناصر العضوية إلى مشتقات السلاسل الأليفاتية ، والأليفية الحلقية ، والعطرية ، وغير المتجانسة الحلقية ، وكل منها مقسم إلى فئات: الهيدروكربونات ، ومشتقات الهالوجين من الهيدروكربونات ، والكحولات ، والألدهيدات ، والكيتونات ، والأحماض ، والإيثرات ، والبسيطة والمعقدة ، إلخ.
المركبات ALIPHATIC AS HP.
محضرات الألدهيدات ومشتقاتها. الكربوهيدرات
الألدهيدات
تشمل هذه المجموعة من المركبات المواد الطبية العضوية التي تحتوي على مجموعة الألدهيد ، أو مشتقاتها الوظيفية.
الصيغة العامة:
الخصائص الدوائية
إن إدخال مجموعة ألدهيد في بنية مركب عضوي يعطيها تأثيرًا مخدرًا ومطهرًا. في هذا ، يشبه عمل الألدهيدات عمل الكحول. ولكن على عكس الكحول ، تعزز مجموعة الألدهيد سمية المركب.
العوامل المؤثرة في التركيب على العمل الدوائي :
يزيد استطالة جذر الألكيل من النشاط ، ولكن في نفس الوقت تزداد السمية ؛
إدخال رابطة غير مشبعة والهالوجينات لها نفس التأثير ؛
يؤدي تكوين الشكل الرطب للألدهيد إلى انخفاض في السمية. لكن القدرة على تكوين شكل رطب ثابت تتجلى فقط في مشتقات الكلور من الألدهيدات. لذلك ، الفورمالديهايد هو سم بروتوبلازمي ، ويستخدم للتطهير ، ولا يتم استخدام الأسيتالديهيد والكلورال في الطب بسبب سميتهم العالية ، وهيدرات الكلورال دواء يستخدم كمهدئ ومنوم.
نمت قوة التأثير المخدر (الدوائي) والسمية من الفورمالديهايد إلى الأسيتالديهيد والكلورال. يمكن أن يؤدي تكوين شكل رطب (هيدرات الكلورال) إلى تقليل السمية بشكل كبير ، مع الحفاظ على التأثير الدوائي.
حسب الحالة الماديةيمكن أن تكون الألدهيدات الغازية (الوزن الجزيئي المنخفض) والسوائل والمواد الصلبة. الوزن الجزيئي المنخفض له رائحة كريهة حادة ، ووزن جزيئي مرتفع - زهر لطيف.
الخواص الكيميائية
من الناحية الكيميائية ، هذه مواد شديدة التفاعل ، بسبب وجود مجموعة كربونيل في جزيءها.
يتم تفسير التفاعل العالي للألدهيدات من خلال:
أ) وجود رابطة مزدوجة مستقطبة
ب) عزم ثنائي القطب من الكربونيل
ج) وجود شحنة موجبة جزئية على ذرة الكربون للكربونيل
σ -
σ + ح
الرابطة المزدوجة بين C و O ، على عكس الرابطة المزدوجة بين ذرتي كربون ، مستقطبة بشدة ، لأن الأكسجين له كهرسلبية أعلى بكثير من الكربون ، وتتحول كثافة الإلكترون للرابطة نحو الأكسجين. يحدد هذا الاستقطاب العالي الخواص الكهربية لكربون مجموعة الكربونيل وقدرته على التفاعل مع المركبات المحبة للنواة (للدخول في تفاعلات الإضافة المحبة للنواة). يحتوي الأكسجين في المجموعة على خصائص محبة للنواة.
الأكسدة وتفاعلات الإضافة المحبة للأكسدة مميزة
1. تفاعلات الأكسدة.
الألدهيداتبسهولة تتأكسد. أكسدة الألدهيدات إلى أحماضيحدث تحت التأثير مدى قوةوعوامل مؤكسدة ضعيفة .
يتم تقليل العديد من المعادن - الفضة والزئبق والبزموت والنحاس - من محاليل أملاحها ، خاصة في وجود القلويات. وهذا ما يميز الألدهيدات عن غيرها مركبات العضوية، قادرة على الأكسدة - الكحولات ، المركبات غير المشبعة ، التي تتطلب أكسدة أقوى عوامل مؤكسدة. لذلك ، يمكن استخدام تفاعلات أكسدة الألدهيدات مع كاتيونات معقدة من الزئبق والنحاس والفضة في وسط قلوي لإثبات صحة الألدهيدات.
أنا. 1 .رد فعلبمحلول الأمونيا من نترات الفضة (تفاعل المرآة الفضية) موصى به من قبل FS لتأكيد أصالة المواد مع مجموعة الألدهيد ، والأساس هو أكسدة الألدهيد إلى حمض وتقليل Ag + إلى Ag ↓.
AgNO 3 + 2NH 4 OH → NO 3 + 2H 2 O
NSON+ 2NO 3 + H 2 O → HCOONH 4 + 2Ag ↓ + 2NH 4 NO 3 + NH 3
يتأكسد الفورمالديهايد إلى ملح الأمونيوم لحمض الفورميك ، ويقلل من الفضة المعدنية ، التي تترسبعلى جدران أنبوب الاختبار لوحة رائعة "المرايا" أو الرواسب الرمادية.

أنا. 2. رد فعلمع كاشف فيلينج (مركب مركب من النحاس (II) مع ملح البوتاسيوم والصوديوم لحمض الطرطريك). تقلل الألدهيدات مركب النحاس (II) إلى أكسيد النحاس (I) ، يتكون راسب من الطوب الأحمر.أعد قبل الاستخدام).
كاشف القطع 1 - محلول CuSO 4
كاشف القطع 2 - أفضل ضاحية للمهنيين واحدملح البوتاسيوم والصوديوم لحمض الطرطريك
عند خلط 1: 1 قطع الكواشف 1 و 2 يتكون مركب مركب من النحاس الأزرق (ثانيًا) مع ملح الصوديوم والبوتاسيوم لحمض الطرطريك:

تلطيخ أزرق
عند إضافة الألدهيد وتسخينه ، يختفي اللون الأزرق للكاشف ، يتشكل منتج وسيط - راسب أصفر من هيدروكسيد النحاس (I) ، والذي يتحلل على الفور إلى راسب أحمر من أكسيد النحاس (I) والماء.
2KNa + ص- COH+ 2NaOH + 2KOH → ص- كونا+ 4KNaC4H4O6 + 2 كوه ↓ + H2O
2 كوه ↓ →النحاس 2 ا ↓ + H2O
الأصفر يعجل الطوب الأحمر مترسب

الكتب المدرسية لها مخطط رد فعل عام مختلف
أنا. 3. رد فعلمع كاشف نيسلر (محلول قلوي من رباعي كلوريد الكيراتين (II) البوتاسيوم). يقلل الفورمالديهايد أيون الزئبق إلى زئبق معدني - راسب رمادي غامق.
R-COH + K 2 + 3KOH → R-COOK + 4KI + زئبق↓ + 2H2O
ما هي الألدهيدات على أي حال؟ الإجابة على هذا السؤال ليست بالبساطة التي قد تبدو للوهلة الأولى. اسأل أحد محبي العطور ذوي الخبرة عن هذا - على الأرجح سيخبرك عن المواد الاصطناعية ذات الرائحة التي لا توصف والتي جعلت العطر غير عادي وتجريدي ومبتكر.
الكيميائي أو حتى طالب عادي في الصف الحادي عشر يحضر بانتظام فصول الكيمياء لن يفكر كثيرًا ويقول إن الألدهيدات هي فئة من المركبات العضوية تحتوي على مجموعة -CHO، والتي تسمى مجموعة الألدهيد. جميع الألدهيدات لها خصائص كيميائية شائعة ، مثل أن تتأكسد بسهولة لتكوين الأحماض المقابلة. هذا هو أساس تفاعل المرآة الفضية - تذكر عندما يتم تسخين أنبوب الاختبار وتظهر طبقة معدنية لامعة على سطح الزجاج. كلمة "ألدهيد" ، التي ابتكرها الكيميائي الألماني يوستاس فون ليبيج ، هي اختصار نازعة هيدروجين الكحول ،مما يعني " كحول بدون هيدروجين».
في الأسماء التافهة للألدهيدات غالبًا * (انظر الحاشية) إما كلمة "ألدهيد" نفسها موجودة ، أو لاحقة -AL ، على سبيل المثال ، "زلابية ألدهيد" ، "زابالدهيد" ، "بوكيرغال". مواد مثل الفانيلين والهيليوتروبين هي أيضًا ألدهيدات من وجهة نظر كيميائية. بشكل عام ، يحتوي صانع العطور على كمية هائلة من الألدهيدات برائحة مختلفة تمامًا في ترسانته: البطيخرائحته مثل البطيخ أدوكسالتنبعث منه رائحة البحر و بياض البيضة, السترونلال- عشب الليمون، ليرال- زنبق الوادي ثلاثة أضعاف - عشب اخضر. هناك سيكلامين ألدهيد ، سينامالديهيد ، يانسون ، كوميك ، يوسفي.
حسنًا ، تسأل ، ما علاقة شانيل بذلك؟ إذا كان هناك الكثير من الألدهيدات وكانت رائحتها جميعًا مختلفة ، فما هي "نوتة الألدهيد" هذه ، وما هي رائحتها وما هي الألدهيدات المحددة الموجودة في شانيل رقم 5؟ تذكر "حكايات من حياة بوشكين لخرمز": "وقع بوشكين في حب جوكوفسكي وبدأ يناديه بطريقة ودية جوكوف"؟ غالبًا ما يطلق العطارون بطريقة ودية الألدهيدات ، في الواقع ، نوعًا من الأنواع الفرعية و حالة خاصة: الأليفاتية المشبعة أو ما يسمى الألدهيدات الدهنية. عادة ما يتم تسميتها بعد عدد ذرات الكربون في الجزيء. في "ألدهيد C-7" ، أو هيبتانال، - سبع ذرات كربون في "الألدهيد C-10" ، عشري، كما قد تتخيل ، عشرة.
يحتوي عطر شانيل رقم 5 على مزيج من الألدهيدات " C-11 undecylic "أو "S-110"(غير قانوني) ، "C-11 undecylenic"(10-undecenal) و S-12(دوديكانال). الجدير بالذكر أن الألدهيدات ظهرت في تركيبة العطور قبل فترة طويلة من ظهور هذا العطر الأسطوري [ صدر شانيل رقم 5 في عام 1921]. يتفق العديد من مؤرخي العطور على أن الألدهيدات قد استخدمت لأول مرة في إنشاء ، أو بالأحرى ، إعادة إصدارها عام 1905 ، من قبل صانع العطور بيير أرميجينت. توجد الألدهيدات في كل من (1912) و Bouquet de Catherine (1913) من قبل مصنع موسكو Alphonse Rallet & Co ، الذي تم إنشاؤه ، مثل Chanel No. 5 ، بواسطة صانع العطور Ernest Bo (بالمناسبة ، من سكان موسكو الأصليين). لكن شانيل هي التي أصبحت بلا شك العطر الرئيسي للألدهيد في جميع الأوقات والشعوب ، مما أدى إلى ظهور عدد كبير من النسخ المقلدة والنسخ.

تتحد الألدهيدات الدهنية برائحة شمعية مميزة تشبه رائحة الشمعة المنفوخة (في الواقع ، رائحة الشمعة هذه ناتجة عن الألدهيدات الدهنية والمنتجات احتراق غير كاملالبارافين). رائحة الألدهيدات الدهنية شديدة وحادة للغاية ، وتصبح لطيفة عند تخفيفها إلى 1٪ أو أقل. رائحة الديكانال (C-10) لها لمسة من الحماس ، ورائحة الألدهيد C-12 لها فروق دقيقة من الزنابق والبنفسج. في أبسط الألدهيدات ، الفورمالديهايد والأسيتالديهيد ، تكون الرائحة حادة للغاية وغير سارة إلى حد ما (ومع ذلك ، يستخدم خبراء النكهات حتى الأسيتالديهيد ويتم تضمينه في بعض إضافات النكهة) ، في hexanal (C-6 aldehyde) يمكن للمرء أن يميز بالفعل اللون الأخضر اللطيف نسبيًا وجوانب التفاح. الألدهيدات الدهنية ، التي تحتوي على 15 ذرة كربون أو أكثر في السلسلة ، عديمة الرائحة تقريبًا.
رائحة الألدهيدات الدهنية لها رائحة أخرى الملكية المشتركة- نوع من "الصابون". لطالما استخدمت الألدهيدات بنشاط في عطور الصابون نظرًا لتكلفتها المنخفضة وكثافة الرائحة وقدرتها على إخفاء روائح قاعدة الصابون الكريهة جيدًا. غالبًا ما ترتبط رائحة الألدهيد بالنظافة المجردة أو الشعور بالكي حديثًا.

اخر نقطة مهمة، الأمر الذي يستحق الاهتمام بشكل خاص - الألدهيدات ليست شيئًا مصطنعًا ، نتيجة العمل البشري. تم العثور على الكثير منهم على نطاق واسع في الطبيعة. ديكانال ، على سبيل المثال ، يوجد في الزيوت الأساسية للحمضيات (حتى 4٪ برتقالية!) ، الصنوبرية والعديد من النباتات المزهرة ، يوجد الكثير منها في زيت اساسيكسبرة. الألدهيدات الأليفاتية غير المشبعة موجودة أيضًا في كل مكان بطبيعتها ، ولها رائحة أكثر كثافة ، على سبيل المثال ، (E) -2-decenal مسؤول عن الرائحة المميزة للكزبرة ، وغالبًا ما تكون موجودة في " أسلحة كيميائية»البق ، ومشتق الإيبوكسي ، trans-4،5-epoxy- (E) -2-decenal ، يتسبب في الرائحة المميزة للدم ، مما يعطيها مظهرًا معدنيًا واضحًا. برائحة هذه المادة تتعقب الحيوانات المفترسة فرائسها.
في أعقاب نجاح أول عطور الأزهار والألدهيد ، عمل الكيميائيون بلا كلل لتصنيع مواد جديدة بخصائص شمية مماثلة. في عام 1905 ، قام الفرنسيان إي. عمل مماثلاثنان من الكيميائيين الروس أ. جوكوف وبي. شيستاكوف (ZhRHO 40 ، 830 ، 1908). كان لهذا المركب رائحة مثيرة للاهتمام ، تذكرنا برائحة الخوخ الناضج الذي يتم تسخينه في الشمس - فاكهي ، شمعي وقشدي جوز الهند إلى حد ما.
قرر المصنعون بيع هذه المادة تحت اسم "Aldehyde C-14" من أجل إرضاء عطش العطارين إلى "الألدهيدات الجديدة ذات الأرقام" من ناحية ، ومن ناحية أخرى لتضليل المنافسين ، لأنه في الواقع من من وجهة نظر كيميائية ، لم يكن ألدهيد ، ولكن لاكتون (إستر دوري) ، والذرات في جزيء هذا المركب ليست 14 ، ولكن 11. كما هو الحال في مزحة ، "ليس في الشطرنج ، ولكن في التفضيل ، لم أفز ، لكنني خسرت ".

ظهر ما يسمى بـ "Aldehyde C-14" لأول مرة في Guerlain Mitsouko بنجاح كبير في عام 1919 ، وبعد ذلك بقليل ، ظهرت مواد جديدة مماثلة: "aldehyde C-16 (Strawberry)" ، "aldehyde C-18 (جوز الهند) "،" ألدهيد C-20 (قرمزي) "وبعض الآخرين. لذلك اتضح ، من ناحية ، أن كل مادة عطرية تقريبًا هي ألدهيد ، ومن ناحية أخرى ، بعض أهم الألدهيدات ليست ألدهيدات على الإطلاق.
* يستخدم الكيميائيون عدة أنواع من الأسماء. النوع الأول منهجي أو تسمية. اسم التسمية هو نوع من التشفير ، خوارزمية ، بفضلها يمكن إعادة تكوين بنية المادة ، أي لفهم الذرات وكيف ترتبط داخل الجزيء. يتوافق كل اسم مع بنية واحدة والعكس صحيح - لكل مادة هناك اسم تسمية واحد فقط. يجب أن تحمل الألدهيدات ، وفقًا للتسمية ، اللاحقة "al". العيب الوحيد ، ولكن المهم للغاية لهذه الأسماء هو ضخامتها. على سبيل المثال ، يجب تسمية iso e super الذي تمت مناقشته في المرة الأخيرة ، وفقًا لقواعد التسمية ، "1- (1،2،3،4،5،6،7،8-octahydro-2،3،8،8 ، - رباعي ميثيل - 2 - نافثيل) إيثانون - 1 ". من الصعب تخيل ما يمكن أن تتحول إليه الحياة اليومية للمختبرات إذا استخدم الكيميائيون أسماء المصطلحات فقط ("فاسيلي ، من فضلك مرر هذه القارورة باستخدام cis-3-dimethylmethoxy ...").
لهذا السبب ، غالبًا ما يتم استخدام الأسماء البسيطة. الاسم التافه هو ، كما كان ، لقب ، لقب لمادة. لا يخبرنا أي شيء عن الهيكل والهيكل ، لكنه قصير ولا يُنسى. فانيلين ، ديكلوروفوس ، بروميدول ، بارابين - هذه كلها أسماء تافهة. قد تنتج شركات مختلفة نفس المركب تحت أسماء مختلفة، وعادة ما تسمى هذه الأسماء علامات تجارية. 2 حمض أسيتيل أوكسي بنزويك هو اسم التسمية ، حمض أسيتيل الساليسيليكأمر تافه ، والأسبرين علامة تجارية. يحب مصنعو العطور الاصطناعية إعطاء موادهم أسماء مشرقة ورنانة. غالبًا ما تتم تسمية الألدهيدات (من وجهة نظر كيميائية) بلاحقة "al" في النهاية. ولكن معرفة حب العطارين للألدهيدات ، في بعض الأحيان يتم إعطاء الأسماء التي تحتوي على "al" للمواد التي هي شيء مختلف تمامًا. على سبيل المثال ، Clonal ، منتج من IFF ، هو في الواقع نيتريل ، و Mystikal ، مادة أسيرة من Givaudan ، هو حمض الكربوكسيل. أساسا نفس الحيلة كما هو الحال مع "الألدهيد C-14".
المركبات التي تحتوي على الأكسجين
مركبات الكربونيل
الديهايد و
المركبات العضوية التي تحتوي جزيئاتها على مجموعة كاربونيلتسمى مركبات الكربونيل. اعتمادًا على طبيعة البدائل المرتبطة بمجموعة الكربونيل ، يتم تقسيم مركبات الكربونيل إلى ألدهيدات وكيتونات وأحماض كربوكسيلية ومشتقاتها الوظيفية.
الديهايد
الألدهيدات هي مركبات عضوية تحتوي على مجموعة كربونيل حيث ترتبط ذرة كربون بجذر وذرة هيدروجين واحدة ، أي الصيغة العامة للألدهيدات. استثناء هو الفورميك ألدهيد.حيث ، كما يمكن رؤيته ،ص= ح.
ايزومرية
تتميز الألدهيدات بتشابه الجذور الهيدروكربونية ، والتي يمكن أن تحتوي على سلسلة عادية (غير متفرعة) وسلسلة متفرعة ، بالإضافة إلى تزاوج بين الطبقات مع الكيتونات.فمثلا ،
|
ا |
ا |
ا |
|
|
ألدهيد الزبد |
متساوي |
ميثيل إيثيل كيتون أو |
|
إيصال
1.
أكثر الطرق شيوعًا للحصول على الألدهيدات هي الأكسدة ونزع الهيدروجين التحفيزي للكحولات الأولية.
أ) أكسدة الكحوليات الأولية.
كما يتضح ، تتشكل الأحماض عند المزيد من الأكسدة. تم إعطاء هذه التفاعلات بالفعل عند النظر في الخصائص الكيميائية للكحول.
ب) نزع الهيدروجين من الكحولات الأولية. يتم إجراء التفاعل عن طريق تمرير بخار الكحول على درجة حرارة 200-300° مع محفز يستخدم النحاس والنيكل والكوبالت ، إلخ.
2. تم تطوير طريقة لإنتاج الأسيتالديهيد عن طريق أكسدة الإيثيلين مع الأكسجين الجوي في وجود أملاح النحاس والبلاديوم.
3. يتم الحصول على ألدهيد الخليك عن طريق ترطيب الأسيتيلين وفقًا لتفاعل كوتشيروف.
|
ا |
||
|
HC º CH + H 2 O –– HgSO 4 ® – ® CH 3 –C |
||
|
|
أنا |
تمت دراسة تفاعل كوتشيروف بالتفصيل عند دراسة الخواص الكيميائية للهيدروكربونات الأسيتيلنية.
4. يتم الحصول على الألدهيدات عن طريق التحلل المائي لمشتقات الهيدروكربونات ثنائي الهالوجين ، ولكن فقط تلك التي توجد فيها ذرتا الهالوجين في إحدى ذرات الكربون الطرفية.
|
CH 3 -CH 2 - |
2H 2 O ® + 2 HCl |
|||
|
1،1-ثنائي كلورو بروبان |
1،1-بروبانديول |
|||
عندما يعمل الماء على ثنائي ألكيل في وسط قلوي أو حمضي ، يمر تفاعل التحلل المائي الخاص به خلال مرحلة تكوين كحول ثنائي الهيدروكسيل يحتوي على مجموعتين من الهيدروكسيل عند ذرة كربون واحدة.
هذه الكحوليات ، بسبب عدم استقرارها في وقت التكوين ، تفقد الماء وتشكل الألدهيدات.
الخصائص الفيزيائية
أبسط ألدهيدشكلية - غاز ذو رائحة نفاذة جدا. الألدهيدات السفلية الأخرى هي سوائل قابلة للذوبان في الماء بسهولة. للألدهيدات رائحة خانقة ، والتي ، مع التخفيف المتكرر ، تصبح لطيفة ، تذكرنا برائحة الفاكهة. تغلي الألدهيدات عند درجة حرارة أقل من الكحول الذي يحتوي على نفس عدد ذرات الكربون. هو - هيج بسبب عدم وجود روابط هيدروجينية في الألدهيدات. في الوقت نفسه ، تكون نقطة غليان الألدهيدات أعلى من نقطة غليان الهيدروكربونات المقابلة في الوزن الجزيئي ، والذي يرتبط بارتفاع قطبية الألدهيدات.
الخصائص الفيزيائيةيتم عرض بعض الألدهيدات في الجدول.
الطاولة . الخصائص الفيزيائية لبعض الألدهيدات
|
اسم |
معادلة |
t ° الغليان ، |
ر ° مربع ، |
د 4 20 |
|
فورميك |
ا |
92,0 |
21,0 |
0,815 |
|
خليك |
ا |
123,5 |
21,0 |
0,780 |
|
بروبيوني |
ا |
102,0 |
48,8 |
0,807 |
|
بترول |
ا |
99,0 |
75,7 |
0,817 |
|
متساوي |
ا |
65,9 |
64,0 |
0,794 |
الخواص الكيميائية
تتميز الألدهيدات بفاعلية عالية. معظم ردود أفعالهم ناتجة عن وجود مجموعة كاربونيل. ذرة الكربون في مجموعة الكاربونيل موجودة في الحالة sp2- التهجين والأشكال الثلاثةس - اتصالات (أحدها اتصال C – O ) ، والموجودة في نفس المستوى بزاوية 120° لبعضهم البعض.

مخطط هيكل مجموعة الكاربونيل
تتشابه الرابطة المزدوجة لمجموعة الكاربونيل في الطبيعة الفيزيائية مع الرابطة المزدوجة بين ذرات الكربون ، أي هذا المزيج s- و p - روابط ، آخرها يتكون من إلكترونات p من ذرات الكربون والأكسجين. بسبب زيادة كهرسلبية ذرة الأكسجين مقارنة بذرة الكربون ، الرابطةج = س شديد الاستقطاب بسبب تغير كثافة الإلكترونص - روابط لذرة الأكسجين ، ونتيجة لذلك تكون سالبة جزئية (د-) ، وعلى ذرة الكربون - موجبة جزئية (د +) الرسوم:.
بسبب الاستقطاب ، تتمتع ذرة الكربون في مجموعة الكربونيل بخصائص محبة للكهرباء وقادرة على التفاعل مع الكواشف النووية. إن أهم تفاعلات الألدهيدات هي تفاعلات الإضافة المحبة للنواة عند الرابطة المزدوجة لمجموعة الكاربونيل.
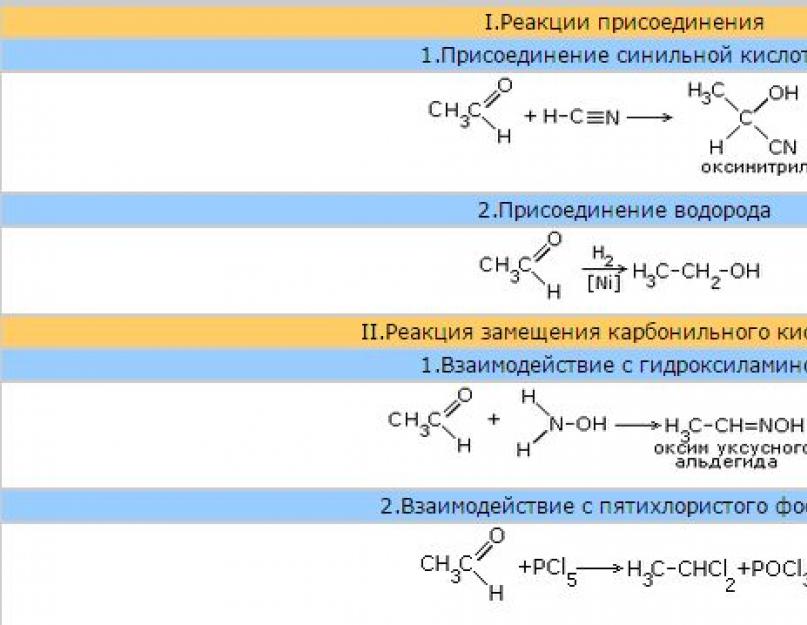
1. أحد تفاعلات الإضافة النموذجية للنواة للألدهيداتهو إضافة حمض الهيدروسيانيك (الهيدروسيانيك)مما يؤدي إلى التشكيلأ - أوكسينيتريل.
يستخدم هذا التفاعل لتمديد سلسلة الكربون والإنتاجأ- أحماض الهيدروكسي.
2.
إضافة هيدروسلفيت الصوديوميعطي المواد البلورية التي يشار إليها عادة بمشتقات الهيدروكلفيت من الألدهيدات.
يتم تحلل المشتقات المذكورة بسهولة في أي بيئة ، مما يؤدي إلى مركب الكربونيل الأصلي. لذلك ، عند تسخينها بمحلول من الصودا ، يتم تشكيل مشتق هيدرو سلفيت من الأسيتالديهيد ، يتم تكوين الأسيتالديهيد نفسه.
تستخدم هذه الخاصية لتنقية الألدهيدات وعزلها عن المخاليط.
3.
إضافة الكحولياتإلى الألدهيدات يؤدي إلى تكوين مركبات نصفية ،حيث يتم ربط ذرة الكربون بكل من الهيدروكسيل (–OH) والألكوكسي (–Oص ) مجموعات.
عندما يتم معالجة نصف الأسيتال بكمية زائدة من الكحول في وسط حمضي ، تتشكل الأسيتال - مركبات ترتبط فيها ذرة الكربون بمجموعتي ألكوكسي (يشبه التفاعل تخليق الإيثرات من الكحوليات).
على عكس الإيثرات ، يتم تحلل الأسيتال بواسطة الأحماض لتكوين كحول وألدهيد.
4. إضافة الهيدروجينإلى الألدهيدات في وجود محفزات (ني ، كو ، بد إلخ) ويؤدي إلى تكوين الكحوليات الأولية.
يتزايد استخدام هيدريد ألومنيوم الليثيوم كعامل اختزال. LiAlH 4 وبوروهيدريد الصوديوم NaBH4.
بالإضافة إلى تفاعلات الإضافة في مجموعة الكاربونيل ، تتميز الألدهيدات أيضًا بتفاعلات الأكسدة.
5. الأكسدة . تتأكسد الألدهيدات بسهولة لتكوين الأحماض الكربوكسيلية المقابلة.
أ) محلول الأمونيا من أكسيد الفضة[حج (NH 3) 2] أوه عند تسخينه مع الألدهيدات ، فإنه يؤكسد الألدهيد إلى حمض (على شكل ملح الأمونيوم) مع تكوين الفضة المعدنية الحرة. تترسب الفضة المختزلة في طبقة رقيقة على جدران الوعاء الكيميائي الذي يحدث فيه التفاعل ، ويتم الحصول على مرآة فضية. هذا التفاعل ، والذي يسمى بالتالي "مرآة الفضة" ، بمثابة رد فعل نوعي للألدهيدات.
ب) تفاعل مميز آخر هو أكسدة الألدهيدات مع هيدروكسيد النحاس ( II).
عند تسخين هيدروكسيد النحاس الأزرق (ثانيًا ) بمحلول أسيتالديهيد ، وهو راسب أحمر من أكسيد النحاس (أنا ). في هذه الحالة ، يتأكسد الأسيتالديهيد إلى حمض الأسيتيك ، ويتم تقليل النحاس مع حالة الأكسدة +2 إلى النحاس مع حالة الأكسدة +1. يحتل ألدهيد الفورميك (الفورمالديهايد) مكانة خاصة بين الألدهيدات. بسبب عدم وجود جذري ألدهيد فورميك ، فإنه يحتوي على بعض الخصائص المحددة. تتم عملية أكسدة الفورمالديهايد ، على سبيل المثال ، إلى ثاني أكسيد الكربونثاني أكسيد الكربون .
يتبلمر الفورمالديهايد بسهولة لتكوين بوليمرات حلقية وخطية. لذلك ، في بيئة حمضية ، فإنه يشكل قاطع دوري - ثلاثي أكسيد ميثيلين.
يشكل الفورمالديهايد الغازي الجاف في وجود محفزات بولي فورمالدهيد عالي الوزن الجزيئي. إن بلمرة الفورمالديهايد تشبه بلمرة الألكينات.
|
®O –– kat |
ح |
ح |
|
... –H 2 C – O (H 2 C – O) n H 2 C – O– ... |
في المحاليل المائية ، يشكل الفورمالديهايد بوليمر يسمى بارافورم.
n CH 2 \ u003d O + H 2 O ® HOCH 2 (OCH 2) n-2 OCH 2 OH
(بارافورم)
من الأهمية العملية بشكل خاص تفاعل التكثيف المتعدد للفورمالدهيد مع الفينول لتكوين راتنجات الفينول فورمالدهايد. تحت تأثير المحفزات القلوية أو الحمضية على خليط من الفينول والفورمالديهايد ، يحدث التكثيف في مواضع أورثو وبارا.
يتم نمو الجزيء بسبب تكثيف الفينول مع الفورمالديهايد في درجة الحرارة العاديةفي اتجاه خطي.
|
|
CH2OH |
||||
إلخ.
في المجموع ، يمكن تمثيل تفاعل التكثيف المتعدد للفينول مع الفورمالديهايد على النحو التالي:
|
O + (ن + 1) |
عامل حفاز |
|
NH2O |
||||
|
–––––––– ® |
راتنجات الفينول فورمالدهايد هي أول راتنجات صناعية صناعية ، بدأ إنتاجها تحت اسم "الباكليت" لأول مرة في عام 1909. تستخدم راتنجات الفينول فورمالدهايد في إنتاج مختلف أنواع البلاستيك. في تركيبة مع مواد مالئة مختلفة ، تسمى هذه المواد البلاستيكية الفينولات. بالإضافة إلى ذلك ، يتم استخدام راتنجات الفينول فورمالدهايد في التصنيع مواد لاصقة مختلفةوالورنيشات ، مواد العزل الحراري ، اللدائن الخشبية ، القوالب ، إلخ.
طلب
لقد قيل الكثير بالفعل عن استخدام الفورمالديهايد. بالإضافة إلى ذلك ، يتم استخدامه للحصول على راتنجات اليوريا عن طريق التفاعل مع اليوريا ، والتي يتم على أساسها إنتاج المواد البلاستيكية اللازمة لاحتياجات الهندسة الكهربائية. تُستخدم محاليل الفورمالديهايد (الفورمالين) في صناعة الجلود لدباغة الجلود ، ولتطهير مخازن الحبوب والخضروات ، والصوبات الزراعية ، والأحواض الساخنة ، ولملابس البذور قبل البذر ، ولتخزين المستحضرات التشريحية ، وكذلك في إنتاج بعض الأدوية.
ألدهيد الخليك هو المادة الأولية لإنتاج حمض الأسيتيك ، أنهيدريد الخل ، كحول الإيثيل ، أسيتات الإيثيل وغيرها من المنتجات القيمة على نطاق صناعي ، ومختلف الراتنجات الاصطناعية عند تكثيفها بالأمينات والفينولات.
كيتونات
الكيتونات عبارة عن مركبات ترتبط فيها مجموعة الكاربونيل بجذر هيدروكربونيين. الصيغة العامة للكيتوناتحيث R قد تتطابق مع R ".
ايزومرية
تتميز الكيتونات بتشابه الجذور الهيدروكربونية ، والتشابه في موضع مجموعة الكربونيل ، والتشابه بين الطبقات مع الألدهيدات.
إيصال
تقريبًا جميع طرق التحضير السابقة للألدهيدات (انظر "") تنطبق أيضًا على الكيتونات.
1. أكسدة الكحولات الثانوية.
2. نزع الهيدروجين من الكحولات الثانوية.
3. ترطيب متماثلات الأسيتيلين (تفاعل كوتشيروف).
4. التحلل المائي للهيدروكربونات المشتتةتحتوي على ذرات الهالوجين في إحدى ذرات الكربون المتوسطة في السلسلة.
|
CH 3 - |
Cl |
||
|
CH 3 - |
ا |
5.
يتم الحصول على الكيتونات أيضًا عن طريق الانحلال الحراري لأملاح الكالسيوم للأحماض الكربوكسيلية عند تسخينها.ا
ثانيًا
CH 3 -C
أنا
ا
الخصائص الفيزيائية
الكيتونات المنخفضة عبارة عن سوائل قابلة للذوبان في الماء بسهولة. بشكل عام ، الكيتونات لها رائحة طيبة تذكر برائحة الزهور. مثل الألدهيدات ، تغلي الكيتونات عند درجة حرارة أقل من الكحوليات المقابلة ، ولكن أعلى من الهيدروكربونات. يتم عرض الخصائص الفيزيائية لبعض الكيتونات في الجدول.
الطاولة. الخصائص الفيزيائية لبعض الكيتونات
|
اسم |
معادلة |
ر ° مربع ، |
t ° الغليان ، |
د 4 20 |
|
الأسيتون (ثنائي ميثيل كيتون) 42,0 |
102,7 |
0,816 |
الخواص الكيميائية
مثل الألدهيدات ، فإن الكيتونات شديدة التفاعل. كلما زاد النشاط الكيميائي للألدهيدات والكيتونات ، زادت الشحنة الموجبة على ذرة الكربون في مجموعة الكاربونيل. الجذور التي تزيد من هذه الشحنة الموجبة تزيد بشكل حاد من تفاعل الألدهيدات والكيتونات ، بينما الجذور التي تقلل الشحنة الموجبة لها تأثير معاكس. في الكيتونات ، تتبرع مجموعتان من الألكيل بالإلكترون ، مما يوضح سبب كون الكيتونات أقل نشاطًا في تفاعلات الإضافة المحبة للنواة مقارنة بالألدهيدات.
تم النظر في أمثلة تفاعلات من هذا النوع للألدهيدات بالتفصيل سابقًا (انظر "") ، لذلك ، مع إعطاء بعض الأمثلة على تفاعلات إضافة محبة للنواة في مجموعة الكيتونات الكربونية ، سوف ننتبه فقط إلى الاختلافات في خواصها الكيميائية من الألدهيدات.
1. الحصول على حمض الهيدروسيانيك.
|
ص |
أوه |
وتجدر الإشارة إلى أن كيتونات الميثيل فقط تتفاعل مع هيدروسلفيت الصوديوم ، أي الكيتونات التي لها التجمع CH3.
3.
بالمقارنة مع الألدهيدات ، فإن الكيتونات لا تتفاعل مع الكحول.
4. إضافة الهيدروجين. تؤدي إضافة الهيدروجين إلى الكيتونات إلى تكوين كحول ثانوي.
5. الكيتونات أكثر صعوبة في الأكسدة من الألدهيدات. أكسجين الهواء وعوامل الأكسدة الضعيفة لا تؤكسد الكيتونات. لا تعطي الكيتونات تفاعل "مرآة فضية" ولا تتفاعل مع هيدروكسيد النحاس (ثانيًا ). تحت تأثير عوامل مؤكسدة قوية في ظل ظروف قاسية ، يتم تدمير سلسلة الكربون لجزيء الكيتون بالقرب من مجموعة الكربونيل وتتكون الأحماض (أحيانًا الكيتونات ، اعتمادًا على بنية الكيتون الأصلي) بعدد أقل من ذرات الكربون.
|
|
|
|
طلب
الأعرض تطبيق الصناعيلديه أبسط ممثل للكيتونات - الأسيتون. الأسيتون هو مذيب قيم يستخدم في صناعة الطلاء والورنيش ، في إنتاج الحرير الصناعي والأغشية والمسحوق عديم الدخان. كما أنه يستخدم كمادة وسيطة في إنتاج حمض الميثاكريليك ، ميثيل ميثاكريلات (إنتاج الزجاج العضوي غير القابل للكسر) ، ميثيل إيزوبوتيل كيتون ، إلخ.
نهاية القسم
هيكل الألدهيدات والكيتونات

الألدهيدات- المواد العضوية التي تحتوي جزيئاتها مجموعة الكاربونيال:

مرتبطة بذرة هيدروجين وجذر هيدروكربوني. الصيغة العامة للألدهيدات هي:

في أبسط ألدهيد ، يتم لعب دور الجذر الهيدروكربوني بواسطة ذرة هيدروجين أخرى:
 الفورمالديهايد
الفورمالديهايد غالبًا ما يشار إلى مجموعة الكربونيل المرتبطة بذرة الهيدروجين الألدهيد:

الكيتونات عبارة عن مواد عضوية في الجزيئات التي ترتبط بها مجموعة الكاربونيل مع شقين هيدروكربونيين. من الواضح أن الصيغة العامة للكيتونات هي:

تسمى مجموعة الكاربونيل من الكيتونات مجموعة كيتو.
في أبسط الكيتون ، الأسيتون ، ترتبط مجموعة الكاربونيل بجذر ميثيل اثنين:

التسمية والتشابه للألدهيدات والكيتونات
اعتمادًا على بنية الجذر الهيدروكربوني المرتبط بمجموعة الألدهيد ، هناك الألدهيدات المشبعة ، غير المشبعة ، العطرية ، الحلقية غير المتجانسة والألدهيدات الأخرى:
وفقًا لتسمية IUPAC الحد من الألدهيداتتتشكل من اسم ألكان له نفس عدد ذرات الكربون من الجزيء باستخدام اللاحقة -AL. فمثلا:
الترقيمتبدأ ذرات الكربون في السلسلة الرئيسية من ذرة الكربون لمجموعة الألدهيد. لذلك ، تقع مجموعة الألدهيد دائمًا عند ذرة الكربون الأولى ، وليس من الضروري الإشارة إلى موقعها.
إلى جانب التسميات المنهجية ، تُستخدم أيضًا أسماء تافهة للألدهيدات المستخدمة على نطاق واسع. عادة ما يتم اشتقاق هذه الأسماء من أسماء الأحماض الكربوكسيلية المقابلة للألدهيدات.
للحصول على العنوان الكيتوناتوفقًا للتسمية المنهجية ، يتم الإشارة إلى مجموعة keto بواسطة اللاحقة -هوورقم يشير إلى عدد ذرة الكربون في مجموعة الكاربونيل (يجب أن يبدأ الترقيم من نهاية السلسلة الأقرب إلى مجموعة الكيتو).
فمثلا:
إلى عن على الألدهيداتنوع واحد فقط من التماكب البنيوي مميز - تماثل الهيكل الكربوني، وهو ممكن مع butanal و الكيتونات- ايضا تماثل موضع الكربونيل. بالإضافة إلى ذلك ، فهي تتميز أيضًا بين الصفوف(بروبانال وبروبانون).
الخصائص الفيزيائية للألدهيدات والكيتونات

في جزيء الألدهيد أو الكيتون ، بسبب زيادة كهرسلبية ذرة الأكسجين مقارنة بذرة الكربون ، فإن الرابطة C = O مستقطب للغايةبسبب تحول كثافة الإلكترون للرابطة π إلى الأكسجين:

الألدهيدات والكيتونات المواد القطبية ذات الكثافة الإلكترونية الزائدة على ذرة الأكسجين. الأجزاء السفلية من سلسلة الألدهيدات والكيتونات (الفورمالديهايد ، الأسيتالديهيد ، الأسيتون) قابلة للذوبان في الماء بلا حدود. نقاط غليانها أقل من تلك الخاصة بالكحول المقابل. هذا يرجع إلى حقيقة أنه في جزيئات الألدهيدات والكيتونات ، على عكس الكحوليات ، لا توجد ذرات هيدروجين متحركة ولا تشكل روابط بسبب الروابط الهيدروجينية.
الألدهيدات السفلية لها رائحة نفاذة. الألدهيدات التي تحتوي على أربع إلى ست ذرات كربون في السلسلة لها رائحة كريهة ؛ تحتوي الألدهيدات والكيتونات المرتفعة على روائح زهرية وتستخدم في صناعة العطور.
إن وجود مجموعة ألدهيد في جزيء ما يحدد الخصائص المميزة للألدهيدات.
ردود فعل الانتعاش.
1. إضافة الهيدروجينإلى جزيئات الألدهيد يحدث عند الرابطة المزدوجة في مجموعة الكاربونيل:

ناتج هدرجة الألدهيدات عبارة عن كحول أولي ، والكيتونات عبارة عن كحول ثانوي.
لذلك ، أثناء هدرجة الأسيتالديهيد على محفز نيكل ، الإيثانول، في هدرجة الأسيتون - بروبانول -2.

2. هدرجة الألدهيدات- تفاعل الاختزال ، حيث تنخفض درجة أكسدة ذرة الكربون الموجودة في مجموعة الكربونيل.
تفاعلات الأكسدة.
لا يمكن تقليل الألدهيدات فحسب ، بل يتأكسد أيضًا. عندما تتأكسد ، تشكل الألدهيدات أحماض كربوكسيلية. من الناحية التخطيطية ، يمكن تمثيل هذه العملية على النحو التالي:

1. الأكسدة بالأكسجين الجوي.على سبيل المثال ، يتكون حمض البروبيونيك من بروبيونالديهيد (بروبانال):

2. الأكسدة بعوامل مؤكسدة ضعيفة(محلول الأمونيا من أكسيد الفضة). في شكل مبسط ، يمكن التعبير عن هذه العملية بمعادلة التفاعل:

فمثلا:

بتعبير أدق ، تنعكس هذه العملية في المعادلات:

إذا تم إزالة الشحوم من سطح الوعاء الذي يتم فيه إجراء التفاعل سابقًا ، فإن الفضة المتكونة أثناء التفاعل تغطيه بغشاء رقيق مستوٍ. لذلك ، يسمى رد الفعل هذا برد فعل "المرآة الفضية". يستخدم على نطاق واسع في صناعة المرايا وزخارف الفضة وزينة عيد الميلاد.
3. الأكسدة بهيدروكسيد النحاس (II) المترسب حديثًا.يؤكسد الألدهيد ، يتم تقليل Cu 2+ إلى Cu +. هيدروكسيد النحاس (I) CuOH المتكون أثناء التفاعل يتحلل على الفور إلى أكسيد النحاس الأحمر (I) والماء.

رد الفعل هذا مثل رد الفعل مرآة الفضة”، للكشف عن الألدهيدات.
لا تتأكسد الكيتونات إما عن طريق الأكسجين الموجود في الغلاف الجوي أو بواسطة عامل مؤكسد ضعيف مثل محلول الأمونيا من أكسيد الفضة.
الخواص الكيميائية للألدهيدات والأحماض - مجردة


الممثلين الفرديين للألدهيدات ومعناها
الفورمالديهايد(الميثان ، ألدهيد الفورميك HCHO) هو غاز عديم اللون برائحة نفاذة ونقطة غليان تصل إلى -21 درجة مئوية ، وسوف نذوب في الماء بسهولة. الفورمالديهايد سام! محلول الفورمالديهايد في الماء (40٪) يسمى الفورمالين ويستخدم لتطهير الفورمالديهايد والأسيتيك. في الزراعة ، يستخدم الفورمالين لتغذية البذور ، وفي صناعة الجلود - لمعالجة الجلود. يستخدم لصنع الفورمالديهايد يوروتروبين- مادة طبية. يتم ضغط urotropin أحيانًا على شكل قوالب ، ويستخدم كوقود (كحول جاف). يتم استهلاك كمية كبيرة من الفورمالديهايد في إنتاج راتنجات الفينول فورمالدهايد وبعض المواد الأخرى.
ألدهيد الخليك(ethanal، acetaldehyde CH3 CHO) - سائل برائحة حادة كريهة ونقطة غليان 21 درجة مئوية ، سوف نذوب جيدًا في الماء. يتم الحصول على حمض الخليك وعدد من المواد الأخرى من الأسيتالديهيد على نطاق صناعي ، ويستخدم لإنتاج مختلف أنواع البلاستيك وألياف الأسيتات. ألدهيد الخليك سام!

مجموعة ذرات -

اتصل مجموعة الكربوكسيل، أو الكربوكسيل.
الأحماض العضوية التي تحتوي على مجموعة كربوكسيل واحدة في الجزيء أحادي القاعدة.
الصيغة العامة لهذه الأحماض هي RCOOH ، على سبيل المثال:

تسمى الأحماض الكربوكسيلية التي تحتوي على مجموعتين من الكربوكسيل ثنائي القاعدة. وتشمل ، على سبيل المثال ، أحماض الأكساليك والسكسينيك:

هناك أيضا متعدد القاعدةأحماض كربوكسيلية تحتوي على أكثر من مجموعتين كربوكسيل. وتشمل هذه ، على سبيل المثال ، حامض الستريك تريباسيك:

اعتمادًا على طبيعة الجذر الهيدروكربوني ، يتم تقسيم الأحماض الكربوكسيلية إلى هامشي ، غير مشبع ، عطري.
يحد، أو الأحماض الكربوكسيلية المشبعة ، على سبيل المثال ، حمض البروبانويك (بروبيونيك):

أو مألوف لدينا بالفعل حمض السكسينيك.
من الواضح أن الأحماض الكربوكسيلية المشبعة لا تحتوي على روابط π في جذور الهيدروكربون.
في جزيئات الأحماض الكربوكسيلية غير المشبعة ، ترتبط مجموعة الكربوكسيل بجذر هيدروكربوني غير مشبع وغير مشبع ، على سبيل المثال ، في جزيئات الأكريليك (البروبين)
CH 2 \ u003d CH-COOH
أو أوليك
CH 3 - (CH 2) 7 -CH \ u003d CH- (CH 2) 7 -COOH
والأحماض الأخرى.
كما يتضح من صيغة حمض البنزويك ، فهو كذلك عطريحيث أنه يحتوي على حلقة عطرية (بنزين) في الجزيء:


يتكون اسم حمض الكربوكسيل من اسم الألكان المقابل (ألكان له نفس عدد ذرات الكربون في الجزيء) مع إضافة اللاحقة -ov— ، تنتهي -و اناوالكلمات حامض. ترقيم ذرات الكربون يبدأ بمجموعة الكربوكسيل. فمثلا:

يشار إلى عدد مجموعات الكربوكسيل في الاسم من خلال البادئات ثنائي ، ثلاثي ، رباعي-:
العديد من الأحماض لها أسماء طورت تاريخيا ، أو تافهة.
سيتم التعبير عن تكوين الأحماض الكربوكسيلية أحادية القاعدة بواسطة الصيغة العامة ج ن H 2n O 2، أو C n H 2n + 1 COOH، أو RCOOH.
الخصائص الفيزيائية للأحماض الكربوكسيلية
الأحماض السفلية ، أي الأحماض ذات الوزن الجزيئي الصغير نسبيًا ، والتي تحتوي على ما يصل إلى أربع ذرات كربون في الجزيء ، هي سوائل ذات رائحة نفاذة مميزة (على سبيل المثال ، رائحة حمض الأسيتيك). الأحماض التي تحتوي على 4 إلى 9 ذرات كربون هي سوائل زيتية لزجة ذات رائحة كريهة ؛ تحتوي على أكثر من 9 ذرات كربون في جزيء - مواد صلبة لا تذوب في الماء. تزداد نقاط غليان الأحماض الكربوكسيلية أحادية القاعدة مع زيادة عدد ذرات الكربون في الجزيء ، وبالتالي مع زيادة الوزن الجزيئي النسبي. لذا ، فإن درجة غليان حمض الفورميك هي 100.8 درجة مئوية ، وحمض الخليك - 118 درجة مئوية ، وحمض البروبيونيك - 141 درجة مئوية.
أبسط حمض الكربوكسيل ، الفورميك HCOOH ، له وزن جزيئي نسبي صغير (M r (HCOOH) = 46) ، في ظل الظروف العادية هو سائل مع نقطة غليان 100.8 درجة مئوية. في الوقت نفسه ، يكون البيوتان (M r (C 4 H 10) \ u003d 58) غازيًا في نفس الظروف وله نقطة غليان تبلغ -0.5 درجة مئوية. يفسر هذا التناقض بين نقاط الغليان والأوزان الجزيئية النسبية تشكيل ثنائيات الأحماض الكربوكسيليةحيث يتم ربط جزيئين من الحمض بواسطة اثنين روابط هيدروجينية:

يصبح حدوث الروابط الهيدروجينية واضحًا عند النظر في بنية جزيئات حمض الكربوكسيل.
تحتوي جزيئات الأحماض الكربوكسيلية أحادية القاعدة المشبعة على مجموعة قطبية من الذرات - الكربوكسيل

وعمليا جذري هيدروكربوني غير قطبي. تنجذب مجموعة الكربوكسيل إلى جزيئات الماء ، وتشكل معها روابط هيدروجينية:

أحماض الفورميك والأسيتيك قابلة للذوبان في الماء بلا حدود. من الواضح أنه مع زيادة عدد الذرات في جذور الهيدروكربون ، تقل قابلية ذوبان الأحماض الكربوكسيلية.
الخواص الكيميائية للأحماض الكربوكسيلية
تعود الخصائص العامة المميزة لفئة الأحماض (العضوية وغير العضوية) إلى الوجود في جزيئات مجموعة الهيدروكسيل التي تحتوي على رابطة قطبية قوية بين ذرات الهيدروجين والأكسجين. دعونا نفكر في هذه الخصائص باستخدام مثال الأحماض العضوية القابلة للذوبان في الماء.
1. التفككمع تكوين كاتيونات الهيدروجين وأنيونات بقايا الحمض:
بتعبير أدق ، يتم وصف هذه العملية بمعادلة تأخذ في الاعتبار مشاركة جزيئات الماء فيها:
يتم تحويل توازن تفكك الأحماض الكربوكسيلية إلى اليسار ؛ الغالبية العظمى منهم من الشوارد ضعيفة. ومع ذلك ، فإن الطعم الحامض لأحماض الأسيتيك والفورميك ، على سبيل المثال ، يرجع إلى التفكك في كاتيونات الهيدروجين وأنيونات المخلفات الحمضية.
من الواضح أن وجود الهيدروجين "الحمضي" ، أي هيدروجين مجموعة الكربوكسيل ، في جزيئات الأحماض الكربوكسيلية يحدد أيضًا الخصائص المميزة الأخرى.
2. التفاعل مع المعادنالوقوف في سلسلة الكهروكيميائية من الفولتية حتى الهيدروجين:
لذلك ، يقلل الحديد من الهيدروجين من حمض الأسيتيك:
3. التفاعل مع الأكاسيد الأساسيةمع تكوين الملح والماء:
4. التفاعل مع هيدروكسيدات المعادنمع تكوين الملح والماء (تفاعل معادلة):
5. التفاعل مع أملاح الأحماض الضعيفةمع تشكيل الأخير. وهكذا ، يحل حمض الأسيتيك محل حامض دهني من ستيرات الصوديوم وحمض الكربونيك من كربونات البوتاسيوم:

6. تفاعل الأحماض الكربوكسيلية مع الكحولمع تكوين الإسترات - تفاعل الأسترة (أحد أهم التفاعلات المميزة للأحماض الكربوكسيلية):
يتم تحفيز تفاعل الأحماض الكربوكسيلية مع الكحوليات بواسطة كاتيونات الهيدروجين.
يكون رد فعل الأسترة قابلاً للعكس. يتحول التوازن نحو تكوين الإستر في وجود عوامل نزع الماء وعند إزالة الإستر من خليط التفاعل.
في تفاعل الأسترة العكسي ، والذي يسمى تحلل الإستر (تفاعل إستر مع الماء) ، يتكون حمض وكحول:

من الواضح أن الكحولات متعددة الهيدروكسيل ، على سبيل المثال ، الجلسرين ، يمكن أن تتفاعل أيضًا مع الأحماض الكربوكسيلية ، أي تدخل في تفاعل الأسترة:

تحتوي جميع الأحماض الكربوكسيلية (باستثناء الفورميك) ، جنبًا إلى جنب مع مجموعة الكربوكسيل ، على بقايا هيدروكربونية في جزيئاتها. بالطبع ، لا يمكن لهذا إلا أن يؤثر على خصائص الأحماض ، التي تحددها طبيعة بقايا الهيدروكربون.
7. تفاعلات إضافة رابطة متعددة- الأحماض الكربوكسيلية غير المشبعة تدخل فيها. على سبيل المثال ، تفاعل إضافة الهيدروجين هو الهدرجة. بالنسبة للحمض الذي يحتوي على رابطة n واحدة في الجذر ، يمكن كتابة المعادلة بشكل عام:
لذلك ، عندما يتم هدرجة حمض الأوليك ، يتشكل حمض دهني مشبع:
الأحماض الكربوكسيلية غير المشبعة ، مثل غيرها من المركبات غير المشبعة ، تضيف الهالوجينات إلى الرابطة المزدوجة. على سبيل المثال ، يقوم حمض الأكريليك بإزالة لون ماء البروم:

8. تفاعلات الاستبدال (مع الهالوجينات)- الأحماض الكربوكسيلية المشبعة قادرة على الدخول فيها. على سبيل المثال ، من خلال تفاعل حمض الأسيتيك مع الكلور ، يمكن الحصول على مشتقات أحماض الكلور المختلفة:

الخواص الكيميائية للأحماض الكربوكسيلية - خلاصة وافية



الممثلين الفرديين للأحماض الكربوكسيلية وأهميتها
حمض الفورميك (الميثان) HCOOH- سائل ذو رائحة نفاذة ودرجة غليانه 100.8 درجة مئوية ، عالي الذوبان في الماء.
حمض الفورميك سام ويسبب حروقًا إذا لامس الجلد! يحتوي السائل اللاذع الذي يفرزه النمل على هذا الحمض.
يحتوي حمض الفورميك على خاصية مطهرة وبالتالي يجد تطبيقه في الصناعات الغذائية والجلدية والأدوية والأدوية. يتم استخدامه في صباغة المنسوجات والورق.
حمض الخليك (الإيثانويك) CH 3 COOH- سائل عديم اللون ذو رائحة نفاذة مميزة ، قابل للامتزاج مع الماء بأي نسبة. يتم طرح المحاليل المائية لحمض الأسيتيك للبيع تحت اسم الخل (محلول 3-5٪) وجوهر الخل (محلول 70-80٪) وتستخدم على نطاق واسع في صناعة المواد الغذائية. حمض الخليك مذيب جيد للكثيرين المواد العضويةولذلك فهي تستخدم في الصباغة وصناعة الجلود وصناعة الطلاء والورنيش. بالإضافة إلى ذلك ، يعد حمض الأسيتيك مادة خام لإنتاج العديد من المركبات العضوية المهمة تقنيًا: على سبيل المثال ، يتم استخدامه للحصول على المواد المستخدمة لمكافحة الحشائش - مبيدات الأعشاب. حمض الخليك هو المكون الرئيسي لخل النبيذ ، ورائحته المميزة ترجع إليه. إنه نتاج أكسدة الإيثانول ويتكون منه عند تخزين النبيذ في الهواء.
أهم الممثلين لأعلى الأحماض أحادية القاعدة هي بالميتيك C 15 H 31 COOH و stearic C 17 H 35 COOH الأحماض. على عكس الأحماض السفلية ، هذه المواد صلبة ، ضعيفة الذوبان في الماء.
ومع ذلك ، فإن أملاحهم - الستيرات والراحة - قابلة للذوبان بدرجة عالية ولها تأثير منظف ، وهذا هو سبب تسميتها أيضًا بالصابون. من الواضح أن هذه المواد يتم إنتاجها على نطاق واسع.
من الأحماض الكربوكسيلية العالية غير المشبعة أعلى قيمةلديها حمض الأوليك C 17 H 33 COOH ، أو CH 3 - (CH 2) 7 - CH \ u003d CH - (CH 2) 7 COOH. إنه سائل شبيه بالزيت بدون طعم أو رائحة. تطبيق واسعتم العثور على أملاحه في التكنولوجيا.
أبسط ممثل للأحماض الكربوكسيلية ثنائية القاعدة هو حمض الأكساليك (ethanedioic) HOOC-COOH ، توجد أملاحها في العديد من النباتات ، مثل حميض وحميض. حمض الأكساليك مادة بلورية عديمة اللون ، عالية الذوبان في الماء. يتم استخدامه في تلميع المعادن ، وفي صناعة الأخشاب والجلود.
المواد المرجعية لاجتياز الاختبار:
الجدول الدوري
جدول الذوبان