يتذكر كل من ذهب إلى المدرسة أن الكيمياء هي إحدى المواد المطلوبة للدراسة. قد تعجبها ، أو لم تعجبها - لا يهم. ومن المحتمل أن يكون قد تم بالفعل نسيان الكثير من المعرفة في هذا التخصص ولم يتم تطبيقه في الحياة. ومع ذلك ، الجدول العناصر الكيميائيةربما يتذكر الجميع د. آي مينديليف. بالنسبة للكثيرين ، ظل جدولًا متعدد الألوان ، حيث تم كتابة أحرف معينة في كل مربع ، للإشارة إلى أسماء العناصر الكيميائية. لكن هنا لن نتحدث عن الكيمياء على هذا النحو ، ونصف مئات التفاعلات والعمليات الكيميائية ، لكننا سنتحدث عن كيفية ظهور الجدول الدوري بشكل عام - هذه القصة ستكون موضع اهتمام أي شخص ، وفي الواقع لكل من يريد معلومات مثيرة للاهتمام ومفيدة.
القليل من الخلفية
في عام 1668 ، نشر الكيميائي والفيزيائي واللاهوتي الأيرلندي روبرت بويل كتابًا تم فيه فضح العديد من الأساطير حول الكيمياء ، وتحدث فيه عن الحاجة إلى البحث عن عناصر كيميائية غير قابلة للتحلل. قدم العالم أيضًا قائمة بها ، تتكون من 15 عنصرًا فقط ، لكنه سمح بفكرة أنه قد يكون هناك المزيد من العناصر. أصبح نقطة البدايةليس فقط في البحث عن عناصر جديدة ، ولكن أيضًا في تنظيمها.
بعد مائة عام ، قام الكيميائي الفرنسي أنطوان لافوازييه بجمع المعلومات قائمة جديدة، والتي تضمنت بالفعل 35 عنصرًا. تم العثور على 23 منهم في وقت لاحق لتكون غير قابلة للتحلل. لكن البحث عن عناصر جديدة استمر من قبل العلماء في جميع أنحاء العالم. و دور قياديلعب الكيميائي الروسي الشهير ديمتري إيفانوفيتش مينديليف في هذه العملية - كان أول من طرح فرضية أنه يمكن أن تكون هناك علاقة بين الكتلة الذرية للعناصر وموقعها في النظام.
بفضل العمل الجاد ومقارنة العناصر الكيميائية ، تمكن منديليف من اكتشاف العلاقة بين العناصر التي يمكن أن تكون واحدة فيها ، وخصائصها ليست شيئًا مفروغًا منه ، ولكنها ظاهرة تتكرر بشكل دوري. نتيجة لذلك ، في فبراير 1869 ، صاغ مندليف القانون الدوري الأول ، وفي مارس بالفعل ، تم تقديم تقريره "علاقة الخصائص بالوزن الذري للعناصر" إلى الجمعية الكيميائية الروسية من قبل مؤرخ الكيمياء ن. أ. مينشوتكين. ثم في نفس العام ، نُشر منشور منديليف في مجلة Zeitschrift fur Chemie في ألمانيا ، وفي عام 1871 تم نشر منشور جديد واسع النطاق للعالم مكرس لاكتشافه في مجلة ألمانية أخرى Annalen der Chemie.
إنشاء جدول دوري

كانت الفكرة الرئيسية بحلول عام 1869 قد تشكلت بالفعل من قبل مندليف ، وإلى الأبد وقت قصير، ولكن لفترة طويلة لم يتمكن من ترتيبها في نوع من النظام المرتب الذي يعرض بوضوح ما هو. في إحدى المحادثات التي أجراها مع زميله أ. إينوستريستيف ، قال حتى إن كل شيء قد نجح بالفعل في رأسه ، لكنه لم يستطع إحضار كل شيء إلى الطاولة. بعد ذلك ، وفقًا لكتاب سيرة مندليف ، بدأ في ذلك عمل شاقفوق طاولته التي استمرت ثلاثة أيام دون استراحة للنوم. تم فرز جميع أنواع الطرق لتنظيم العناصر في الجدول ، وكان العمل معقدًا بسبب حقيقة أن العلم في ذلك الوقت لم يكن يعرف بعد عن جميع العناصر الكيميائية. لكن ، على الرغم من ذلك ، كان الجدول لا يزال يُنشأ ، وتم تنظيم العناصر.
أسطورة حلم مندليف
لقد سمع الكثيرون القصة التي كان يحلم بها دي آي مينديليف من طاولته. تم توزيع هذا الإصدار بنشاط من قبل الزميل المذكور أعلاه من Mendeleev A. A. Inostrantsev as قصة مضحكةالذي كان يرفه عن طلابه. قال إن ديمتري إيفانوفيتش ذهب إلى الفراش وفي المنام رأى بوضوح طاولته ، حيث تم ترتيب جميع العناصر الكيميائية بالترتيب الصحيح. بعد ذلك ، قال الطلاب مازحين أنه تم اكتشاف 40 درجة من الفودكا بنفس الطريقة. ولكن لا تزال هناك شروط مسبقة حقيقية لقصة النوم: كما ذكرنا سابقًا ، عمل منديليف على الطاولة دون نوم أو راحة ، ووجده إينوستريستيف ذات مرة متعبًا ومرهقًا. في فترة ما بعد الظهر ، قرر منديليف أخذ قسط من الراحة ، وبعد فترة من الوقت ، استيقظ فجأة ، وأخذ على الفور قطعة من الورق ورسم طاولة جاهزة عليها. لكن العالم نفسه دحض هذه القصة برمتها بحلم ، قائلاً: "لقد كنت أفكر في الأمر منذ عشرين عامًا ، وأنت تعتقد: كنت جالسًا وفجأة ... أصبحت جاهزة." لذلك قد تكون أسطورة الحلم جذابة للغاية ، لكن إنشاء الطاولة لم يكن ممكنًا إلا من خلال العمل الجاد.

مزيد من العمل
في الفترة من 1869 إلى 1871 ، طور مندليف أفكار الدورية التي كان المجتمع العلمي يميل إليها. وواحد من معالمكانت هذه العملية عبارة عن فهم أن أي عنصر في النظام يجب أن يعتمد على مجموع خصائصه مقارنة بخصائص العناصر الأخرى. بناءً على ذلك ، واستناداً أيضًا إلى نتائج البحث في تغيير الأكاسيد المكونة للزجاج ، تمكن الكيميائي من تعديل قيم الكتل الذرية لبعض العناصر ، من بينها اليورانيوم والإنديوم والبريليوم وغيرها.
بالطبع ، أراد Mendeleev ملء الخلايا الفارغة التي بقيت في الجدول في أسرع وقت ممكن ، وفي عام 1870 توقع أنه سيتم قريبًا اكتشاف عناصر كيميائية غير معروفة للعلم ، والكتل الذرية وخصائصها التي تمكن من حسابها. كان أولها الغاليوم (اكتشف عام 1875) ، سكانديوم (اكتشف عام 1879) والجرمانيوم (اكتشف عام 1885). ثم استمرت التوقعات في تحقيقها ، وتم اكتشاف ثمانية عناصر جديدة أخرى ، بما في ذلك: البولونيوم (1898) ، والرينيوم (1925) ، والتكنيشيوم (1937) ، والفرانسيوم (1939) ، والأستاتين (1942-1943). بالمناسبة ، في عام 1900 ، توصل D.I Mendeleev والكيميائي الاسكتلندي William Ramsay إلى استنتاج مفاده أنه يجب أيضًا تضمين عناصر المجموعة الصفرية في الجدول - حتى عام 1962 كانت تسمى غازات خاملة ، وبعدها - غازات نبيلة.
تنظيم النظام الدوري
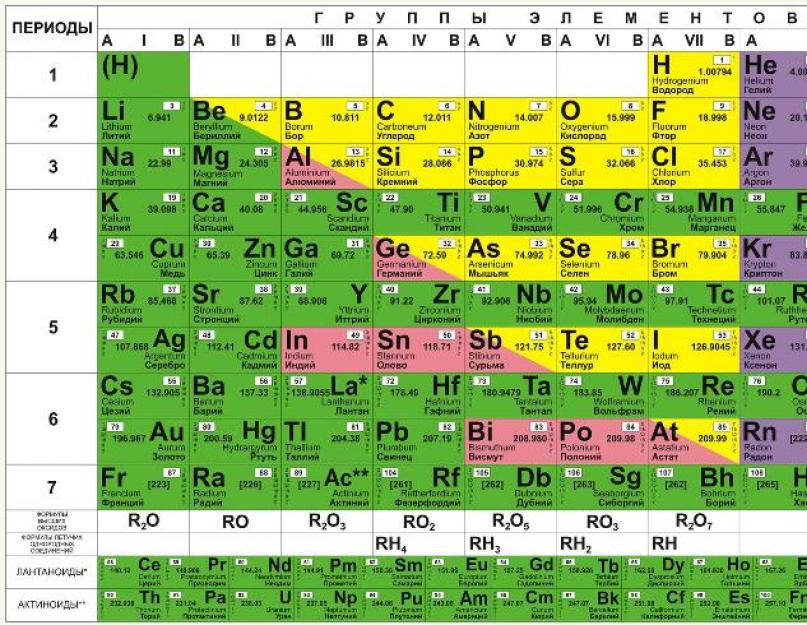
يتم ترتيب العناصر الكيميائية في جدول D.I Mendeleev في صفوف ، وفقًا للزيادة في كتلتها ، ويتم اختيار طول الصفوف بحيث يكون للعناصر الموجودة فيها خصائص متشابهة. على سبيل المثال ، لا تتفاعل الغازات النبيلة مثل الرادون والزينون والكريبتون والأرجون والنيون والهيليوم بسهولة مع العناصر الأخرى ، كما أن لها نشاطًا كيميائيًا منخفضًا ، وهذا هو سبب وجودها في العمود الأيمن الأقصى. وتتفاعل عناصر العمود الأيسر (البوتاسيوم ، والصوديوم ، والليثيوم ، وما إلى ذلك) تمامًا مع العناصر الأخرى ، وتكون التفاعلات نفسها متفجرة. لوضعها ببساطة ، داخل كل عمود ، العناصر لها خصائص متشابهة ، تختلف من عمود إلى آخر. جميع العناصر حتى رقم 92 موجودة في الطبيعة ، ومع رقم 93 تبدأ العناصر الاصطناعية ، والتي لا يمكن إنشاؤها إلا في المختبر.
في نسخته الأصلية ، لم يُفهم النظام الدوري إلا على أنه انعكاس للترتيب الموجود في الطبيعة ، ولم تكن هناك تفسيرات لماذا يجب أن يكون كل شيء على هذا النحو. وفقط عندما ظهرت ميكانيكا الكم ، المعنى الحقيقيأصبح ترتيب العناصر في الجدول واضحًا.
دروس العملية الإبداعية
عند الحديث عن الدروس المستفادة من العملية الإبداعية التي يمكن استخلاصها من التاريخ الكامل لإنشاء الجدول الدوري لـ D.I Mendeleev ، يمكن للمرء أن يستشهد بأفكار الباحث الإنجليزي في مجال التفكير الإبداعي Graham Wallace والعالم الفرنسي هنري بوانكاريه. لنأخذها بإيجاز.
وفقًا لـ Poincaré (1908) و Graham Wallace (1926) ، هناك أربع مراحل رئيسية في التفكير الإبداعي:
- تمرين- مرحلة صياغة المهمة الرئيسية والمحاولات الأولى لحلها ؛
- حضانة- المرحلة التي يوجد فيها إلهاء مؤقت عن العملية ، ولكن يتم العمل على إيجاد حل للمشكلة على مستوى اللاوعي ؛
- تبصر- المرحلة التي فيها حل بديهي. علاوة على ذلك ، يمكن العثور على هذا الحل في موقف لا علاقة له بالمهمة على الإطلاق ؛
- فحص- مرحلة اختبار الحل وتنفيذه ، حيث يتم التحقق من هذا الحل وإمكانية تطويره.
كما نرى ، في عملية إنشاء طاولته ، اتبع Mendeleev بشكل حدسي هذه المراحل الأربع. ما مدى فعالية هذا يمكن الحكم عليه من خلال النتائج ، أي لأن الجدول قد تم إنشاؤه. وبالنظر إلى أن إنشائها كان خطوة كبيرة إلى الأمام ليس فقط في مجال العلوم الكيميائية ، ولكن بالنسبة للبشرية جمعاء ، يمكن تطبيق المراحل الأربع المذكورة أعلاه على كل من تنفيذ المشاريع الصغيرة وتنفيذ الخطط العالمية. الشيء الرئيسي الذي يجب تذكره هو أنه لا يمكن العثور على اكتشاف واحد أو حل واحد لمشكلة ما بمفرده ، بغض النظر عن مدى رغبتنا في رؤيتهم في المنام وبغض النظر عن مقدار نومنا. لكي تنجح ، سواء كان ذلك في إنشاء جدول للعناصر الكيميائية أو تطوير خطة تسويق جديدة ، فأنت بحاجة إلى معرفة ومهارات معينة ، وكذلك استخدام إمكاناتك بمهارة والعمل الجاد.
نتمنى لك النجاح في مساعيك و التنفيذ الناجحمتخيل، حامل!
العنصر الكيميائي هو مصطلح جماعي يصف مجموعة من الذرات مادة بسيطة، أي أنه لا يمكن تقسيمه إلى أي مكونات أبسط (حسب بنية جزيئاتهم). تخيل أنك تلقيت قطعة من الحديد النقي مع طلب تقسيمها إلى مكونات افتراضية باستخدام أي جهاز أو طريقة اخترعها الكيميائيون. ومع ذلك ، لا يمكنك فعل أي شيء ، فلن يتم تقسيم المكواة أبدًا إلى شيء أبسط. مادة بسيطة - الحديد - تتوافق مع العنصر الكيميائي Fe.
التعريف النظري
يمكن تفسير الحقيقة التجريبية المذكورة أعلاه باستخدام التعريف التالي: العنصر الكيميائي هو مجموعة مجردة من الذرات (وليس الجزيئات!) للمادة البسيطة المقابلة ، أي الذرات من نفس النوع. إذا كانت هناك طريقة للنظر إلى كل ذرة منفردة في قطعة الحديد النقي المذكورة أعلاه ، فستكون جميعها متشابهة - ذرات الحديد. وعلى النقيض من هذا، مركب كيميائي، على سبيل المثال ، أكسيد الحديد ، يحتوي دائمًا على اثنين على الأقل نوع مختلفالذرات: ذرات الحديد وذرات الأكسجين.
شروط يجب أن تعرفها
الكتلة الذرية: كتلة البروتونات والنيوترونات والإلكترونات التي تشكل ذرة عنصر كيميائي.
العدد الذري: عدد البروتونات في نواة ذرة عنصر.
رمز كيميائي: حرف أو زوج حروف لاتينيةأ يمثل رمز هذا العنصر.
مركب كيميائي: مادة تتكون من عنصرين كيميائيين أو أكثر مدمجين مع بعضهم البعض بنسب معينة.
معدن: عنصر يفقد الإلكترونات في التفاعلات الكيميائية مع العناصر الأخرى.
ميتالويد: عنصر يتفاعل أحيانًا كمعدن وأحيانًا يتفاعل كمعدن.
اللافلزية: عنصر يميل إلى اكتساب الإلكترونات فيه تفاعلات كيميائيةمع عناصر أخرى.
النظام الدوري للعناصر الكيميائية: نظام لتصنيف العناصر الكيميائية حسب عددها الذري.
عنصر اصطناعي: الذي يتم الحصول عليه صناعياً في المختبر ، وعادة لا يحدث في الطبيعة.

العناصر الطبيعية والاصطناعية
يوجد اثنان وتسعون عنصرًا كيميائيًا بشكل طبيعي على الأرض. تم الحصول على الباقي بشكل مصطنع في المختبرات. عادة ما يكون العنصر الكيميائي الاصطناعي نتاج التفاعلات النووية في مسرعات الجسيمات (الأجهزة المستخدمة لزيادة سرعة الجسيمات دون الذرية مثل الإلكترونات والبروتونات) أو المفاعلات النووية(الأجهزة المستخدمة للتحكم في الطاقة المنبعثة في التفاعلات النووية). أول عنصر اصطناعي تم الحصول عليه برقم ذري 43 هو عنصر التكنيشيوم ، الذي اكتشفه الفيزيائيان الإيطاليان سي. بيرييه وإي سيجري في عام 1937. بصرف النظر عن التكنيشيوم والبروميثيوم ، تحتوي جميع العناصر الاصطناعية على نوى أكبر من نوى اليورانيوم. آخر عنصر اصطناعي تم تسميته هو ليفرموريوم (116) ، وقبل ذلك كان فلروفيوم (114).

عشرين عنصرًا مشتركًا وهامًا
| اسم | رمز | النسبة المئوية لجميع الذرات * | خصائص العناصر الكيميائية (في ظل ظروف الغرفة العادية) |
|||
| في الكون | في قشرة الأرض | في مياه البحر | في جسم الإنسان |
|||
| الألومنيوم | ال | - | 6,3 | - | - | معدن فضي خفيف الوزن |
| الكالسيوم | كاليفورنيا | - | 2,1 | - | 0,02 | المدرجة في المعادن الطبيعية ، والأصداف والعظام |
| كربون | من | - | - | - | 10,7 | أساس جميع الكائنات الحية |
| الكلور | Cl | - | - | 0,3 | - | غاز سام |
| نحاس | النحاس | - | - | - | - | فقط معدن أحمر |
| ذهب | Au | - | - | - | - | فقط معدن أصفر |
| الهيليوم | هو | 7,1 | - | - | - | غاز خفيف جدا |
| هيدروجين | ح | 92,8 | 2,9 | 66,2 | 60,6 | الأخف وزنا من جميع العناصر ؛ غاز |
| اليود | أنا | - | - | - | - | اللافلزية؛ يستخدم كمطهر |
| حديد | الحديد | - | 2,1 | - | - | معدن مغناطيسي تستخدم لانتاج الحديد والصلب |
| قيادة | الرصاص | - | - | - | - | معدن ثقيل ناعم |
| المغنيسيوم | ملغ | - | 2,0 | - | - | معدن خفيف جدا |
| الزئبق | زئبق | - | - | - | - | المعدن السائل؛ أحد عنصرين سائلين |
| نيكل | ني | - | - | - | - | معدن مقاوم للتآكل تستخدم في العملات المعدنية |
| نتروجين | ن | - | - | - | 2,4 | الغاز هو المكون الرئيسي للهواء |
| الأكسجين | ا | - | 60,1 | 33,1 | 25,7 | الغاز ثاني أهميه مكون الهواء |
| الفوسفور | ص | - | - | - | 0,1 | اللافلزية؛ مهم للنباتات |
| البوتاسيوم | إلى | - | 1.1 | - | - | معدن؛ مهم للنباتات يشار إليه عادة باسم "البوتاس" |
* إذا لم يتم تحديد القيمة ، فعندئذ يكون العنصر أقل من 0.1 بالمائة.
الانفجار العظيم هو السبب الجذري لتكوين المادة
ما هو العنصر الكيميائي الذي كان أول عنصر في الكون؟ يعتقد العلماء أن الإجابة على هذا السؤال تكمن في النجوم والعمليات التي تتشكل بها النجوم. يعتقد أن الكون نشأ في وقت ما بين 12 و 15 مليار سنة مضت. حتى هذه اللحظة ، لا يتم تصور أي شيء موجود ، باستثناء الطاقة. ولكن حدث شيء ما حول هذه الطاقة إلى انفجار ضخم (ما يسمى الانفجار العظيم). في الثواني التالية بعد .الانفجار العظيمبدأت المادة تتشكل.
كانت أول أبسط أشكال المادة التي ظهرت هي البروتونات والإلكترونات. يتم دمج بعضها في ذرات الهيدروجين. يتكون الأخير من بروتون واحد وإلكترون واحد ؛ إنها أبسط ذرة يمكن أن توجد.

ببطء ، على مدى فترات طويلة من الزمن ، بدأت ذرات الهيدروجين تتجمع معًا في مناطق معينة من الفضاء ، مكونة غيومًا كثيفة. تم سحب الهيدروجين في هذه السحب إلى تكوينات مضغوطة بواسطة قوى الجاذبية. في نهاية المطاف ، أصبحت هذه السحب من الهيدروجين كثيفة بما يكفي لتشكيل النجوم.
النجوم كمفاعلات كيميائية للعناصر الجديدة
النجم هو ببساطة كتلة من المادة تولد طاقة التفاعلات النووية. أكثر هذه التفاعلات شيوعًا هو الجمع بين أربع ذرات هيدروجين لتكوين ذرة هيليوم واحدة. بمجرد أن بدأت النجوم في التكون ، أصبح الهيليوم العنصر الثاني الذي يظهر في الكون.
مع تقدم النجوم في السن ، تتحول من التفاعلات النووية للهيدروجين والهيليوم إلى أنواع أخرى. في نفوسهم ، تشكل ذرات الهيليوم ذرات كربون. تشكل ذرات الكربون اللاحقة الأكسجين والنيون والصوديوم والمغنيسيوم. في وقت لاحق ، يتحد النيون والأكسجين مع بعضهما البعض لتكوين المغنيسيوم. مع استمرار هذه التفاعلات ، يتم تكوين المزيد والمزيد من العناصر الكيميائية.
الأنظمة الأولى للعناصر الكيميائية
منذ أكثر من 200 عام ، بدأ الكيميائيون في البحث عن طرق لتصنيفها. في منتصف القرن التاسع عشر ، عُرف حوالي 50 عنصرًا كيميائيًا. أحد الأسئلة التي سعى الكيميائيون لحلها. يتلخص في ما يلي: هل العنصر الكيميائي مادة مختلفة تمامًا عن أي عنصر آخر؟ أم أن بعض العناصر مرتبطة ببعضها البعض بطريقة ما؟ ما إذا كان هناك ملف القانون العامالذي يوحدهم؟
اقترح الكيميائيين أنظمة مختلفةالعناصر الكيميائية. لذلك ، على سبيل المثال ، اقترح الكيميائي الإنجليزي ويليام بروت في عام 1815 أن الكتل الذرية لجميع العناصر هي مضاعفات كتلة ذرة الهيدروجين ، إذا أخذناها تساوي واحدًا ، أي يجب أن تكون أعدادًا صحيحة. في ذلك الوقت ، كانت الكتل الذرية للعديد من العناصر قد حُسبت بالفعل بواسطة J.Dalton فيما يتعلق بكتلة الهيدروجين. ومع ذلك ، إذا كان هذا هو الحال تقريبًا بالنسبة للكربون والنيتروجين والأكسجين ، فإن الكلور بكتلة 35.5 لا يتناسب مع هذا المخطط.
أظهر الكيميائي الألماني يوهان فولفجانج دوبرينير (1780-1849) في عام 1829 أن ثلاثة عناصر من مجموعة الهالوجين (الكلور والبروم واليود) يمكن تصنيفها وفقًا لكتلها الذرية النسبية. تبين أن الوزن الذري للبروم (79.9) هو تقريبًا متوسط الأوزان الذرية للكلور (35.5) واليود (127) ، أي 35.5 + 127 2 = 81.25 (قريب من 79.9). كان هذا هو النهج الأول لبناء واحدة من مجموعات العناصر الكيميائية. اكتشف دوبرينر اثنين آخرين من مثل هذه الثلاثيات من العناصر ، لكنه فشل في صياغة قانون دوري عام.
كيف ظهر الجدول الدوري للعناصر الكيميائية؟
لم تكن معظم مخططات التصنيف المبكرة ناجحة جدًا. ثم ، حوالي عام 1869 ، تم الاكتشاف نفسه تقريبًا بواسطة كيميائيين في نفس الوقت تقريبًا. اقترح الكيميائي الروسي دميتري مندليف (1834-1907) والكيميائي الألماني جوليوس لوثار ماير (1830-1895) تنظيم العناصر التي لها نفس العناصر الفيزيائية و الخواص الكيميائية، في نظام منظم من المجموعات والسلاسل والفترات. في الوقت نفسه ، أشار مندليف وماير إلى أن خصائص العناصر الكيميائية تتكرر بشكل دوري اعتمادًا على أوزانها الذرية.
اليوم ، يعتبر منديليف عمومًا هو المكتشف قانون دوريلأنه اتخذ خطوة واحدة لم يفعلها ماير. عندما كانت جميع العناصر موجودة في الجدول الدوري ، ظهرت بعض الفجوات فيه. توقع مندليف أن هذه كانت مواقع لعناصر لم يتم اكتشافها بعد.
ومع ذلك ، ذهب إلى أبعد من ذلك. تنبأ مندليف بخصائص هذه العناصر التي لم تكتشف بعد. كان يعرف مكان وجودهم في الجدول الدوري ، حتى يتمكن من التنبؤ بخصائصهم. من اللافت للنظر أن كل عنصر كيميائي تنبأ به مندليف ، الغاليوم المستقبلي ، سكانديوم ، والجرمانيوم ، تم اكتشافه بعد أقل من عشر سنوات من نشر قانونه الدوري.
شكل قصير من الجدول الدوري
كانت هناك محاولات لحساب عدد متغيرات التمثيل الرسومي للنظام الدوري التي اقترحها علماء مختلفون. اتضح أن أكثر من 500. علاوة على ذلك ، 80٪ الرقم الإجماليالخيارات هي الجداول والباقي الأشكال الهندسيةونتيجة لذلك الاستخدام العمليتم العثور على أربعة أنواع من الجداول: قصيرة وشبه طويلة وطويلة وسلم (هرمي). هذا الأخير اقترحه الفيزيائي العظيم ن. بوهر.
يوضح الشكل أدناه النموذج القصير.

في ذلك ، يتم ترتيب العناصر الكيميائية بترتيب تصاعدي لأعدادها الذرية من اليسار إلى اليمين ومن أعلى إلى أسفل. إذن ، العنصر الكيميائي الأول في الجدول الدوري ، الهيدروجين ، له العدد الذري 1 لأن نوى ذرات الهيدروجين تحتوي على بروتون واحد فقط. وبالمثل ، فإن العدد الذري للأكسجين هو 8 ، لأن نوى جميع ذرات الأكسجين تحتوي على 8 بروتونات (انظر الشكل أدناه).

الأجزاء الهيكلية الرئيسية للنظام الدوري هي فترات ومجموعات من العناصر. في ست فترات ، تمتلئ جميع الخلايا ، والسابع لم يكتمل بعد (العناصر 113 و 115 و 117 و 118 ، على الرغم من توليفها في المختبرات ، لم يتم تسجيلها رسميًا بعد وليس لها أسماء).
تنقسم المجموعات إلى مجموعات فرعية رئيسية (أ) وثانوية (ب). يتم تضمين عناصر الفترات الثلاث الأولى ، التي تحتوي على سطر سلسلة واحد ، حصريًا في المجموعات الفرعية A. تتضمن الفترات الأربع المتبقية صفين لكل منهما.
تميل العناصر الكيميائية في نفس المجموعة إلى أن يكون لها خصائص كيميائية متشابهة. لذلك ، تتكون المجموعة الأولى من الفلزات القلوية ، والثانية - الأرض القلوية. العناصر في نفس الفترة لها خصائص تتغير ببطء من معدن قلوي إلى غاز نبيل. يوضح الشكل أدناه كيف تتغير إحدى الخصائص - نصف القطر الذري - لـ العناصر الفرديةفي الطاولة.
شكل فترة طويلة من الجدول الدوري
وهي موضحة في الشكل أدناه وهي مقسمة إلى اتجاهين ، حسب الصفوف والأعمدة. هناك سبعة صفوف زمنية ، كما في النموذج القصير ، و 18 عمودًا ، تسمى مجموعات أو عائلات. في الواقع ، يتم الحصول على الزيادة في عدد المجموعات من 8 في الشكل القصير إلى 18 في الشكل الطويل عن طريق وضع جميع العناصر في فترات تبدأ من الرابع ، وليس في مجموعتين ، ولكن في سطر واحد.
اثنين أنظمة مختلفةيتم استخدام الترقيم للمجموعات ، كما هو موضح في أعلى الجدول. لطالما كان نظام الأرقام الرومانية (IA ، IIA ، IIB ، IVB ، إلخ) شائعًا في الولايات المتحدة. يتم استخدام نظام آخر (1 ، 2 ، 3 ، 4 ، إلخ) تقليديًا في أوروبا ، وقد تمت التوصية باستخدامه في الولايات المتحدة قبل بضع سنوات.

إن ظهور الجداول الدورية في الأشكال أعلاه مضلل بعض الشيء ، كما هو الحال مع أي جدول منشور من هذا القبيل. والسبب في ذلك هو أن مجموعتي العناصر الموضحة في أسفل الجداول يجب أن تكون موجودة بالفعل داخلهما. تنتمي اللانثانيدات ، على سبيل المثال ، إلى الفترة 6 بين الباريوم (56) والهافنيوم (72). بالإضافة إلى ذلك ، تنتمي الأكتينيدات إلى الفترة 7 بين الراديوم (88) والراذرفورديوم (104). إذا تم لصقها في طاولة ، فسيكون عرضها واسعًا جدًا بحيث لا يمكن وضعها على قطعة من الورق أو مخطط حائط. لذلك ، من المعتاد وضع هذه العناصر في أسفل الجدول.
الجدول الدوري هو واحد من أعظم الاكتشافاتالإنسانية ، مما جعل من الممكن تبسيط المعرفة حول العالم من حولنا واكتشافه عناصر كيميائية جديدة. إنه ضروري لأطفال المدارس ، وكذلك لكل من يهتم بالكيمياء. بالإضافة إلى ذلك ، هذا المخطط لا غنى عنه في مجالات العلوم الأخرى.
هذا الرسم البياني يحتوي على كل شيء معروف للإنسانالعناصر ، ويتم تجميعها وفقًا لـ الكتلة الذرية و رقم سري
. تؤثر هذه الخصائص على خصائص العناصر. في المجموع ، هناك 8 مجموعات في النسخة القصيرة من الجدول ، والعناصر المدرجة في مجموعة واحدة لها خصائص متشابهة للغاية. المجموعة الأولى تحتوي على الهيدروجين والليثيوم والبوتاسيوم والنحاس ، النطق اللاتينيبالروسية وهو cuprum. وكذلك الأرجنتوم - الفضة والسيزيوم والذهب - أوروم وفرانسيوم. المجموعة الثانية تحتوي على البريليوم والمغنيسيوم والكالسيوم والزنك يليها السترونشيوم والكادميوم والباريوم وتنتهي المجموعة بالزئبق والراديوم.
المجموعة الثالثة تشمل البورون والألمنيوم والسكانديوم والجاليوم ثم الإيتريوم والإنديوم واللانثانوم وتنتهي المجموعة بالثاليوم والأكتينيوم. تبدأ المجموعة الرابعة بالكربون والسيليكون والتيتانيوم ، وتستمر مع الجرمانيوم والزركونيوم والقصدير وتنتهي بالهافنيوم والرصاص والروذرفورديوم. في المجموعة الخامسة توجد عناصر مثل النيتروجين والفوسفور والفاناديوم والزرنيخ والنيوبيوم والأنتيمون أدناه ، ثم يأتي البزموت التنتالوم ويكمل مجموعة الدوبنيوم. يبدأ السادس بالأكسجين ، يليه الكبريت ، والكروم ، والسيلينيوم ، ثم الموليبدينوم ، والتيلوريوم ، ثم التنجستن ، والبولونيوم ، والسيبورجيوم.
في المجموعة السابعة ، العنصر الأول هو الفلور ، يليه الكلور ، والمنغنيز ، والبروم ، والتكنيتيوم ، يليه اليود ، ثم الرينيوم ، والأستاتين ، والبوريوم. المجموعة الأخيرة هي الأكثر عددًا. ويشمل غازات مثل الهيليوم والنيون والأرجون والكريبتون والزينون والرادون. تشمل هذه المجموعة أيضًا معادن الحديد والكوبالت والنيكل والروديوم والبلاديوم والروثينيوم والأوزميوم والإيريديوم والبلاتين. يأتي بعد ذلك هانيوم والميتريوم. العناصر التي تتشكل بشكل منفصل سلسلة الأكتينيد وسلسلة اللانثانيد. لديهم خصائص مماثلة اللانثانم والأكتينيوم.

يتضمن هذا المخطط جميع أنواع العناصر ، والتي تنقسم إلى 2 مجموعات كبيرة – المعادن واللافلزاتنأخذ خصائص مختلفة. كيفية تحديد ما إذا كان عنصر ما ينتمي إلى مجموعة معينة ، سيساعد الخط الشرطي ، والذي يجب رسمه من البورون إلى الأستاتين. يجب أن نتذكر أنه لا يمكن رسم هذا الخط إلا النسخة الكاملةالجداول. تعتبر جميع العناصر الموجودة فوق هذا الخط والموجودة في المجموعات الفرعية الرئيسية غير معادن. والتي هي أقل ، في المجموعات الفرعية الرئيسية - المعادن. أيضا ، المعادن هي المواد الموجودة في مجموعات فرعية جانبية. هناك صور وصور خاصة يمكنك من خلالها التعرف على موقع هذه العناصر بالتفصيل. من الجدير بالذكر أن تلك العناصر الموجودة في هذا الخط تظهر نفس خصائص كل من المعادن واللافلزات.
تتكون قائمة منفصلة أيضًا من عناصر مذبذبة ، والتي لها خصائص مزدوجة ويمكن أن تشكل نوعين من المركبات نتيجة للتفاعلات. في الوقت نفسه ، فإنها تظهر على حد سواء الأساسية و خصائص الحمض. تعتمد غلبة خصائص معينة على ظروف التفاعل والمواد التي يتفاعل معها العنصر المذبذب.

وتجدر الإشارة إلى أن هذا المخطط في التنفيذ التقليدي ذو الجودة الجيدة هو اللون. حيث ألوان مختلفةلسهولة التوجيه يتم وضع علامة عليها المجموعات الفرعية الرئيسية والثانوية. وأيضًا يتم تجميع العناصر اعتمادًا على تشابه خصائصها.
ومع ذلك ، في الوقت الحاضر ، إلى جانب نظام الألوان ، يعد الجدول الدوري بالأبيض والأسود لمندليف شائعًا جدًا. يستخدم هذا النموذج للطباعة بالأبيض والأسود. على الرغم من التعقيد الظاهر ، فإن العمل معه مريح بنفس القدر ، بالنظر إلى بعض الفروق الدقيقة. لذلك ، في هذه الحالة ، من الممكن التمييز بين المجموعة الفرعية الرئيسية والمجموعة الثانوية من خلال الاختلافات في الظلال التي يمكن رؤيتها بوضوح. بالإضافة إلى ذلك ، في النسخة الملونة ، يشار إلى العناصر التي بها إلكترونات على طبقات مختلفة ألوان مختلفة.
تجدر الإشارة إلى أنه في تصميم أحادي اللون ، ليس من الصعب جدًا التنقل في المخطط. لهذا ، ستكون المعلومات المشار إليها في كل خلية فردية من العنصر كافية.

الامتحان اليوم هو النوع الرئيسي للاختبار في نهاية المدرسة ، مما يعني أنه يجب التحضير له انتباه خاص. لذلك ، عند الاختيار الامتحان النهائي في الكيمياء، عليك الانتباه إلى المواد التي يمكن أن تساعد في توصيلها. كقاعدة عامة ، يُسمح للطلاب باستخدام بعض الجداول أثناء الاختبار ، ولا سيما الجدول الدوري في جودة جيدة. لذلك ، لكي تحقق الفائدة فقط في الاختبارات ، يجب الانتباه مسبقًا إلى هيكلها ودراسة خصائص العناصر ، بالإضافة إلى تسلسلها. أنت أيضا بحاجة إلى التعلم استخدم النسخة بالأبيض والأسود من الجدولحتى لا تواجه أي صعوبات في الامتحان.

بالإضافة إلى الجدول الرئيسي الذي يصف خصائص العناصر واعتمادها على الكتلة الذرية ، هناك مخططات أخرى يمكن أن تساعد في دراسة الكيمياء. على سبيل المثال ، هناك جداول الذوبان والكهرسلبية للمواد. يمكن أن يحدد الأول مدى قابلية مركب معين للذوبان في الماء عند درجة الحرارة العادية. في هذه الحالة ، توجد الأنيونات أفقيًا - توجد أيونات سالبة الشحنة ، وتقع الكاتيونات ، أي الأيونات الموجبة الشحنة ، عموديًا. تجده في الخارج درجة الذوبانلمركب أو آخر ، من الضروري إيجاد مكوناته في الجدول. وفي مكان تقاطعهم سيكون هناك التعيين الضروري.
إذا كان الحرف "p" ، فإن المادة قابلة للذوبان تمامًا في الماء الظروف الطبيعية. في وجود الحرف "m" - المادة قابلة للذوبان بشكل طفيف ، وفي وجود الحرف "n" - تكاد لا تذوب. إذا كانت هناك علامة "+" ، فإن المركب لا يشكل راسبًا ويتفاعل مع المذيب بدون بقايا. في حالة وجود علامة "-" ، فهذا يعني أن هذه المادة غير موجودة. في بعض الأحيان يمكنك أيضًا رؤية علامة "؟" في الجدول ، فهذا يعني أن درجة ذوبان هذا المركب غير معروفة على وجه اليقين. كهرسلبية العناصريمكن أن تختلف من 1 إلى 8 ، وهناك أيضًا جدول خاص لتحديد هذه المعلمة.
 جدول مفيد آخر هو سلسلة النشاط المعدني. توجد جميع المعادن فيه عن طريق زيادة درجة الإمكانات الكهروكيميائية. تبدأ سلسلة من معادن الإجهاد بالليثيوم ، وتنتهي بالذهب. يُعتقد أنه كلما زاد احتلال المعدن إلى اليسار في هذا الصف ، زاد نشاطه في التفاعلات الكيميائية. في هذا الطريق، عظم معدن نشط
يعتبر الليثيوم معدنًا قلويًا. يوجد الهيدروجين أيضًا في نهاية قائمة العناصر. يُعتقد أن المعادن الموجودة بعده غير نشطة عمليًا. من بينها عناصر مثل النحاس والزئبق والفضة والبلاتين والذهب.
جدول مفيد آخر هو سلسلة النشاط المعدني. توجد جميع المعادن فيه عن طريق زيادة درجة الإمكانات الكهروكيميائية. تبدأ سلسلة من معادن الإجهاد بالليثيوم ، وتنتهي بالذهب. يُعتقد أنه كلما زاد احتلال المعدن إلى اليسار في هذا الصف ، زاد نشاطه في التفاعلات الكيميائية. في هذا الطريق، عظم معدن نشط
يعتبر الليثيوم معدنًا قلويًا. يوجد الهيدروجين أيضًا في نهاية قائمة العناصر. يُعتقد أن المعادن الموجودة بعده غير نشطة عمليًا. من بينها عناصر مثل النحاس والزئبق والفضة والبلاتين والذهب.
صور الجدول الدوري بجودة جيدة
هذا المخطط هو أحد أعظم الإنجازات في مجال الكيمياء. حيث هناك أنواع عديدة من هذا الجدول.- نسخة قصيرة وطويلة وطويلة جدًا. الأكثر شيوعًا هو الجدول القصير ، والإصدار الطويل من المخطط شائع أيضًا. تجدر الإشارة إلى أن الإصدار المختصر من المخطط لا ينصح باستخدامه حاليًا من قبل IUPAC.
كان المجموع تم تطوير أكثر من مائة نوع من الجداول، والتي تختلف في العرض ، والشكل ، والتمثيل الرسومي. يتم استخدامها في مختلف مجالات العلوم ، أو لا تستخدم على الإطلاق. حاليًا ، يواصل الباحثون تطوير تكوينات الدوائر الجديدة. كخيار رئيسي ، يتم استخدام دائرة قصيرة أو طويلة بجودة ممتازة.
بمعرفة صياغة القانون الدوري واستخدام النظام الدوري لعناصر D. I. Mendeleev ، يمكن للمرء أن يميز أي عنصر كيميائي ومركباته. من الملائم إضافة مثل هذه الخاصية لعنصر كيميائي وفقًا للخطة.
I. رمز العنصر الكيميائي واسمه.
II. موضع العنصر الكيميائي في النظام الدوريالعناصر D.I. منديليف:
- رقم سري؛
- رقم الفترة
- رقم المجموعة؛
- مجموعة فرعية (رئيسية أو ثانوية).
ثالثا. هيكل ذرة عنصر كيميائي:
- شحنة نواة الذرة.
- نسبيا الكتلة الذريةعنصر كيميائي؛
- عدد البروتونات
- عدد الإلكترونات
- عدد النيوترونات
- عدد المستويات الإلكترونية في الذرة.
رابعا. الصيغ الإلكترونية والرسومات الإلكترونية للذرة وإلكترونات التكافؤ الخاصة بها.
نوع العنصر الكيميائي (معدن أو غير معدني ، s- ، p- ، d- أو f- عنصر).
السادس. صيغ أكسيد وهيدروكسيد عنصر كيميائي أعلى ، خصائص خصائصها (قاعدية ، حمضية أو مذبذبة).
سابعا. مقارنة الخصائص المعدنية أو غير المعدنية لعنصر كيميائي بخصائص العناصر المجاورة حسب الفترة والمجموعة الفرعية.
ثامنا. حالة الأكسدة القصوى والدنيا للذرة.
على سبيل المثال ، دعنا نوفر خاصية عنصر كيميائي برقم تسلسلي 15 ومركباته وفقًا للموضع في النظام الدوري لعناصر D. I. Mendeleev وهيكل الذرة.
I. نجد في جدول D. I. Mendeleev خلية تحتوي على رقم عنصر كيميائي ، اكتب رمزها واسمها.
العنصر الكيميائي رقم 15 هو الفوسفور. رمزها هو R.
II. دعونا نميز موضع العنصر في جدول D. I. Mendeleev (رقم الفترة ، المجموعة ، نوع المجموعة الفرعية).
يقع الفوسفور في المجموعة الفرعية الرئيسية للمجموعة الخامسة ، في الفترة الثالثة.
ثالثا. دعونا نقدم وصفًا عامًا لتكوين ذرة عنصر كيميائي (الشحنة النووية والكتلة الذرية وعدد البروتونات والنيوترونات والإلكترونات والمستويات الإلكترونية).
الشحنة النووية لذرة الفوسفور هي +15. الكتلة الذرية النسبية للفوسفور هي 31. تحتوي نواة الذرة على 15 بروتونًا و 16 نيوترونًا (31 - 15 = 16). تحتوي ذرة الفوسفور على ثلاثة مستويات للطاقة مع 15 إلكترونًا.
رابعا. نؤلف الصيغ الإلكترونية والرسومات الإلكترونية للذرة ، ونضع علامة على إلكترونات التكافؤ.
الصيغة الإلكترونية لذرة الفوسفور هي: 15 P 1s 2 2s 2 2p 6 3s 2 3p 3.
صيغة الرسم الإلكتروني للمستوى الخارجي لذرة الفوسفور: على مستوى الطاقة الثالث ، يوجد إلكترونان على المستوى الفرعي 3s (سهمان مع الاتجاه المعاكس مكتوبان في خلية واحدة) ، وثلاثة إلكترونات على p- المستوى الفرعي (في كل خلية من الخلايا الثلاث ، سهم واحد يشير في نفس الاتجاه).
إلكترونات التكافؤ هي إلكترونات من المستوى الخارجي ، أي 3s2 3p3 إلكترونات.
V. تحديد نوع العنصر الكيميائي (معدن أو غير معدني ، s- ، p- ، d- أو f- عنصر).
الفوسفور مادة غير معدنية. نظرًا لأن المستوى الفرعي الأخير في ذرة الفوسفور ، المليء بالإلكترونات ، هو المستوى الفرعي p ، فإن الفوسفور ينتمي إلى عائلة العناصر p.
السادس. نضع الصيغ لأكسيد وهيدروكسيد الفوسفور الأعلى ونميز خصائصها (قاعدية ، حمضية أو مذبذبة).
يظهر أعلى أكسيد الفوسفور P 2 O 5 خصائص أكسيد الحمض. يعرض الهيدروكسيد المقابل للأكسيد الأعلى ، H 3PO4 ، خصائص الحمض. نؤكد هذه الخصائص مع معادلات أنواع التفاعلات الكيميائية:
P 2 O 5 + 3 Na 2 O \ u003d 2Na 3 PO 4
H 3 PO 4 + 3 NaOH \ u003d Na 3 PO 4 + 3H 2 O
سابعا. دعنا نقارن الخصائص غير المعدنية للفوسفور بخصائص العناصر المجاورة حسب الفترة والمجموعة الفرعية.
جار الفوسفور في المجموعة الفرعية هو النيتروجين. جيران الفوسفور خلال هذه الفترة هم السيليكون والكبريت. الخصائص غير المعدنية لذرات العناصر الكيميائية للمجموعات الفرعية الرئيسية مع زيادة الرقم التسلسلي المتزايد في الفترات والنقص في المجموعات. لذلك ، تكون الخصائص غير المعدنية للفوسفور أكثر وضوحًا من خصائص السيليكون وأقل وضوحًا من خصائص النيتروجين والكبريت.
ثامنا. تحديد أقصى وأدنى حالة أكسدة لذرة الفوسفور.
أقصى درجة ايجابيةأكسدة العناصر الكيميائية للمجموعات الفرعية الرئيسية تساوي رقم المجموعة. يقع الفوسفور في المجموعة الفرعية الرئيسية للمجموعة الخامسة ، وبالتالي فإن أقصى حالة أكسدة للفوسفور هي +5.
الحد الأدنى من حالة الأكسدة لغير المعادن في معظم الحالات يساوي الفرق بين رقم المجموعة ورقم ثمانية. لذا ، فإن أدنى حالة أكسدة للفوسفور هي -3.
الجدول الدوري لمندلييف
يتوافق بناء الجدول الدوري للعناصر الكيميائية لمندليف مع الفترات المميزة لنظرية الأعداد والقواعد المتعامدة. تكملة مصفوفات Hadamard بمصفوفات من الرتب الفردية والزوجية تخلق أساسًا هيكليًا لعناصر المصفوفة المتداخلة: مصفوفات الرتب الأولى (Odin) والثانية (Euler) والثالثة (Mersenne) والرابعة (Hadamard) والخامسة (Fermat).
من السهل أن نرى أن المقدار 4 كتتوافق مصفوفات هادامارد مع عناصر خاملة ذات كتلة ذرية مضاعفة لأربعة: الهليوم 4 ، نيون 20 ، الأرجون 40 (39.948) ، إلخ ، ولكن أيضًا أسس الحياة والتكنولوجيا الرقمية: الكربون 12 ، الأكسجين 16 ، السيليكون 28 ، الجرمانيوم 72.
يبدو أنه مع مصفوفات أوامر ميرسين 4 ك-1 ، على العكس من ذلك ، كل شيء نشط ، سام ، مدمر ومسبب للتآكل. لكن هذه أيضًا عناصر مشعة - مصادر للطاقة ، والرصاص 207 (المنتج النهائي ، أملاح سامة). الفلور ، بالطبع ، هو 19. تتوافق أوامر مصفوفات ميرسين مع سلسلة من العناصر المشعة تسمى سلسلة الأكتينيوم: اليورانيوم 235 ، والبلوتونيوم 239 (النظير الذي يعد مصدرًا أقوى للطاقة الذرية من اليورانيوم) ، إلخ. هو نفسه الفلزات القلويةالليثيوم 7 والصوديوم 23 والبوتاسيوم 39.

الغاليوم - الوزن الذري 68
الطلبات 4 ك–2 مصفوفات أويلر (ميرسين مزدوجة) تتوافق مع النيتروجين 14 (القاعدة الجوية). يتكون ملح الطعام من ذرتين من الصوديوم 23 والكلور 35 "شبيهة بمرسين" ، وهذا المزيج نموذجي ، فقط لمصفوفات أويلر. الكلور الأكثر ضخامة بوزن 35.4 أقل قليلاً من بُعد Hadamard البالغ 36. بلورات الملح الشائعة: مكعب (! على سبيل المثال ، شخصية وديعة ، Hadamars) وثماني الوجوه (أكثر تحديًا ، هذا بلا شك أويلر).
في الفيزياء الذريةانتقال الحديد 56 - النيكل 59 ، هذا هو الحد الفاصل بين العناصر التي توفر الطاقة أثناء تخليق نواة أكبر ( قنبلة هيدروجينية) والاضمحلال (اليورانيوم). يشتهر الترتيب 58 بحقيقة أنه لا يوجد فقط نظائر لمصفوفات Hadamard في شكل مصفوفات Belevich مع أصفار على القطر ، كما أنه لا يوجد العديد من المصفوفات الموزونة له - أقرب متعامد W (58،53) يحتوي على 5 أصفار في كل عمود وصف (فجوة عميقة).
في السلسلة المقابلة لمصفوفات فيرما وبدائلها من الرتب 4 ك+1 ، تكلف 257 فيرمي بإرادة القدر. لا يمكنك قول أي شيء ، ضربة دقيقة. هنا ذهب 197. النحاس 64 (63.547) والفضة 108 (107.868) ، رموز الإلكترونيات ، على ما يبدو لا تصل إلى الذهب وتتوافق مع مصفوفات هادامارد الأكثر تواضعًا. النحاس ، بوزنه الذري الذي لا يبعد عن 63 ، نشط كيميائيًا - أكاسيده الخضراء معروفة جيدًا.

بلورات البورون تحت التكبير العالي
من النسبة الذهبيةالبورون متصل - الكتلة الذرية بين جميع العناصر الأخرى هي الأقرب إلى 10 (بتعبير أدق ، 10.8 ، يؤثر أيضًا قرب الوزن الذري من الأعداد الفردية). البورون عنصر معقد إلى حد ما. يلعب بوهر دورًا محيرًا في تاريخ الحياة نفسها. هيكل الإطار في هياكله أكثر تعقيدًا بكثير مما هو عليه في الماس. النوع الفريد من الروابط الكيميائية التي تسمح للبورون بامتصاص أي شوائب غير مفهوم جيدًا ، على الرغم من البحث المرتبط به عدد كبير منلقد تلقى العلماء بالفعل جوائز نوبل. شكل بلورة البورون هو عشري الوجوه ، خمسة مثلثات تشكل قمة.
لغز البلاتين. العنصر الخامس هو بلا شك المعادن النبيلة مثل الذهب. التعليق فوق Hadamard البعد 4 ك، ل 1 كبير.

نظير اليورانيوم المستقر 238
تذكر ، مع ذلك ، أن أرقام فيرما نادرة (أقربها 257). بلورات الذهب الأصلية لها شكل قريب من المكعب ، لكن النجم الخماسي يتألق أيضًا. أقرب جيرانه ، البلاتين ، معدن نبيل ، يقل وزنه الذري عن الذهب بأربع مرات أقل من 197. البلاتين له وزن ذري ليس 193 ، ولكنه زاد إلى حد ما ، 194 (ترتيب مصفوفات أويلر). تافه ، لكنه يجلبها إلى معسكر بعض العناصر الأكثر عدوانية. يجدر بنا أن نتذكر ، بسبب خمولها (يذوب ، ربما ، في أكوا ريجيا) ، يستخدم البلاتين كمحفز نشط العمليات الكيميائية.
البلاتين الإسفنجي يشعل الهيدروجين في درجة حرارة الغرفة. طبيعة البلاتين ليست سلمية على الإطلاق ، الإيريديوم 192 يتصرف بهدوء أكثر (خليط من النظائر 191 و 193). إنه أشبه بالنحاس ، لكن له وزن وشخصية الذهب.
بين النيون 20 والصوديوم 23 لا يوجد عنصر بوزن ذري 22. بالطبع ، تعتبر الأوزان الذرية خاصية متكاملة. ولكن من بين النظائر ، يوجد أيضًا ارتباط غريب للخصائص بخصائص الأعداد والمصفوفات المقابلة للقواعد المتعامدة. كما وقود نووي أعظم تطبيقلديه نظير اليورانيوم 235 (ترتيب مصفوفة ميرسين) ، حيث يكون من الممكن حدوث تفاعل نووي متسلسل ذاتي الاستدامة. في الطبيعة ، يحدث هذا العنصر في شكل مستقر اليورانيوم 238 (ترتيب مصفوفات أويلر). لا يوجد عنصر بوزن ذري 13. بالنسبة للفوضى ، يرتبط العدد المحدود للعناصر المستقرة في الجدول الدوري وصعوبة العثور على مصفوفات المستوى العالي بسبب الحاجز الذي يظهر في مصفوفات الرتبة الثالثة عشر.

نظائر العناصر الكيميائية ، جزيرة الاستقرار