Kas lankė mokyklą, prisimena, kad vienas iš privalomų mokytis dalykų buvo chemija. Jai tai gali patikti arba nepatikti – nesvarbu. Ir tikėtina, kad daug žinių šioje disciplinoje jau pamiršta ir gyvenime nepritaikoma. Tačiau lentelė cheminiai elementai Visi tikriausiai prisimena D. I. Mendelejevą. Daugeliui tai išliko įvairiaspalvė lentelė, kur kiekviename kvadrate įrašytos tam tikros raidės, žyminčios cheminių elementų pavadinimus. Bet čia mes nekalbėsime apie chemiją kaip tokią, o aprašysime šimtus cheminių reakcijų ir procesų, o kalbėsime apie tai, kaip apskritai atsirado periodinė lentelė - ši istorija bus įdomi bet kuriam žmogui, o iš tikrųjų visiems norintiems. įdomi ir naudinga informacija.
Šiek tiek fono
Dar 1668 m. žymus airių chemikas, fizikas ir teologas Robertas Boyle'as išleido knygą, kurioje buvo paneigta daugybė mitų apie alchemiją ir kurioje jis kalbėjo apie būtinybę ieškoti nesuyrančių cheminių elementų. Mokslininkas taip pat pateikė jų sąrašą, susidedantį tik iš 15 elementų, tačiau leido manyti, kad elementų gali būti ir daugiau. Tai tapo Atspirties taškas ne tik ieškant naujų elementų, bet ir sisteminant.
Po šimto metų prancūzų chemikas Antoine'as Lavoisier sudarė naujas sąrašas, kuriame jau buvo 35 elementai. 23 iš jų vėliau buvo nustatyti kaip nesuyrantys. Tačiau mokslininkai visame pasaulyje tęsė naujų elementų paieškas. Ir Pagrindinis vaidmuošiame procese vaidino garsus rusų chemikas Dmitrijus Ivanovičius Mendelejevas – jis pirmasis iškėlė hipotezę, kad gali būti ryšys tarp elementų atominės masės ir jų išsidėstymo sistemoje.
Dėl kruopštaus darbo ir cheminių elementų palyginimo Mendelejevas sugebėjo atrasti ryšį tarp elementų, kuriuose jie gali būti vienas, o jų savybės nėra savaime suprantamas dalykas, o periodiškai pasikartojantis reiškinys. Dėl to 1869 m. vasarį Mendelejevas suformulavo pirmąjį periodinį įstatymą, o jau kovo mėnesį chemijos istorikas N. A. Menšutkinas Rusijos chemijos draugijai pateikė jo pranešimą „Savybių santykis su elementų atominiu svoriu“. Tada tais pačiais metais Mendelejevo publikacija buvo paskelbta žurnale Zeitschrift fur Chemie Vokietijoje, o 1871-aisiais kitas Vokietijos žurnalas Annalen der Chemie paskelbė naują platų mokslininko leidinį, skirtą jo atradimui.
Periodinės lentelės kūrimas

Pagrindinę idėją 1869 m. jau suformavo Mendelejevas ir gana trumpam laikui, bet jis ilgai negalėjo to sutvarkyti į kažkokią tvarkingą sistemą, kuri aiškiai parodytų, kas yra kas. Viename iš pokalbių su kolega A. A. Inostrantsevu jis net sakė, kad jo galvoje jau viskas susitvarkė, tačiau visko sunešti ant stalo negalėjo. Po to, pasak Mendelejevo biografų, jis pradėjo kruopštus darbas virš jo stalo, kuris truko tris dienas be pertraukų miegoti. Buvo sutvarkyti visokie būdai elementams tvarkyti lentelėje, o darbą apsunkino tai, kad tuo metu mokslas dar nežinojo apie visus cheminius elementus. Tačiau, nepaisant to, lentelė vis tiek buvo sukurta, o elementai buvo susisteminti.
Mendelejevo sapno legenda
Daugelis girdėjo istoriją, kad D. I. Mendelejevas svajojo apie savo stalą. Šią versiją aktyviai platino minėtas Mendelejevo kolega A. A. Inostrancevas kaip linksma istorija kuriais linksmino savo mokinius. Jis sakė, kad Dmitrijus Ivanovičius nuėjo miegoti ir sapne aiškiai matė savo stalą, kuriame visi cheminiai elementai buvo išdėstyti tinkama tvarka. Po to mokiniai net juokavo, kad lygiai taip pat buvo atrasta 40° degtinė. Tačiau miego istorijai vis dar buvo tikros prielaidos: kaip jau minėta, Mendelejevas dirbo ant stalo nemiegodamas ir nepailsėjęs, o Inostrancevas kartą rado jį pavargusį ir išsekusį. Po pietų Mendelejevas nusprendė padaryti pertrauką, o po kurio laiko staiga pabudo, iškart paėmė popieriaus lapą ir ant jo pavaizdavo jau paruoštą stalą. Tačiau pats mokslininkas visą šią istoriją paneigė sapnu sakydamas: „Gal dvidešimt metų galvoju apie tai, o tu galvoji: aš sėdėjau ir staiga... jau paruošta“. Taigi svajonės legenda gali būti labai patraukli, tačiau stalą sukurti pavyko tik sunkiai dirbant.

Tolesnis darbas
1869–1871 m. Mendelejevas plėtojo periodiškumo idėjas, į kurias buvo linkusi mokslo bendruomenė. Ir vienas iš etapaiŠis procesas buvo supratimas, kurį turi turėti bet kuris sistemos elementas, remiantis jo savybių visuma, palyginti su kitų elementų savybėmis. Remdamasis tuo, taip pat remdamasis stiklą formuojančių oksidų kaitos tyrimų rezultatais, chemikui pavyko pakeisti kai kurių elementų, tarp kurių buvo uranas, indis, berilis ir kt., atominių masių vertes.
Žinoma, Mendelejevas norėjo kuo greičiau užpildyti tuščias lentelėje likusias ląsteles, o 1870 metais numatė, kad netrukus bus atrasti mokslui nežinomi cheminiai elementai, kurių atomines mases ir savybes jis sugebėjo apskaičiuoti. Pirmieji iš jų buvo galis (atrastas 1875 m.), skandis (atrastas 1879 m.) ir germanis (atrastas 1885 m.). Tada prognozės ir toliau pildėsi ir buvo atrasti dar aštuoni nauji elementai, tarp jų: polonis (1898), renis (1925), technecis (1937), francis (1939) ir astatinas (1942-1943). Beje, 1900 metais D. I. Mendelejevas ir škotų chemikas Williamas Ramsay priėjo prie išvados, kad į lentelę turėtų būti įtraukti ir nulinės grupės elementai – iki 1962 metų jie buvo vadinami inertinėmis, o vėliau – tauriosiomis dujomis.
Periodinės sistemos organizavimas
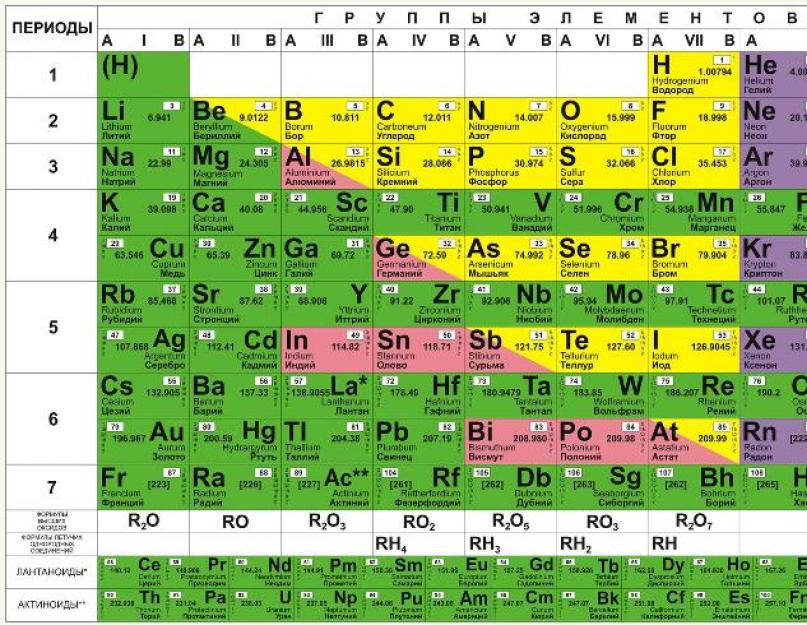
Cheminiai elementai D. I. Mendelejevo lentelėje išdėstyti eilėmis, atsižvelgiant į jų masės padidėjimą, o eilučių ilgis parenkamas taip, kad juose esantys elementai turėtų panašias savybes. Pavyzdžiui, tauriosios dujos, tokios kaip radonas, ksenonas, kriptonas, argonas, neonas ir helis, nelengvai reaguoja su kitais elementais, taip pat turi mažą cheminį aktyvumą, todėl jos yra dešiniajame stulpelyje. O kairiojo stulpelio elementai (kalis, natris, litis ir kt.) puikiai reaguoja su kitais elementais, o pačios reakcijos yra sprogstamos. Paprasčiau tariant, kiekviename stulpelyje elementai turi panašias savybes, kurios skiriasi kiekviename stulpelyje. Visi elementai iki Nr.92 randami gamtoje, o su Nr.93 prasideda dirbtiniai elementai, kuriuos galima sukurti tik laboratorijoje.
Pradiniame variante periodinė sistema buvo suprantama tik kaip gamtoje egzistuojančios tvarkos atspindys ir nebuvo paaiškinimų, kodėl viskas taip turi būti. Ir tik tada, kai atsirado kvantinė mechanika, tikroji prasmė paaiškėjo elementų tvarka lentelėje.
Kūrybinio proceso pamokos
Kalbant apie tai, kokias kūrybinio proceso pamokas galima pasisemti iš visos D. I. Mendelejevo periodinės lentelės kūrimo istorijos, kaip pavyzdį galima pateikti anglų tyrinėtojo kūrybinio mąstymo srityje Grahamo Wallace ir prancūzų mokslininko idėjas. Henri Poincaré. Paimkime juos trumpai.
Poincaré (1908) ir Graham Wallace (1926) teigimu, yra keturi pagrindiniai kūrybinio mąstymo etapai:
- Treniruotės- pagrindinės užduoties formulavimo etapas ir pirmieji bandymai ją išspręsti;
- Inkubavimas- etapas, kurio metu laikinai atitraukiamas dėmesys nuo proceso, tačiau darbas ieškant problemos sprendimo atliekamas pasąmonės lygmeniu;
- įžvalga- etapas, kuriame intuityvus sprendimas. Be to, šį sprendimą galima rasti situacijoje, kuri visiškai nesusijusi su užduotimi;
- Apžiūra- sprendimo testavimo ir diegimo etapas, kuriame vyksta šio sprendimo patikrinimas ir galimas tolesnis jo tobulinimas.
Kaip matome, kurdamas lentelę Mendelejevas intuityviai laikėsi šių keturių etapų. Kiek tai efektyvu, galima spręsti iš rezultatų, t.y. nes buvo sukurta lentelė. O atsižvelgiant į tai, kad jo sukūrimas buvo didžiulis žingsnis į priekį ne tik chemijos mokslui, bet ir visai žmonijai, minėtus keturis etapus galima pritaikyti tiek mažų projektų įgyvendinimui, tiek globalių planų įgyvendinimui. Svarbiausia atsiminti, kad nei vieno atradimo, nei vieno problemos sprendimo negalima rasti savarankiškai, kad ir kaip norėtume juos matyti sapne ir kiek miegotume. Kad pasisektų, nesvarbu, ar tai būtų cheminių elementų lentelės sukūrimas, ar naujo rinkodaros plano kūrimas, reikia turėti tam tikrų žinių ir įgūdžių, taip pat sumaniai išnaudoti savo potencialą ir sunkiai dirbti.
Linkime sėkmės jūsų pastangose ir sėkmingas įgyvendinimasįsivaizduojamas!
Cheminis elementas yra bendras terminas, apibūdinantis atomų rinkinį paprasta medžiaga, t.y., kurio negalima suskirstyti į jokius paprastesnius (pagal jų molekulių sandarą) komponentus. Įsivaizduokite, kad gaunate grynos geležies gabalėlį su prašymu padalyti jį į hipotetines sudedamąsias dalis, naudojant bet kokį chemikų sugalvotą prietaisą ar metodą. Tačiau nieko nepadarysi, lygintuvas niekada nebus padalintas į ką nors paprastesnio. Paprasta medžiaga – geležis – atitinka cheminį elementą Fe.
Teorinis apibrėžimas
Aukščiau pažymėtą eksperimentinį faktą galima paaiškinti naudojant tokį apibrėžimą: cheminis elementas yra atitinkamos paprastos medžiagos, t. y. to paties tipo atomų, abstraktus atomų (ne molekulių!) rinkinys. Jei būtų galimybė pažvelgti į kiekvieną atskirą atomą aukščiau minėtame grynos geležies gabale, tada jie visi būtų vienodi – geležies atomai. Priešingai nei tai, cheminis junginys, pavyzdžiui, geležies oksidas, visada turi bent du skirtingos rūšies atomai: geležies atomai ir deguonies atomai.
Sąlygos, kurias turėtumėte žinoti
Atominė masė: protonų, neutronų ir elektronų, sudarančių cheminio elemento atomą, masė.
atominis skaičius: protonų skaičius elemento atomo branduolyje.
cheminis simbolis: raidė arba pora lotyniškos raidės A, kuris reiškia šio elemento simbolį.
Cheminis junginys: medžiaga, kurią sudaro du ar daugiau cheminių elementų, sujungtų vienas su kitu tam tikra proporcija.
Metalas: Elementas, kuris praranda elektronus cheminėse reakcijose su kitais elementais.
Metaloidas: Elementas, kuris kartais reaguoja kaip metalas, o kartais kaip nemetalas.
Nemetaliniai: elementas, kuris linkęs įgyti elektronų cheminės reakcijos su kitais elementais.
Periodinė cheminių elementų sistema: cheminių elementų klasifikavimo pagal jų atominį skaičių sistema.
sintetinis elementas: toks, kuris gaunamas dirbtinai laboratorijoje, o gamtoje dažniausiai nebūna.

Natūralūs ir sintetiniai elementai
Žemėje natūraliai randami devyniasdešimt du cheminiai elementai. Likusi dalis buvo gauta dirbtinai laboratorijose. Sintetinis cheminis elementas paprastai yra branduolinių reakcijų produktas dalelių greitintuvuose (prietaisai, naudojami subatominių dalelių, pvz., elektronų ir protonų, greičiui padidinti) arba branduoliniai reaktoriai(prietaisai, naudojami branduolinių reakcijų metu išsiskiriančiai energijai valdyti). Pirmasis sintetinis elementas, gautas atominiu numeriu 43, buvo technecis, kurį 1937 metais atrado italų fizikai C. Perrier ir E. Segre. Be technecio ir prometio, visi sintetiniai elementai turi didesnius branduolius nei urano. Paskutinis įvardytas sintetinis elementas yra livermoriumas (116), o prieš tai buvo fleroviumas (114).

Dvi dešimtys bendrų ir svarbių elementų
| vardas | Simbolis | Visų atomų procentas * | Cheminių elementų savybės (įprastomis kambario sąlygomis) |
|||
| Visatoje | Žemės plutoje | Jūros vandenyje | Žmogaus kūne |
|||
| Aliuminis | Al | - | 6,3 | - | - | Lengvas, sidabrinis metalas |
| Kalcis | Ca | - | 2,1 | - | 0,02 | Įeina į natūralius mineralus, kriaukles, kaulus |
| Anglies | NUO | - | - | - | 10,7 | Visų gyvų organizmų pagrindas |
| Chloras | Cl | - | - | 0,3 | - | nuodingų dujų |
| Varis | Cu | - | - | - | - | Tik raudonas metalas |
| Auksas | Au | - | - | - | - | Tik geltonas metalas |
| Helis | Jis | 7,1 | - | - | - | Labai lengvos dujos |
| Vandenilis | H | 92,8 | 2,9 | 66,2 | 60,6 | Lengviausias iš visų elementų; dujų |
| Jodas | aš | - | - | - | - | Nemetaliniai; naudojamas kaip antiseptikas |
| Geležis | Fe | - | 2,1 | - | - | Magnetinis metalas; naudojamas geležies ir plieno gamybai |
| Vadovauti | Pb | - | - | - | - | Minkštas, sunkus metalas |
| Magnis | mg | - | 2,0 | - | - | Labai lengvas metalas |
| Merkurijus | hg | - | - | - | - | Skystas metalas; vienas iš dviejų skystų elementų |
| Nikelis | Ni | - | - | - | - | korozijai atsparus metalas; naudojamas monetose |
| Azotas | N | - | - | - | 2,4 | Dujos, pagrindinė oro sudedamoji dalis |
| Deguonis | O | - | 60,1 | 33,1 | 25,7 | Dujos, antras svarbus dalykas oro komponentas |
| Fosforas | R | - | - | - | 0,1 | Nemetaliniai; svarbu augalams |
| Kalis | Į | - | 1.1 | - | - | Metalas; svarbu augalams; paprastai vadinamas "kaliu" |
* Jei reikšmė nenurodyta, tai elementas yra mažesnis nei 0,1 proc.
Didysis sprogimas kaip pagrindinė materijos susidarymo priežastis
Koks cheminis elementas buvo pirmasis visatoje? Mokslininkai mano, kad atsakymas į šį klausimą slypi žvaigždėse ir žvaigždžių formavimosi procesuose. Manoma, kad visata atsirado tam tikru metu prieš 12–15 milijardų metų. Iki šios akimirkos niekas, kas egzistuoja, išskyrus energiją, nėra sumanyta. Tačiau atsitiko kažkas, kas šią energiją pavertė didžiuliu sprogimu (vadinamuoju Didžiuoju sprogimu). Per kitas sekundes po Didysis sprogimas pradėjo formuotis materija.
Pirmosios paprasčiausios materijos formos buvo protonai ir elektronai. Kai kurie iš jų yra sujungti į vandenilio atomus. Pastarasis susideda iš vieno protono ir vieno elektrono; tai paprasčiausias atomas, koks tik gali egzistuoti.

Lėtai, per ilgą laiką, tam tikruose erdvės regionuose pradėjo burtis vandenilio atomai, sudarydami tankius debesis. Šiuose debesyse esantis vandenilis gravitacinių jėgų buvo ištrauktas į kompaktiškus darinius. Galiausiai šie vandenilio debesys tapo pakankamai tankūs, kad susidarytų žvaigždės.
Žvaigždės kaip naujų elementų cheminiai reaktoriai
Žvaigždė yra tiesiog materijos masė, kuri generuoja branduolinių reakcijų energiją. Dažniausia iš šių reakcijų yra keturių vandenilio atomų derinys, kad susidarytų vienas helio atomas. Kai tik pradėjo formuotis žvaigždės, helis tapo antruoju visatoje pasirodžiusiu elementu.
Kai žvaigždės sensta, jos pereina nuo vandenilio ir helio branduolinių reakcijų prie kitų tipų. Juose helio atomai sudaro anglies atomus. Vėliau anglies atomai susidaro deguonies, neono, natrio ir magnio. Dar vėliau neonas ir deguonis susijungia vienas su kitu ir sudaro magnį. Vykstant šioms reakcijoms, susidaro vis daugiau cheminių elementų.
Pirmosios cheminių elementų sistemos
Daugiau nei prieš 200 metų chemikai pradėjo ieškoti būdų, kaip juos klasifikuoti. Devynioliktojo amžiaus viduryje buvo žinoma apie 50 cheminių elementų. Vienas iš klausimų, kurį siekė išspręsti chemikai. suvesti į šiuos dalykus: ar cheminis elementas yra visiškai kitokia medžiaga nei bet kuris kitas elementas? O gal kai kurie elementai yra kažkaip susiję su kitais? Ar yra a bendroji teisė kas juos vienija?
Chemikai pasiūlė įvairios sistemos cheminiai elementai. Taigi, pavyzdžiui, anglų chemikas Williamas Proutas 1815 m. pasiūlė, kad visų elementų atominės masės yra vandenilio atomo masės kartotiniai, jei laikysime ją lygiu vienetui, tai yra, jie turi būti sveikieji skaičiai. Tuo metu daugelio elementų atomines mases vandenilio masės atžvilgiu jau buvo apskaičiavęs J. Daltonas. Tačiau jei maždaug taip yra anglies, azoto, deguonies atveju, tai chloras, kurio masė 35,5, į šią schemą netilpo.
Vokiečių chemikas Johanas Wolfgangas Döbereineris (1780-1849) 1829 m. parodė, kad trys elementai iš vadinamosios halogenų grupės (chloras, bromas ir jodas) gali būti klasifikuojami pagal jų santykinę atominę masę. Paaiškėjo, kad bromo (79,9) atominė masė yra beveik tiksliai chloro (35,5) ir jodo (127) atominių svorių vidurkis, ty 35,5 + 127 ÷ 2 = 81,25 (arti 79,9). Tai buvo pirmasis požiūris į vienos iš cheminių elementų grupių konstravimą. Doberineris atrado dar dvi tokias elementų triadas, tačiau jam nepavyko suformuluoti bendro periodinio dėsnio.
Kaip atsirado periodinė cheminių elementų lentelė?
Dauguma ankstyvųjų klasifikavimo schemų nebuvo labai sėkmingos. Tada, maždaug 1869 m., beveik tą patį atradimą beveik tuo pačiu metu padarė du chemikai. Rusų chemikas Dmitrijus Mendelejevas (1834-1907) ir vokiečių chemikas Julius Lotharas Meyeris (1830-1895) pasiūlė organizuoti elementus, turinčius panašius fizinius ir Cheminės savybės, į sutvarkytą grupių, serijų ir laikotarpių sistemą. Tuo pat metu Mendelejevas ir Mejeris atkreipė dėmesį į tai, kad cheminių elementų savybės periodiškai kartojasi priklausomai nuo jų atominio svorio.
Šiandien Mendelejevas paprastai laikomas atradėju periodinė teisė nes jis žengė vieną žingsnį, kurio Mejeris nepadarė. Kai visi elementai buvo išdėstyti periodinėje lentelėje, joje atsirado tam tikrų spragų. Mendelejevas numatė, kad tai buvo dar neatrastų elementų vietos.
Tačiau jis nuėjo dar toliau. Mendelejevas numatė šių dar neatrastų elementų savybes. Jis žinojo, kur jie yra periodinėje lentelėje, todėl galėjo numatyti jų savybes. Pažymėtina, kad kiekvienas Mendelejevo numatytas cheminis elementas – būsimasis galis, skandis ir germanis – buvo atrasti praėjus mažiau nei dešimtmečiui po to, kai jis paskelbė periodinį įstatymą.
Trumpa periodinės lentelės forma
Buvo bandoma suskaičiuoti, kiek periodinės sistemos grafinio vaizdavimo variantų pasiūlė skirtingi mokslininkai. Paaiškėjo, kad daugiau nei 500. Be to, 80 proc. iš viso parinktys yra lentelės, o visa kita geometrines figūras, matematinės kreivės ir tt Dėl to praktinis naudojimas rasti keturių tipų stalai: trumpi, pusilgi, ilgi ir kopėčios (piramidiniai). Pastarąjį pasiūlė didysis fizikas N. Bohras.
Žemiau esančiame paveikslėlyje parodyta trumpoji forma.

Jame cheminiai elementai yra išdėstyti didėjančia jų atominio skaičiaus tvarka iš kairės į dešinę ir iš viršaus į apačią. Taigi pirmasis periodinės lentelės cheminis elementas vandenilis turi atominį numerį 1, nes vandenilio atomų branduoliuose yra vienas ir tik vienas protonas. Panašiai deguonies atominis skaičius yra 8, nes visų deguonies atomų branduoliuose yra 8 protonai (žr. paveikslėlį žemiau).

Pagrindiniai periodinės sistemos struktūriniai fragmentai yra laikotarpiai ir elementų grupės. Per šešis laikotarpius visos ląstelės užpildomos, septintasis dar nebaigtas (113, 115, 117 ir 118 elementai, nors ir susintetinti laboratorijose, dar nėra oficialiai užregistruoti ir neturi pavadinimų).
Grupės skirstomos į pagrindinius (A) ir antrinius (B) pogrupius. Pirmųjų trijų laikotarpių elementai, kurių kiekvienoje yra po vieną eilutę, yra įtraukti tik į A pogrupius. Likę keturi laikotarpiai apima po dvi eilutes.
Tos pačios grupės cheminiai elementai paprastai turi panašias chemines savybes. Taigi, pirmąją grupę sudaro šarminiai metalai, antrąją - šarminės žemės. Elementai tuo pačiu laikotarpiu turi savybių, kurios lėtai keičiasi iš šarminio metalo į tauriąsias dujas. Žemiau pateiktame paveikslėlyje parodyta, kaip keičiasi viena iš savybių - atomo spindulys atskiri elementai lentelėje.
Ilgalaikė periodinės lentelės forma
Jis parodytas žemiau esančiame paveikslėlyje ir yra padalintas dviem kryptimis – eilėmis ir stulpeliais. Yra septynios laikotarpio eilutės, kaip ir trumpoje formoje, ir 18 stulpelių, vadinamų grupėmis arba šeimomis. Tiesą sakant, grupių skaičiaus padidėjimas nuo 8 trumposios formos iki 18 ilgosios formos gaunamas visus elementus išdėstant periodais, pradedant nuo 4, ne dviejose, o vienoje eilutėje.
Du skirtingos sistemos numeracija naudojama grupėms, kaip parodyta lentelės viršuje. Romėniškų skaičių sistema (IA, IIA, IIB, IVB ir kt.) tradiciškai buvo populiari JAV. Europoje tradiciškai naudojama kita sistema (1, 2, 3, 4 ir t. t.), kuri prieš keletą metų buvo rekomenduota naudoti JAV.

Periodinių lentelių išvaizda aukščiau pateiktuose paveikslėliuose yra šiek tiek klaidinanti, kaip ir bet kurioje tokioje paskelbtoje lentelėje. Taip yra todėl, kad dvi elementų grupės, parodytos lentelių apačioje, iš tikrųjų turėtų būti jose. Pavyzdžiui, lantanidai priklauso 6 periodui tarp bario (56) ir hafnio (72). Be to, aktinidai priklauso 7 periodui tarp radžio (88) ir ruterfordžio (104). Jei jie būtų įklijuoti į lentelę, ji būtų per plati, kad tilptų ant popieriaus lapo ar sieninės diagramos. Todėl įprasta šiuos elementus išdėstyti lentelės apačioje.
Periodinė lentelė yra viena iš didžiausi atradimaižmonija, kuri leido supaprastinti žinias apie mus supantį pasaulį ir atrasti naujų cheminių elementų. Ji reikalinga moksleiviams, taip pat visiems, kurie domisi chemija. Be to, ši schema yra būtina ir kitose mokslo srityse.
Šioje diagramoje yra viskas pažįstamas žmogui elementai, ir jie grupuojami pagal atominė masė ir serijos numeris
. Šios charakteristikos turi įtakos elementų savybėms. Iš viso trumpoje lentelės versijoje yra 8 grupės, į vieną grupę įtraukti elementai turi labai panašias savybes. Pirmoje grupėje yra vandenilio, ličio, kalio, vario, lotyniškas tarimas rusų kalba, kuri yra cuprum. Taip pat argentum – sidabras, cezis, auksas – aurumas ir francis. Antroje grupėje yra berilio, magnio, kalcio, cinko, po jo seka stroncis, kadmis, baris, o grupė baigiasi gyvsidabriu ir radžiu.
Trečiajai grupei priklauso boras, aliuminis, skandis, galis, vėliau itris, indis, lantanas, o grupė baigiasi taliu ir aktiniu. Ketvirtoji grupė prasideda anglimi, siliciu, titanu, tęsiasi germaniu, cirkoniu, alavu ir baigiasi hafniu, švinu ir ruterfordžiu. Penktoje grupėje yra tokių elementų kaip azotas, fosforas, vanadis, arsenas, niobis, stibis yra žemiau, tada ateina bismutas tantalas ir užbaigia dubnio grupę. Šeštasis prasideda deguonimi, po to seka siera, chromas, selenas, tada molibdenas, telūras, tada volframas, polonis ir seborgis.
Septintoje grupėje pirmasis elementas yra fluoras, po to seka chloras, manganas, bromas, technecis, po to jodas, tada renis, astatinas ir boras. Paskutinė grupė yra gausiausias. Tai apima tokias dujas kaip helis, neonas, argonas, kriptonas, ksenonas ir radonas. Šiai grupei taip pat priklauso metalai geležis, kobaltas, nikelis, rodis, paladis, rutenis, osmis, iridis, platina. Toliau ateina Hannis ir Meitnerium. Atskirai išdėstyti elementai, kurie formuojasi aktinidų serija ir lantanido serija. Jie turi panašių savybių kaip lantanas ir aktinis.

Ši schema apima visų tipų elementus, kurie yra suskirstyti į 2 didelės grupės – metalai ir nemetalai turintys skirtingos savybės. Kaip nustatyti, ar elementas priklauso tam tikrai grupei, padės sąlyginė linija, kurią reikia nubrėžti nuo boro iki astatino. Reikėtų atsiminti, kad tokią liniją galima tik nubrėžti pilna versija lenteles. Visi elementai, esantys virš šios linijos ir esantys pagrindiniuose pogrupiuose, laikomi nemetalais. O kurie yra žemesni, pagrindiniuose pogrupiuose – metalai. Be to, metalai yra medžiagos, kurios yra šoniniai pogrupiai. Yra specialios nuotraukos ir nuotraukos, kuriose galite išsamiai susipažinti su šių elementų padėtimi. Verta paminėti, kad tie elementai, kurie yra šioje linijoje, turi tas pačias metalų ir nemetalų savybes.
Atskiras sąrašas taip pat sudarytas iš amfoterinių elementų, kurie turi dvejopų savybių ir dėl reakcijų gali sudaryti 2 tipų junginius. Tuo pačiu metu jie vienodai pasireiškia tiek pagrindiniais, tiek rūgščių savybių. Tam tikrų savybių vyravimas priklauso nuo reakcijos sąlygų ir medžiagų, su kuriomis reaguoja amfoterinis elementas.

Reikėtų pažymėti, kad ši schema tradiciniu geros kokybės vykdymu yra spalva. Kuriame skirtingos spalvos kad būtų lengviau orientuotis, yra pažymėtos pagrindiniai ir antriniai pogrupiai. Taip pat elementai grupuojami atsižvelgiant į jų savybių panašumą.
Tačiau šiuo metu, kartu su spalvų schema, nespalvota Mendelejevo periodinė lentelė yra labai paplitusi. Ši forma naudojama nespalvotai spausdinimui. Nepaisant akivaizdaus sudėtingumo, dirbti su juo taip pat patogu, atsižvelgiant į kai kuriuos niuansus. Taigi šiuo atveju pagrindinį pogrupį nuo antrinio galima atskirti pagal aiškiai matomus atspalvių skirtumus. Be to, spalvotoje versijoje nurodomi elementai, kuriuose yra elektronų skirtinguose sluoksniuose skirtingos spalvos.
Verta paminėti, kad vienspalviame dizaine nėra labai sunku naršyti schemoje. Tam pakaks informacijos, nurodytos kiekvienoje atskiroje elemento langelyje.

Egzaminas šiandien yra pagrindinis įskaitos tipas baigiant mokyklą, o tai reiškia, kad jam reikia pasiruošti Ypatingas dėmesys. Todėl renkantis baigiamasis chemijos egzaminas, reikia atkreipti dėmesį į medžiagas, kurios gali padėti jį pristatyti. Paprastai per egzaminą studentams leidžiama naudoti kai kurias lenteles, ypač periodinę lentelę gera kokybė. Todėl, kad bandymuose jis duotų tik naudos, iš anksto reikėtų atkreipti dėmesį į jo struktūrą ir elementų savybių bei jų sekos tyrimą. Taip pat reikia mokytis naudokite nespalvotą lentelės versiją kad egzamine nekiltų sunkumų.

Be pagrindinės lentelės, apibūdinančios elementų savybes ir jų priklausomybę nuo atominės masės, yra ir kitų schemų, kurios gali padėti tiriant chemiją. Pavyzdžiui, yra medžiagų tirpumo ir elektronegatyvumo lentelės. Pirmasis gali nustatyti, kiek tam tikras junginys yra tirpus vandenyje įprastoje temperatūroje. Šiuo atveju anijonai yra horizontaliai - neigiamo krūvio jonai, o katijonai, tai yra teigiamai įkrauti jonai, yra vertikaliai. Sužinoti tirpumo laipsnis vieno ar kito junginio, reikia lentelėje rasti jo komponentus. O jų sankirtos vietoje bus reikalingas žymėjimas.
Jei tai raidė "p", tada medžiaga visiškai tirpsta vandenyje normaliomis sąlygomis. Esant raidei "m" - medžiaga šiek tiek tirpsta, o esant raidei "n" - beveik netirpsta. Jei yra „+“ ženklas, junginys nesudaro nuosėdų ir reaguoja su tirpikliu be likučių. Jei yra ženklas „-“, tai reiškia, kad tokios medžiagos nėra. Kartais lentelėje taip pat galite pamatyti „?“ ženklą, tai reiškia, kad šio junginio tirpumo laipsnis nėra tiksliai žinomas. Elementų elektronegatyvumas gali skirtis nuo 1 iki 8, taip pat yra speciali lentelė šiam parametrui nustatyti.
 Dar viena naudinga lentelė yra metalo užsiėmimų serija. Visi metalai jame išsidėstę didinant elektrocheminio potencialo laipsnį. Įtempių metalų serija prasideda ličiu, baigiasi auksu. Manoma, kad kuo daugiau kairėje šioje eilėje metalas užima, tuo jis aktyvesnis cheminėse reakcijose. Šiuo būdu, dauguma aktyvus metalas
Litis laikomas šarminiu metalu. Vandenilis taip pat yra elementų sąrašo pabaigoje. Manoma, kad po jo esantys metalai yra praktiškai neaktyvūs. Tarp jų yra tokių elementų kaip varis, gyvsidabris, sidabras, platina ir auksas.
Dar viena naudinga lentelė yra metalo užsiėmimų serija. Visi metalai jame išsidėstę didinant elektrocheminio potencialo laipsnį. Įtempių metalų serija prasideda ličiu, baigiasi auksu. Manoma, kad kuo daugiau kairėje šioje eilėje metalas užima, tuo jis aktyvesnis cheminėse reakcijose. Šiuo būdu, dauguma aktyvus metalas
Litis laikomas šarminiu metalu. Vandenilis taip pat yra elementų sąrašo pabaigoje. Manoma, kad po jo esantys metalai yra praktiškai neaktyvūs. Tarp jų yra tokių elementų kaip varis, gyvsidabris, sidabras, platina ir auksas.
Geros kokybės periodinės lentelės nuotraukos
Ši schema yra vienas didžiausių laimėjimų chemijos srityje. Kuriame Yra daug šios lentelės tipų.- trumpas variantas, ilgas, taip pat itin ilgas. Labiausiai paplitusi yra trumpoji lentelė, taip pat įprasta ilgoji schemos versija. Verta paminėti, kad IUPAC šiuo metu nerekomenduoja naudoti trumposios schemos versijos.
Iš viso buvo sukurta daugiau nei šimtas lentelių tipų, kurios skiriasi pateikimu, forma ir grafiniu vaizdu. Jie naudojami įvairiose mokslo srityse arba visai nenaudojami. Šiuo metu mokslininkai toliau kuria naujas grandinių konfigūracijas. Kaip pagrindinė parinktis, naudojama puikios kokybės trumpoji arba ilga grandinė.
Žinant periodinio dėsnio formuluotę ir naudojant periodinę D. I. Mendelejevo elementų sistemą, galima charakterizuoti bet kurį cheminį elementą ir jo junginius. Tokią cheminio elemento charakteristiką patogu susumuoti pagal planą.
I. Cheminio elemento simbolis ir jo pavadinimas.
II. Cheminio elemento padėtis periodinė sistema elementai D.I. Mendelejevas:
- serijos numeris;
- laikotarpio numeris;
- grupės numeris;
- pogrupis (pagrindinis arba antrinis).
III. Cheminio elemento atomo struktūra:
- atomo branduolio krūvis;
- giminaitis atominė masė cheminis elementas;
- protonų skaičius;
- elektronų skaičius;
- neutronų skaičius;
- elektroninių lygių skaičius atome.
IV. Atomo elektroninės ir elektroninės-grafinės formulės, jo valentiniai elektronai.
V. Cheminio elemento tipas (metalinis arba nemetalinis, s-, p-, d- arba f-elementas).
VI. Cheminio elemento aukštesniojo oksido ir hidroksido formulės, jų savybių charakteristikos (bazinės, rūgštinės ar amfoterinės).
VII. Cheminio elemento metalinių arba nemetalinių savybių palyginimas su gretimų elementų savybėmis pagal periodą ir pogrupį.
VIII. Didžiausia ir mažiausia atomo oksidacijos būsena.
Pavyzdžiui, pateikime cheminio elemento, kurio eilės numeris 15, ir jo junginių charakteristiką pagal vietą periodinėje D. I. Mendelejevo elementų sistemoje ir atomo sandarą.
I. D. I. Mendelejevo lentelėje randame ląstelę su cheminio elemento numeriu, užrašome jos simbolį ir pavadinimą.
Cheminis elementas numeris 15 yra fosforas. Jo simbolis yra R.
II. Apibūdinkime elemento padėtį D. I. Mendelejevo lentelėje (laikotarpio numeris, grupė, pogrupio tipas).
Fosforas yra V grupės pagrindiniame pogrupyje, 3 periode.
III. Pateiksime bendrą cheminio elemento atomo sudėties aprašymą (branduolio krūvis, atominė masė, protonų, neutronų, elektronų ir elektroninių lygių skaičius).
Fosforo atomo branduolinis krūvis yra +15. Fosforo santykinė atominė masė yra 31. Atomo branduolyje yra 15 protonų ir 16 neutronų (31 - 15 = 16). Fosforo atomas turi tris energijos lygius su 15 elektronų.
IV. Sudarome atomo elektronines ir elektrongrafines formules, pažymime jo valentinius elektronus.
Fosforo atomo elektroninė formulė yra tokia: 15 P 1s 2 2s 2 2p 6 3s 2 3p 3 .
Fosforo atomo išorinio lygio elektroninė grafinė formulė: trečiame energijos lygyje 3s polygyje yra du elektronai (vienoje ląstelėje parašytos dvi priešingos krypties rodyklės), trys elektronai yra trijuose p- polygis (kiekvienoje iš trijų langelių viena rodyklė, nukreipta ta pačia kryptimi).
Valentiniai elektronai yra išorinio lygio elektronai, t.y. 3s2 3p3 elektronai.
V. Nustatykite cheminio elemento tipą (metalinis ar nemetalinis, s-, p-, d- arba f-elementas).
Fosforas yra nemetalas. Kadangi paskutinis elektronų pripildyto fosforo atomo polygis yra p polygis, fosforas priklauso p elementų šeimai.
VI. Mes sudarome aukštesniojo fosforo oksido ir hidroksido formules ir apibūdiname jų savybes (bazinę, rūgštinę ar amfoterinę).
Didžiausias fosforo oksidas P 2 O 5 pasižymi rūgštinio oksido savybėmis. Hidroksidas, atitinkantis aukštesnįjį oksidą H 3 PO 4, pasižymi rūgšties savybėmis. Šias savybes patvirtiname cheminių reakcijų tipų lygtimis:
P 2 O 5 + 3 Na 2 O \u003d 2Na 3 PO 4
H 3 PO 4 + 3 NaOH \u003d Na 3 PO 4 + 3H 2 O
VII. Palyginkime nemetalines fosforo savybes su gretimų elementų savybėmis pagal periodą ir pogrupį.
Fosforo kaimynas pogrupyje yra azotas. Šiuo laikotarpiu fosforo kaimynai yra silicis ir siera. Pagrindinių pogrupių cheminių elementų atomų nemetalinės savybės didėjant eilės numeriui didėja periodais ir mažėja grupėse. Todėl nemetalinės fosforo savybės yra ryškesnės nei silicio ir mažiau nei azoto ir sieros.
VIII. Nustatykite didžiausią ir mažiausią fosforo atomo oksidacijos būseną.
Maksimalus teigiamas laipsnis pagrindinių pogrupių cheminių elementų oksidacija yra lygi grupės skaičiui. Fosforas yra penktosios grupės pagrindiniame pogrupyje, todėl maksimali fosforo oksidacijos būsena yra +5.
Minimali nemetalų oksidacijos būsena daugeliu atvejų yra lygi skirtumui tarp grupės skaičiaus ir skaičiaus aštuoni. Taigi minimali fosforo oksidacijos būsena yra -3.
PERIODINĖ MENDELEJEVO LENTELĖ
Mendelejevo cheminių elementų periodinės lentelės konstrukcija atitinka būdingus skaičių teorijos ir stačiakampių bazių periodus. Papildant Hadamardo matricas lyginės ir nelyginės eilės matricomis, sukuriamas įdėtųjų matricos elementų struktūrinis pagrindas: pirmosios (Odin), antrosios (Euler), trečiosios (Mersenne), ketvirtosios (Hadamardo) ir penktosios (Fermat) eilės matricos.
Nesunku pastebėti, kad 4 dydžio eilės k Hadamardo matricos atitinka inertinius elementus, kurių atominė masė yra keturių kartotinė: helis 4, neonas 20, argonas 40 (39,948) ir kt., bet taip pat gyvybės ir skaitmeninių technologijų pagrindus: anglis 12, deguonis 16, silicis 28. , germanis 72.
Atrodo, kad naudojant Mersenne 4 eilių matricas k-1, atvirkščiai, viskas, kas aktyvu, nuodinga, destruktyvi ir ėsdinanti, yra susiję. Bet tai taip pat yra radioaktyvūs elementai – energijos šaltiniai ir švinas 207 (galutinis produktas, nuodingos druskos). Žinoma, fluoro yra 19. Merseno matricų eilės atitinka radioaktyviųjų elementų seką, vadinamą aktinio serija: uranas 235, plutonis 239 (izotopas, kuris yra galingesnis atominės energijos šaltinis nei uranas) ir kt. tai tas pats šarminių metalų ličio 7, natrio 23 ir kalio 39.

Galis – atominis svoris 68
Užsakymai 4 k–2 Eulerio matricos (dvigubas Mersenas) atitinka azotą 14 (atmosferos bazė). Valgomąją druską sudaro du „merseno tipo“ natrio 23 ir chloro 35 atomai, kartu šis derinys yra tipiškas, tik Eulerio matricoms. Masyvesnio chloro, kurio svoris yra 35,4, šiek tiek trūksta Hadamardo matmens 36. Paprastieji druskos kristalai: kubas (! t.y., nuolankus personažas, Hadamaras) ir oktaedras (labiau iššaukiantis, tai neabejotinai yra Euleris).
AT atominė fizika pereinamasis geležis 56 - nikelis 59, tai yra riba tarp elementų, kurie teikia energiją didesnio branduolio sintezės metu ( H-bomba) ir skilimo (urano). 58 tvarka garsėja tuo, kad jai yra ne tik Hadamardo matricų analogų Belevičiaus matricų pavidalu su nuliais įstrižainėje, taip pat nėra daug svertinių matricų - artimiausia ortogonali W(58,53) kiekviename stulpelyje ir eilutėje yra 5 nuliai (gilus tarpas ).
Eilėje, atitinkančioje Fermato matricas ir jų eilių pakaitus 4 k+1, likimo valia kainuoja 257 fermii.Nieko nepasakysi, tikslus pataikymas. Štai auksas 197. Varis 64 (63.547) ir sidabras 108 (107.868), elektronikos simboliai, matyt, nesiekia aukso ir atitinka kuklesnes Hadamardo matricas. Varis, kurio atominis svoris yra netoli 63, yra chemiškai aktyvus – jo žalieji oksidai yra gerai žinomi.

Boro kristalai esant dideliam padidinimui
NUO aukso pjūvis boras yra prijungtas - atominė masė tarp visų kitų elementų yra artimiausia 10 (tiksliau, 10,8, turi įtakos ir atominio svorio artumas nelyginiams skaičiams). Boras yra gana sudėtingas elementas. Boras vaidina painų vaidmenį pačioje gyvenimo istorijoje. Karkaso struktūra jos konstrukcijose yra daug sudėtingesnė nei deimantų. Unikalus cheminio ryšio tipas, leidžiantis borui sugerti bet kokias priemaišas, yra labai menkai suprantamas, nors su juo susiję tyrimai didelis skaičius mokslininkai jau gavo Nobelio premijos. Boro kristalo forma yra ikosaedras, penki trikampiai sudaro viršūnę.
Platinos paslaptis. Penktasis elementas, be jokios abejonės, yra taurieji metalai, tokie kaip auksas. Pakaba virš Hadamard matmens 4 k, skirtas 1 dideliam.

Stabilus izotopas uranas 238
Tačiau atminkite, kad Fermato skaičiai yra reti (artimiausias yra 257). Natūralaus aukso kristalų forma yra artima kubui, tačiau pentagrama taip pat spindi. Artimiausias jo kaimynas platina, taurusis metalas, yra mažiau nei 4 kartus mažesnis nei aukso 197 atominis svoris. Platinos atominis svoris yra ne 193, o šiek tiek padidintas, 194 (Eulerio matricų tvarka). Smulkmena, bet įveda ją į kelių agresyvesnių elementų stovyklą. Verta prisiminti dėl to, kad dėl savo inertiškumo (tirpsta galbūt vandenyje) platina naudojama kaip aktyvus katalizatorius. cheminiai procesai.
Kempine platina kambario temperatūroje uždega vandenilį. Platinos prigimtis visai nėra taiki, iridis 192 elgiasi tyliau (191 ir 193 izotopų mišinys). Jis panašesnis į varį, tačiau aukso svoriu ir charakteriu.
Tarp neono 20 ir natrio 23 nėra elemento, kurio atominis svoris būtų 22. Žinoma, atominiai svoriai yra neatsiejama charakteristika. Tačiau tarp izotopų, savo ruožtu, taip pat yra keista savybių koreliacija su skaičių savybėmis ir atitinkamomis stačiakampių bazių matricomis. Kaip branduolinis kuras didžiausias pritaikymas turi urano izotopą 235 (Merseno matricos tvarka), kuriame galima savaime išsilaikanti grandininė branduolinė reakcija. Gamtoje šis elementas yra stabilios formos uranas 238 (Eulerio matricų tvarka). Nėra elemento, kurio atominis svoris būtų 13. Kalbant apie chaosą, koreliuoja ribotas stabilių periodinės lentelės elementų skaičius ir sunkumai ieškant aukšto lygio matricų dėl barjero, matomo tryliktos eilės matricose.

Cheminių elementų izotopai, stabilumo sala