Az ózon fizikai tulajdonságai nagyon jellegzetesek: könnyen felrobbanó kékgáz. Egy liter ózon körülbelül 2 grammot, míg a levegő 1,3 grammot nyom. Ezért az ózon nehezebb a levegőnél. Az ózon olvadáspontja mínusz 192,7 ºС. Ez az "olvadt" ózon egy sötétkék folyadék. Az ózon "jég" sötétkék színű, lila árnyalatú, és 1 mm-nél nagyobb vastagságban átlátszatlanná válik. Az ózon forráspontja mínusz 112ºС. Gázhalmazállapotban az ózon diamágneses, azaz. nem rendelkezik mágneses tulajdonságok, és folyékony állapotban gyengén paramágneses. Az ózon oldhatósága az olvadékvízben 15-ször nagyobb, mint az oxigéné, és körülbelül 1,1 g/l. Egy liter ecetsav szobahőmérsékleten 2,5 gramm ózont old fel. Illóolajokban, terpentinben is jól oldódik, szén-tetraklorid. Az ózonszag 15 µg/m3 levegő feletti koncentrációban érezhető. Minimális koncentrációban "frissesség illataként" érzékelhető, magasabb koncentrációban éles irritáló árnyalatot kap.
Az ózon oxigénből a következő képlet szerint képződik: 3O2 + 68 kcal → 2O3. Klasszikus példák az ózonképződésre: villám hatására zivatar idején; napfénynek kitéve a felső légkörben. Az ózon képződhet bármilyen, atomi oxigén felszabadulásával járó folyamat során is, például a hidrogén-peroxid bomlása során. Az ózon ipari szintézise az elektromos kisülések alacsony hőmérsékleten történő alkalmazásához kapcsolódik. Az ózon előállítására szolgáló technológiák eltérhetnek egymástól. Tehát az orvosi célokra használt ózon előállításához csak tiszta (szennyeződések nélkül) orvosi oxigént használnak. A képződött ózon elválasztása az oxigénszennyeződéstől a fizikai tulajdonságok eltérései miatt általában nem nehéz (az ózon könnyebben cseppfolyósodik). Ha a reakció bizonyos minőségi és mennyiségi paraméterei nem szükségesek, akkor az ózon előállítása nem jelent különösebb nehézséget.
Az O3 molekula instabil, és a hő felszabadulásával meglehetősen gyorsan O2-vé alakul. Alacsony koncentrációban és idegen szennyeződések nélkül az ózon lassan, nagy koncentrációban - robbanásszerűen bomlik le. A vele érintkező alkohol azonnal meggyullad. Az ózon felmelegedése és érintkezése még elhanyagolható mennyiségű oxidációs szubsztrátummal (szerves anyagok, egyes fémek vagy ezek oxidjai) is jelentősen felgyorsítja annak bomlását. Az ózon hosszú ideig tárolható -78ºC-on stabilizátor (kis mennyiségű HNO3) jelenlétében, valamint üvegből, egyes műanyagokból vagy nemesfémekből készült edényekben.
Az ózon a legerősebb oxidálószer. Ennek a jelenségnek az oka abban rejlik, hogy a bomlás során atomi oxigén képződik. Az ilyen oxigén sokkal agresszívebb, mint a molekuláris oxigén, mivel az oxigénmolekulában nem annyira észrevehető a külső szinten lévő elektronok hiánya a molekulapálya kollektív felhasználása miatt.
Már a 18. században észrevették, hogy a higany ózon jelenlétében elveszti fényét, és az üveghez tapad; oxidált. És amikor az ózont vizes kálium-jodid-oldaton vezetik át, gáznemű jód szabadul fel. Ugyanezek a "trükkök" a tiszta oxigénnel nem működtek. Ezt követően felfedezték az ózon tulajdonságait, amelyeket az emberiség azonnal át is vett: az ózon kiváló antiszeptikumnak bizonyult, az ózon gyorsan eltávolította a vízből bármilyen eredetű szerves anyagokat (illatszerek és kozmetikumok, biológiai folyadékok), széles körben alkalmazták az iparban és a mindennapi életben, és bevált a fogászati fúró alternatívájaként.
A 21. században az ózon felhasználása az emberi élet és tevékenység minden területén egyre növekszik és fejlődik, ezért az egzotikumból a mindennapi munka megszokott eszközévé válnak. ÓZON O3, az oxigén allotróp formája.
Átvételi és fizikai tulajdonságokózon.
A tudósok először akkor lettek figyelmesek egy ismeretlen gáz létezésére, amikor elektrosztatikus gépekkel kezdtek kísérletezni. A 17. században történt. De csak a következő század végén kezdték el tanulmányozni az új gázt. 1785-ben Martin van Marum holland fizikus elektromos szikrákat oxigénen átvezetve ózont hozott létre. Az ózon név csak 1840-ben jelent meg; Christian Schönbein svájci kémikus találta fel, a görög ózonból származtatva, szagló. Ennek a gáznak a kémiai összetétele nem különbözött az oxigéntől, de sokkal agresszívebb volt. Tehát azonnal oxidálta a színtelen kálium-jodidot barna jód felszabadulásával; Shenbein ezt a reakciót használta az ózon meghatározására a kálium-jodid és keményítő oldatával impregnált papír kékségének mértéke alapján. Még a szobahőmérsékleten inaktív higany és ezüst is oxidálódik ózon jelenlétében.
Kiderült, hogy az ózonmolekulák az oxigénhez hasonlóan csak oxigénatomokból állnak, csak nem kettőből, hanem háromból. Oxigén O2 és ózon O3 - az egyetlen példa arra, hogy egy kémiai elem két gáznemű (normál körülmények között) képződik egyszerű anyagok. Az O3 molekulában az atomok szögben helyezkednek el, tehát ezek a molekulák polárisak. Az ózon a szabad oxigénatomok O2-molekuláihoz való „tapadása” eredményeként keletkezik, amelyek oxigénmolekulákból képződnek elektromos kisülések, ultraibolya sugarak, gamma-sugarak, gyors elektronok és más nagy energiájú részecskék hatására. Az ózon mindig szaga van a működő elektromos gépek közelében, amelyekben a kefék „szikráznak”, az ultraibolya sugárzást kibocsátó baktericid higany-kvarc lámpák közelében. Némelyik során oxigénatomok is felszabadulnak kémiai reakciók. Az ózon kis mennyiségben képződik a savanyított víz elektrolízise során, a nedves fehérfoszfor lassú oxidációja során a levegőben, a magas oxigéntartalmú vegyületek (KMnO4, K2Cr2O7 stb.) bomlásakor, fluor hatására vízre. vagy tömény kénsav bárium-peroxidján. Az oxigénatomok mindig jelen vannak a lángban, ezért ha irányítja a sugárt sűrített levegő az oxigénégő lángján át az ózon jellegzetes szaga lesz megtalálható a levegőben.
A 3O2 → 2O3 reakció erősen endoterm: 1 mól ózon előállításához 142 kJ-t kell elkölteni. A fordított reakció az energia felszabadulásával megy végbe, és nagyon könnyen végrehajtható. Ennek megfelelően az ózon instabil. A gáznemű ózon szennyeződések hiányában 70°C hőmérsékleten lassan, 100°C felett gyorsan bomlik, katalizátorok jelenlétében az ózonbomlás sebessége jelentősen megnő. Lehetnek gázok (például nitrogén-monoxid, klór) és sok szilárd anyag (még az edény falai is). Ezért a tiszta ózont nehéz beszerezni, és a vele való munkavégzés veszélyes a robbanás lehetősége miatt.
Nem meglepő, hogy az ózon felfedezése után sok évtizedig még alapvető fizikai állandói sem voltak ismertek: hosszú ideig senkinek sem sikerült tiszta ózont előállítania. Ahogy D. I. Mengyelejev a Kémia alapjai című tankönyvében írta: „a gáznemű ózon előállításának minden módszerénél az oxigéntartalma mindig jelentéktelen, általában csak néhány tized százalék, ritkán 2%, és csak nagyon alacsony hőmérséklet eléri a 20%-ot. Csak 1880-ban, a francia tudósok, J. Gotfeil és P. Chappui kapott ózont tiszta oxigénből mínusz 23 °C hőmérsékleten. Kiderült, hogy egy vastag rétegben az ózon gyönyörű kék színű. A lehűtött ózonozott oxigén lassú összenyomásakor a gáz sötétkék színűvé vált, majd a nyomás gyors felengedése után a hőmérséklet még jobban lecsökkent és sötétlila folyékony ózoncseppek keletkeztek. Ha a gázt nem hűtötték le vagy sűrítették gyorsan, akkor az ózon azonnal, sárga villanással oxigénné alakult.
Később egy kényelmes módszert fejlesztettek ki az ózon szintézisére. Ha a perklór-, foszfor- vagy kénsav tömény oldatát platina- vagy ólom(IV)-oxidból készült hűtött anóddal elektrolízisnek vetjük alá, akkor az anódon felszabaduló gáz akár 50% ózont is tartalmazhat. Az ózon fizikai állandóit is finomították. Sokkal könnyebben cseppfolyósodik, mint az oxigén - -112 ° C hőmérsékleten (oxigén - -183 ° C-on). -192,7 ° C-on az ózon megszilárdul. A szilárd ózon kék-fekete színű.
Az ózonnal végzett kísérletek veszélyesek. A gáznemű ózon akkor képes felrobbanni, ha koncentrációja a levegőben meghaladja a 9%-ot. A folyékony és szilárd ózon még könnyebben felrobban, különösen oxidáló anyagokkal érintkezve. Az ózon alacsony hőmérsékleten fluorozott szénhidrogénekben (freonokban) készült oldatok formájában tárolható. Ezek az oldatok kék színűek.
Az ózon kémiai tulajdonságai.
Az ózont rendkívül magas reakcióképesség jellemzi. Az ózon az egyik legerősebb oxidálószer, és ebből a szempontból csak a fluornál és az oxigén-fluoridnál gyengébb OF2. Az ózon, mint oxidálószer hatóanyaga az atomi oxigén, amely az ózonmolekula bomlása során keletkezik. Ezért az oxidálószerként működő ózonmolekula általában csak egy oxigénatomot „használ”, míg a másik kettő szabad oxigén formájában szabadul fel, például 2KI + O3 + H2O → I2 + 2KOH + O2. Sok más vegyület is hasonló módon oxidálódik. Vannak azonban kivételek, amikor az ózonmolekula mindhárom oxigénatomját felhasználja az oxidációhoz, például 3SO2 + O3 → 3SO3; Na2S + O3 → Na2SO3.
Nagyon fontos különbség az ózon és az oxigén között, hogy az ózon megmutatkozik oxidáló tulajdonságok már szobahőmérsékleten. Például a PbS és a Pb(OH)2 normál körülmények között nem reagál oxigénnel, míg ózon jelenlétében a szulfid PbSO4-dá, a hidroxid pedig PbO2-dá alakul. Ha tömény ammóniaoldatot öntenek egy ózonos edénybe, fehér füst jelenik meg - ez az ózon oxidálta az ammóniát, így ammónium-nitrit NH4NO2 keletkezik. Az ózonra különösen jellemző az a képesség, hogy AgO és Ag2O3 képződésével „feketíti” az ezüst tárgyakat.
Egy elektron összekapcsolásával és negatív O3-ionná alakulásával az ózonmolekula stabilabbá válik. Az ilyen anionokat tartalmazó "ózonátsók" vagy ozonidok régóta ismertek – a lítium kivételével minden alkálifém alkotja őket, és az ozonidok stabilitása nátriumról céziumra nő. Az alkáliföldfémek néhány ózonidja is ismert, például a Ca(O3)2. Ha egy gáznemű ózonáramot egy szilárd, száraz lúg felületére irányítanak, narancsvörös kéreg képződik, amely ózonidokat tartalmaz, például 4KOH + 4O3 → 4KO3 + O2 + 2H2O. Ugyanakkor a szilárd lúg hatékonyan megköti a vizet, ami megakadályozza az ózonid azonnali hidrolízisét. Vízfelesleggel azonban az ózonidok gyorsan lebomlanak: 4KO3 + 2H2O → 4KOH + 5O2. A tárolás során is bomlás következik be: 2KO3 → 2KO2 + O2. Az ózonidok jól oldódnak folyékony ammóniában, ami lehetővé tette tiszta formájuk izolálását és tulajdonságaik tanulmányozását.
A szerves anyagok, amelyekkel az ózon érintkezésbe kerül, általában elpusztítja. Tehát az ózon, a klórral ellentétben, képes megosztani a benzolgyűrűt. Ha ózonnal dolgozik, nem használhat gumicsöveket és tömlőket - azonnal „kiszivárognak”. Az ózon reakcióba lép a szerves vegyületekkel, és nagy mennyiségű energia szabadul fel. Például az éter, az alkohol, a terpentinnel, metánnal és sok más anyaggal megnedvesített vatta ozonizált levegővel érintkezve spontán meggyullad, és az ózon etilénnel való keverése erős robbanáshoz vezet.
Az ózon használata.
Az ózon nem mindig "égeti el" a szerves anyagokat; számos esetben lehetséges speciális reakciókat végrehajtani erősen híg ózonnal. Például olajsav ózonozása során (nagy mennyiségben található meg növényi olajok) Azelainsav HOOC(CH2)7COOH keletkezik, amelyből kiváló minőségű kenőolajokat, szintetikus szálakat és műanyagok lágyítóit állítanak elő. Hasonló módon adipinsavat kapnak, amelyet a nylon szintézisében használnak. 1855-ben Schönbein felfedezte a C=C kettős kötéseket tartalmazó telítetlen vegyületek reakcióját az ózonnal, de H. Staudinger német kémikus csak 1925-ben állapította meg ennek a reakciónak a mechanizmusát. Az ózonmolekula ózonid képződésével csatlakozik a kettős kötéshez - ezúttal szerves, és az egyik C \u003d C kötés helyén oxigénatom, a másik helyett -O-O-csoport található. Bár néhány szerves ózonidot tiszta formában izoláltak (például etilén-ozonidot), ezt a reakciót általában híg oldatban hajtják végre, mivel az ozonidok szabad állapotban nagyon instabilak. robbanóanyagok. A telítetlen vegyületek ózonosítási reakciója nagy tiszteletnek örvend a szerves vegyészek körében; az ilyen reakciójú feladatokat gyakran még on-ra is felkínálják iskolai olimpiákon. A helyzet az, hogy amikor az ózonidot víz lebontja, két aldehid- vagy ketonmolekula képződik, amelyek könnyen azonosíthatók és tovább erősítik az eredeti telítetlen vegyület szerkezetét. Így a 20. század elején a vegyészek számos fontos, C=C kötést tartalmazó szerves vegyület szerkezetét állapították meg, köztük a természeteseket is.
Az ózon fontos felhasználási területe az ivóvíz fertőtlenítése. Általában a víz klórozott. A vízben azonban a klór hatására néhány szennyeződés nagyon kellemetlen szagú vegyületekké alakul. Ezért régóta javasolták a klór ózonnal való helyettesítését. Az ózonozott víz nem kap idegen szagot vagy ízt; amikor sok szerves vegyület teljesen oxidálódik ózonnal, csak szén-dioxid és víz keletkezik. Tisztítsa meg ózonnal és szennyvíz. Az ózon oxidációjának termékei még olyan szennyező anyagok esetében is, mint a fenolok, cianidok, felületaktív anyagok, szulfitok, klóraminok ártalmatlan, szín- és szagtalan vegyületek. Az ózonfelesleg gyorsan lebomlik oxigén képződésével. A víz ózonozása azonban drágább, mint a klórozás; ráadásul az ózon nem szállítható, azt a helyszínen kell előállítani.
Ózon a légkörben.
A Föld légkörében nem sok ózon található – 4 milliárd tonna, i.e. átlagosan csak 1 mg/m3. Az ózon koncentrációja a Föld felszínétől való távolság növekedésével növekszik, és a sztratoszférában, 20-25 km-es magasságban éri el a maximumát – ez az „ózonréteg”. Ha az atmoszférából származó összes ózont a Föld felszíne közelében, normál nyomáson összegyűjtjük, mindössze 2-3 mm vastag réteget kapunk. És ilyen kis mennyiségű ózon a levegőben valóban életet biztosít a Földön. Az ózon "védőképernyőt" hoz létre, amely nem engedi, hogy a nap durva ultraibolya sugarai elérjék a Föld felszínét, amelyek minden élőlényre károsak.
Az elmúlt évtizedekben nagy figyelmet fordítottak az úgynevezett „ózonlyukak” kialakulására – olyan területekre, ahol jelentősen csökkent a sztratoszférikus ózontartalom. Egy ilyen "szivárgó" pajzson keresztül a Nap keményebb ultraibolya sugárzása eléri a Föld felszínét. Ezért a tudósok már régóta figyelemmel kísérik az ózont a légkörben. 1930-ban az angol geofizikus, S. Chapman négy reakcióból álló sémát javasolt a sztratoszférában lévő állandó ózonkoncentráció magyarázatára (ezeket a reakciókat Chapman-ciklusnak nevezik, amelyben M minden olyan atomot vagy molekulát jelent, amely elvezeti a felesleges energiát):
O + O + M → O2 + M
O + O3 → 2O2
O3 → O2 + O.
Ennek a ciklusnak az első és negyedik reakciója fotokémiai, a napsugárzás hatása alatt áll. Az oxigénmolekula atomokra bomlásához 242 nm-nél kisebb hullámhosszú sugárzásra van szükség, míg az ózon lebomlik, amikor a fény abszorbeálódik 240-320 nm tartományban (utóbbi reakció éppen megvéd minket a kemény ultraibolya sugárzástól, mivel az oxigén nem abszorbeál ebben a spektrumtartományban) . A fennmaradó két reakció termikus, azaz. menjen a fény hatása nélkül. Nagyon fontos, hogy az ózon eltűnéséhez vezető harmadik reakciónak aktiválási energiája legyen; ez azt jelenti, hogy egy ilyen reakció sebessége katalizátorok hatására növelhető. Mint kiderült, az ózon bomlásának fő katalizátora a nitrogén-monoxid. A felső légkörben nitrogénből és oxigénből képződik a legerősebb napsugárzás hatására. Az ózonoszférába kerülve két reakcióciklusba lép O3 + NO → NO2 + O2, NO2 + O → NO + O2, melynek eredményeként a légkörben lévő tartalma nem változik, és az álló ózonkoncentráció csökken. Vannak más ciklusok is, amelyek az ózontartalom csökkenéséhez vezetnek a sztratoszférában, például a klór részvételével:
Cl + O3 → ClO + O2
ClO + O → Cl + O2.
Az ózont por és gázok is tönkreteszik, amelyek be nagy számban vulkánkitörések során került a légkörbe. BAN BEN Utóbbi időben felvetették, hogy az ózon hatékonyan pusztítja el a hidrogénből felszabaduló hidrogént is földkéreg. Az ózon képződésének és bomlási reakcióinak összessége ahhoz a tényhez vezet, hogy egy ózonmolekula átlagos élettartama a sztratoszférában körülbelül három óra.
Feltételezhető, hogy a természetes mellett mesterséges tényezők is befolyásolják az ózonréteget. Jól ismert példa erre a freonok, amelyek klóratomok forrásai. A freonok olyan szénhidrogének, amelyekben a hidrogénatomokat fluor- és klóratomok helyettesítik. Hűtésre és aeroszolos dobozok töltésére használják. Végül a freonok a levegőbe kerülnek, és a légáramlatokkal lassan egyre magasabbra emelkednek, végül elérik az ózonréteget. A napsugárzás hatására lebomló freonok maguk is elkezdik katalitikusan lebontani az ózont. Egyelőre nem tudni pontosan, hogy a freonok milyen mértékben okolhatók az „ózonlyukakért”, ennek ellenére már régóta tettek intézkedéseket használatuk korlátozására.
A számítások szerint 60-70 év alatt 25%-kal csökkenhet az ózonkoncentráció a sztratoszférában. Ugyanakkor a felszíni rétegben - a troposzférában - megnő az ózon koncentrációja, ami szintén rossz, mivel az ózon és átalakulásának termékei a levegőben mérgezőek. A troposzférában az ózon fő forrása a sztratoszférikus ózon légtömegekkel történő átvitele az alsóbb rétegekbe. Évente körülbelül 1,6 milliárd tonna kerül az ózon talajrétegébe. Az ózonmolekula élettartama a légkör alsó részében sokkal hosszabb - több mint 100 nap, mivel a felszíni rétegben kisebb az ózont tönkretevő ultraibolya napsugárzás intenzitása. A troposzférában általában nagyon kevés az ózon: tiszta, friss levegőn koncentrációja átlagosan csak 0,016 µg/l. A levegő ózonkoncentrációja nemcsak a tengerszint feletti magasságtól, hanem a terepviszonyoktól is függ. Így mindig több ózon van az óceánok felett, mint a szárazföldön, mivel ott lassabban bomlik le az ózon. A Szocsiban végzett mérések azt mutatták, hogy a levegő at tenger partja 20%-kal több ózont tartalmaz, mint a parttól 2 km-re lévő erdőben.
A modern ember sokkal több ózont lélegzik be, mint őseik. Ennek fő oka a metán és a nitrogén-oxidok mennyiségének növekedése a levegőben. Így a légkör metántartalma a 19. század közepétől, a földgáz használatának kezdetétől folyamatosan nő. A nitrogén-oxidokkal szennyezett légkörben a metán oxigént és vízgőzt magában foglaló átalakulások összetett láncolatába lép be, melynek eredménye a CH4 + 4O2 → HCHO + H2O + 2O3 egyenlettel fejezhető ki. Más szénhidrogének is működhetnek metánként, például azok, amelyek az autók kipufogógázaiban találhatók. tökéletlen égés benzin. Ennek eredményeként az elmúlt évtizedekben a nagyvárosok levegőjében az ózon koncentrációja megtízszereződött.
Mindig is azt hitték, hogy zivatar idején az ózon koncentrációja a levegőben drámaian megnő, mivel a villámlás hozzájárul az oxigén ózonná történő átalakulásához. Valójában a növekedés elenyésző, és nem zivatar idején, hanem több órával előtte következik be. Zivatar idején és utána több órán keresztül az ózon koncentrációja csökken. Ez azzal magyarázható, hogy zivatar előtt erős függőleges keveredés következik be. légtömegek, így további ózon jön a felső rétegekből. Ezenkívül zivatar előtt megnő az elektromos térerősség, és a koronakisülés kialakulásának feltételei megteremtődnek a különböző tárgyak, például az ágak csúcsain. Hozzájárul az ózonképződéshez is. Aztán a fejlesztéssel viharfelhő erős felszálló légáramlatok keletkeznek alatta, amelyek közvetlenül a felhő alatt csökkentik az ózontartalmat.
Érdekes kérdés a levegő ózontartalmával kapcsolatban tűlevelű erdők. Például a tanfolyamon szervetlen kémia G. Remyről olvashatjuk, hogy "a tűlevelű erdők ózonos levegője" kitaláció. így van? Természetesen egyetlen növény sem bocsát ki ózont. De a növények, különösen a tűlevelűek, sok illékony szerves vegyületet bocsátanak ki a levegőbe, beleértve a terpén osztályba tartozó telítetlen szénhidrogéneket (a terpentinben sok van). Tehát egy forró napon egy fenyőfa óránként 16 mikrogramm terpént bocsát ki a tűlevelek minden grammjára számítva. A terpéneket nemcsak a tűlevelűek, hanem néhány lombhullató fák is megkülönböztetik, köztük a nyár és az eukaliptusz. Egyes trópusi fák pedig óránként 45 mikrogramm terpéneket képesek felszabadítani 1 g száraz levéltömegre számítva. Ennek eredményeként egy hektár tűlevelű erdő akár 4 kg szerves anyagot is kibocsáthat naponta, és körülbelül 2 kg lombos erdőt. A Föld erdős területe több millió hektár, és ezek mindegyike évente több százezer tonna különféle szénhidrogént, köztük terpéneket bocsát ki. És a szénhidrogének, amint azt a metán példája mutatta, a napsugárzás hatására és más szennyeződések jelenlétében hozzájárulnak az ózon képződéséhez. Kísérletek kimutatták, hogy megfelelő körülmények között a terpének valóban nagyon aktívan részt vesznek az ózonképződéssel járó légköri fotokémiai reakciók ciklusában. Tehát az ózon egy tűlevelű erdőben egyáltalán nem találmány, hanem kísérleti tény.
Ózon és egészség.
Micsoda öröm egy zivatar után sétálni! A levegő tiszta és friss, élénkítő sugarai minden erőfeszítés nélkül a tüdőbe áramlanak. „Ózonszagú” – mondják ilyenkor gyakran. “Nagyon jót tesz az egészségnek.” így van?
Valamikor az ózont minden bizonnyal jótékony hatásúnak tartották az egészségre. De ha koncentrációja meghalad egy bizonyos küszöböt, sok kellemetlen következménnyel járhat. Az ózon a koncentrációtól és a belélegzés idejétől függően elváltozásokat okoz a tüdőben, a szem és az orr nyálkahártyájának irritációját, fejfájást, szédülést, vérnyomáscsökkenést okoz; az ózon csökkenti a szervezet ellenálló képességét a légúti bakteriális fertőzésekkel szemben. Maximálisan megengedett koncentrációja a levegőben mindössze 0,1 µg/l, ami azt jelenti, hogy az ózon sokkal veszélyesebb, mint a klór! Ha több órát tölt bent 0,4 μg/l ózonkoncentráció mellett, mellkasi fájdalmak, köhögés, álmatlanság jelentkezhet, a látásélesség csökken. Ha hosszú ideig lélegez be ózont 2 μg / l-nél nagyobb koncentrációban, a következmények súlyosabbak lehetnek - egészen a kábultságig és a szívműködés csökkenéséhez. 8-9 µg/l ózontartalom mellett néhány óra múlva tüdőödéma lép fel, ami tele van halálos. De ilyen elhanyagolható mennyiségű anyagot általában nehéz hagyományos kémiai módszerekkel elemezni. Szerencsére az ember már nagyon alacsony koncentrációban is érzi az ózon jelenlétét - körülbelül 1 μg / l, amelynél a keményítő-jódpapír nem kékül el. Egyesek számára az ózon illata kis koncentrációban a klór szagára, mások számára a kén-dioxidé, mások a fokhagyma szagára emlékeztet.
Nem csak maga az ózon mérgező. A levegőben való részvétellel például peroxiacetil-nitrát (PAN) CH3-CO-OONO2 képződik - olyan anyag, amely erős irritáló hatású, beleértve a könnyezést is, ami nehezíti a légzést, nagyobb koncentrációban pedig szívbénulást okoz. A PAN a nyáron szennyezett levegőben kialakuló úgynevezett fotokémiai szmog egyik összetevője (ez a szó az angol füst - füst és köd - köd szóból ered). A szmogban az ózon koncentrációja elérheti a 2 μg/l-t, ami 20-szor magasabb a megengedettnél. Azt is figyelembe kell venni, hogy az ózon és a nitrogén-oxidok együttes hatása a levegőben tízszer erősebb, mint az egyes anyagok külön-külön. Nem meglepő módon az ilyen szmog következményei nagy városok katasztrofális lehet, főleg, ha a város feletti levegőt nem fújja be "huzat", és pangózóna alakul ki. Tehát 1952-ben Londonban több mint 4000 ember halt meg a szmog miatt néhány napon belül. 1963-ban New Yorkban a szmog 350 ember halálát okozta. Hasonló történetek voltak Tokióban és másokban is nagyobb városok. Nem csak az emberek szenvednek a légköri ózontól. Amerikai kutatók kimutatták például, hogy azokon a területeken, ahol magas a levegő ózontartalma, az autógumik és más gumitermékek élettartama jelentősen lecsökken.
Hogyan csökkenthető a talajréteg ózontartalma? A metán légkörbe történő kibocsátásának csökkentése aligha reális. Marad egy másik lehetőség - a nitrogén-oxidok kibocsátásának csökkentése, amely nélkül az ózonhoz vezető reakcióciklus nem megy. Ez az út sem könnyű, hiszen nem csak az autók, hanem (főleg) a hőerőművek is bocsátanak ki nitrogén-oxidokat.
Ózonforrások nem csak az utcákon vannak. Röntgenszobákban, fizikoterápiás helyiségekben (forrása higany-kvarc lámpák), fénymásolók (másolók), lézernyomtatók működése során keletkezik (itt a kialakulásának oka nagyfeszültségű kisülés). Az ózon elkerülhetetlen társ a perhidrol, argon ívhegesztés előállításához. Az ózon káros hatásainak csökkentése érdekében a motorháztetőt ultraibolya lámpákkal kell felszerelni, és a helyiséget jó szellőztetni kell.
Ennek ellenére aligha helyes az ózont természetesen károsnak tekinteni az egészségre. Minden a koncentrációjától függ. Tanulmányok kimutatták, hogy a friss levegő nagyon gyengén világít a sötétben; a ragyogás oka egy oxidációs reakció, amelyben ózon vesz részt. Izzást figyeltek meg akkor is, amikor vizet ráztak egy lombikban, amelybe előzetesen ózonizált oxigént töltöttek. Ez a ragyogás mindig kis mennyiségű szerves szennyeződés jelenlétével jár a levegőben vagy a vízben. Ha friss levegőt keverünk egy kilélegzett személlyel, a ragyogás intenzitása tízszeresére nőtt! És ez nem meglepő: a kilélegzett levegőben etilén, benzol, acetaldehid, formaldehid, aceton és hangyasav mikroszennyeződéseket találtak. Az ózon "kiemeli" őket. Ugyanakkor az „elfáradt”, i.e. Teljesen ózonmentes, bár nagyon tiszta, a levegő nem okoz fényt, és az ember úgy érzi, hogy "állott". Az ilyen levegő a desztillált vízhez hasonlítható: nagyon tiszta, gyakorlatilag nem tartalmaz szennyeződéseket, fogyasztása káros. Tehát az ózon teljes hiánya a levegőben nyilvánvalóan az ember számára is kedvezőtlen, mivel növeli a mikroorganizmusok tartalmát, káros anyagok és kellemetlen szagok felhalmozódásához vezet, amit az ózon elpusztít. Így világossá válik a helyiségek rendszeres és hosszú távú szellőztetésének szükségessége, még akkor is, ha nincsenek benne emberek: végül is a helyiségbe bejutott ózon nem marad el benne sokáig - részben lebomlik. , és nagyrészt leülepszik (adszorbeálódik) a falakon és más felületeken. Nehéz megmondani, hogy mennyi ózonnak kell lennie a szobában. Minimális koncentrációban azonban az ózon valószínűleg szükséges és előnyös.
Így az ózon időzített bomba. Ha helyesen használják, akkor az emberiséget szolgálja, de amint más célokra használják, azonnal globális katasztrófaés a Föld a Marshoz hasonló bolygóvá változik.
Amikor az elektromos szikrák oxigénen vagy levegőn áthaladnak, jellegzetes szag jelenik meg, amelynek oka egy új anyag - ózon - képződése. Az ózon tökéletesen tiszta, száraz oxigénből nyerhető; ebből következik, hogy csak oxigénből áll, és annak allotróp módosulatát képviseli.
Az ózon molekulatömege 48. Az oxigén atomtömege 16; ezért az ózonmolekula három oxigénatomból áll.
Az ózon előállításához a csendes elektromos kisülések oxigénre gyakorolt hatását használják. Az erre a célra szolgáló eszközöket ózonizátoroknak nevezzük.
Rizs. 110. Az ózonmolekula szerkezetének vázlata.

Rizs. 111. Az ózonmolekulában lévő központi oxigénatom pályáinak vázlata.
Normál körülmények között az ózon gáz. Erős hűtéssel elválasztható az oxigéntől; Az ózon kék színű folyadékká kondenzálódik, forrásponton.
Az ózon oldhatósága vízben sokkal nagyobb, mint az oxigéné: 100 térfogatrész víz 49 térfogatrész ózont old fel.
Az ózon oxigénből történő képződése az egyenlettel fejezhető ki
amiből az következik, hogy az ózonképződés standard entalpiája pozitív és egyenlő. Ráadásul, amint az egyenlet együtthatói mutatják, a reakció során három gázmolekulából két molekula keletkezik, azaz a rendszer entrópiája csökken. Ennek eredményeként a vizsgált reakcióban a Gibbs-energia standard változása is pozitív (163). Így az oxigén ózonná történő átalakulásának reakciója nem mehet spontán módon le: a megvalósításához energia szükséges. A fordított reakció - az ózon bomlása - spontán módon megy végbe, mivel e folyamat során a rendszer Gibbs-energiája csökken. Más szavakkal, az ózon instabil anyag.
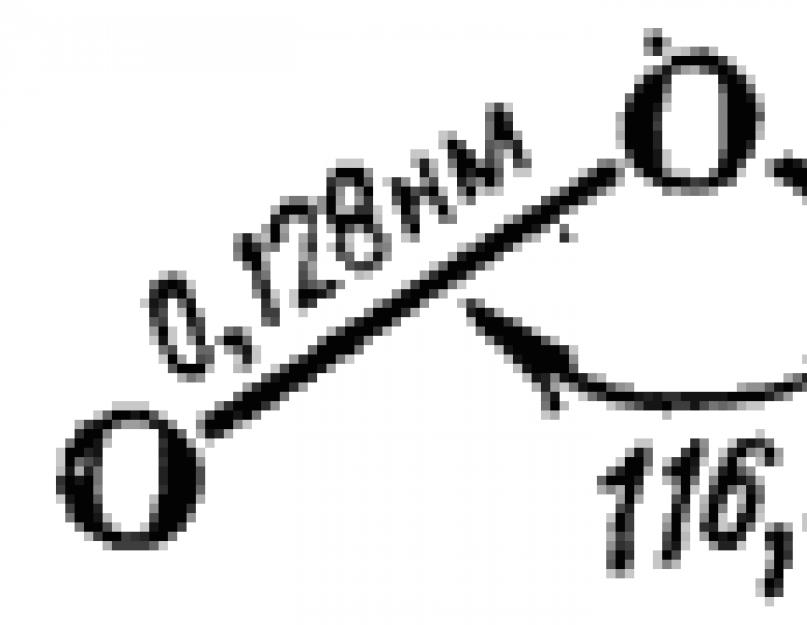
Az ózonmolekula egyenlő szárú háromszög alakúra épül fel. Felépítését sematikusan az ábra mutatja. 110. A háromszög csúcsánál bezárt szög 120°-hoz való közelsége azt jelzi, hogy a központi oxigénatom itt hibridizációs állapotban van. Ennek megfelelően a HS-módszer szempontjából a molekulaképződés a következőképpen írható le.
A központi atom egy elektront tartalmazó hibrid -pályája (111. ábra balra) átfedésben van az egyik szélső oxigénatom -pályájával, aminek következtében -kötés jön létre. A központi atom -pályája, amely nem vesz részt a hibridizációban, merőleges a molekula síkjára orientált, és egy párosítatlan elektront is tartalmaz, átfedésben van ugyanannak a szélső oxigénatomnak a hasonló elhelyezkedésű -pályájával, ami a kialakulásához vezet. egy -kötvényről. Végül az egyiket elfoglaló elektronpár donorjaként működik hibrid -pályák(111. ábra, jobbra) a központi oxigénatom a donor-akceptor módszer szerint kötést képez a másik szélső oxigénatommal.
A kapott szerkezet megfelel az A vegyértéksémának, amelyen a pontok magányos elektronpárokat, a - és -kötéseket pedig betűkkel jelölik.

Az A séma szerint a központi oxigénatom kötései a két szélső atommal nem egyenértékűek - az egyik kettős, a másik egyszerű. Azonban ezeknek a kötéseknek az azonos hossza (110. ábra) jelzi az egyenértékűségüket. Ezért az A sémával együtt az ózonmolekula szerkezete egyformán leírható a B sémával. A vegyértéksémák szuperpozíciójának módszere szempontjából (lásd 44. §) ez azt jelenti, hogy a valóságban az ózonmolekula szerkezete az ózonmolekula az A és B sémák közti köztes, és a következő alakban ábrázolható:
Itt a szaggatott vonalak az -elektronpár delokalizációját jelzik, vagyis mindhárom oxigénatomhoz való tartozását. Ezért az ózonmolekulában a -kötés háromközpontú.
Az ózonmolekula szerkezetének MO-módszer szerinti vizsgálata is arra enged következtetni, hogy itt egy háromcentrikus kötő molekulapálya jön létre.
Az ózon az egyik legerősebb oxidálószer. Minden fémet oxidál, kivéve az aranyat és a platinát, valamint a legtöbb nemfémet. A kisebb oxidokat magasabb oxidokká, a fém-szulfidokat pedig szulfátjaikká alakítja. A legtöbb ilyen reakció során az ózonmolekula egy oxigénatomot veszít, és molekulává alakul.
A kálium-jodid oldatából az ózon jódot szabadít fel:
Ha egy KI- és keményítőoldattal megnedvesített papírdarabot ózontartalmú levegőbe helyezünk, az azonnal megkékül. Ezt a reakciót az ózon felfedezésére használják.
Erős oxidálószerként az ózon elpusztítja a baktériumokat, ezért víz- és levegőfertőtlenítésre használják.
Az ózon mérgező. A maximálisan megengedhető mennyiség a levegőben, egyenlő. Ennél a koncentrációnál jól érezhető az illata. A légkör felszíni rétegében az ózontartalom általában az elektromos kisülések során kialakuló határokon belül van.
1. Mit tudunk az ÓZON-ról?
Az ózon (a görög ózon szóból - szagú) kék gáz, szúrós szaggal, erős oxidálószer. Az ózon az oxigén allotrópja. Az O3 molekulaképlete. 2,5-szer nehezebb, mint az oxigén. Víz, élelmiszer és levegő fertőtlenítésére szolgál.
Technológiák
A korona-ózon technológiára alapozva fejlesztették ki a Green World multifunkcionális anionos ozonátort, amely ózont használ fertőtlenítésre és sterilizálásra.
Az ózon kémiai elem jellemzői
Ózon, tudományos név amely O3, három oxigénatom egyesítése során keletkezik, magas oxidáló funkcióval rendelkezik, amely hatékony a fertőtlenítésben és a sztearizálásban. Képes elpusztítani a legtöbb baktériumot a vízben és a levegőben. Hatékony fertőtlenítőnek és fertőtlenítőnek tartják. Az ózon a légkör fontos összetevője. Légkörünk 0,01 ppm-0,04 ppm ózont tartalmaz, ami egyensúlyba hozza a baktériumok szintjét a természetben. Az ózon természetes módon is keletkezik zivatarok alatti villámkisülések következtében. A villám elektromos kisülése során kellemes édes szag szabadul fel, amit friss levegőnek nevezünk.
Az ózonmolekulák instabilak és nagyon gyorsan oxigénmolekulákká bomlanak le. Ez a minőség az ózont értékes gáz- és víztisztítóvá teszi. Az ózonmolekulák más anyagok molekuláival egyesülve lebomlanak, ennek eredményeként a szerves vegyületeket oxidálja, ártalmatlan szén-dioxiddá és vízzé alakítva. Mivel az ózon könnyen lebomlik oxigénmolekulákra, lényegesen kevésbé mérgező, mint más fertőtlenítőszerek, például a klór. „A legtisztább oxidáló- és fertőtlenítőszernek” is nevezik.
Az ózon tulajdonságai - elpusztítja a mikroorganizmusokat
1. elpusztítja a baktériumokat
a) elpusztítja a legtöbb coli baktériumot és staphylococcust a levegőben
b) elpusztítja a tárgyak felületén a coli baktériumok 99,7%-át és a staphylococcusok 99,9%-át
c) elpusztítja a coli baktériumok, staphylococcusok és szalmonella csoportba tartozó mikrobák 100%-át foszfátvegyületekben
d) Elpusztítja a vízben lévő coli-baktériumok 100%-át
2. Elpusztítja a baktérium spórákat
a) elpusztítja a brevibacteium spórákat
b) a levegőben lévő baktériumok elpusztításának képessége
c) Elpusztítja a vízben lévő brevibacteumspórák 99,999%-át
3. elpusztítja a vírusokat
a) elpusztítja a HBsAg 99,99%-át és a HAAg 100%-át
b) elpusztítja az influenzavírust a levegőben
c) másodpercek vagy percek alatt elpusztítja a PVI-t és a hepatitis A vírust vízben
d) elpusztítja az SA-11 vírust vízben
e) ha az ózon koncentrációja a vérszérumban eléri a 4 mg/l-t, 106cd50/ml mennyiségben képes elpusztítani a HIV-t
a) 100%-ban elpusztítja az aspergillus versicolort és a penicilliumot
b) 100%-ban elpusztítja az aspergillusniger, a fusariumoxysporumf.sp.melonogea és a fusariumoxysporumf.sp. lycopersici
c) elpusztítja az aspergillus niger és a candida baktériumokat
2. Hogyan keletkezik az ózon a természetben?
Molekuláris oxigénből (O2) keletkezik elektromos kisülés vagy ultraibolya sugárzás hatására. Ez különösen az oxigénben gazdag helyeken észlelhető: erdőben, tengerparton vagy vízesés közelében. Napfény hatására egy csepp vízben lévő oxigén ózonná alakul. Zivatar után is érezni az ózonszagot, amikor az elektromos kisülés hatására keletkezik.
3. Miért tűnik tisztábbnak a levegő egy zivatar után?
Az ózon oxidálja a szerves anyagok szennyeződéseit és fertőtleníti a levegőt, kellemes frissességet adva (zivatar illata). Az ózon jellegzetes szaga 10-7%-os koncentrációban jelenik meg.
4. Mi az ózonoszféra? Milyen hatással van a bolygó életére?
Az ózon fő tömege a légkörben 10-50 km magasságban helyezkedik el, maximális koncentrációja 20-25 km magasságban, és egy ózonoszférának nevezett réteget alkot.
Az ózonoszféra visszaveri a kemény ultraibolya sugárzást, megvédi az élő szervezeteket a sugárzás káros hatásaitól. „A levegő oxigénjéből ózon képződésének köszönhetően vált lehetségessé a szárazföldi élet.
5. Mikor fedezték fel az ózont és mi a használatának története?
Az ózont először 1785-ben írták le. Mac Van Marum holland fizikus.
1832-ben prof. Schonbein, a Bázeli Egyetem munkatársa kiadta „Az ózon kémiai termelése” című könyvét. Az „ózon” nevet a görög „szaglás” szóból adta.
1857-ben Werner von Siemens tervezte az első műszaki berendezést az ivóvíz tisztítására. Azóta az ózonozás lehetővé tette a higiéniailag tiszta víz előállítását.
1977-ig Világszerte több mint 1000 ivóvíz-ózonozó üzem működik. Jelenleg Európában az ivóvíz 95%-át ózonnal kezelik. Az ózonozás széles körben elterjedt Kanadában és az USA-ban. Oroszországban több nagy állomás található, amelyeket ivóvíz utókezelésére, uszodavíz előkészítésére, valamint szennyvíz mélytisztítására használnak az autómosók újrahasznosító vízellátásában.
Az ózont először antiszeptikumként használták az első világháború idején.
1935 óta ózon-oxigén keverék rektális adagolását kezdte alkalmazni különféle bélbetegségek (proktitis, aranyér, colitis ulcerosa, fistulák, elnyomás) kezelésére. patogén mikroorganizmusok, a bélflóra helyreállítása).
Az ózon hatásának vizsgálata lehetővé tette a sebészeti gyakorlatban történő alkalmazását fertőző elváltozások, tuberkulózis, tüdőgyulladás, hepatitis, herpeszfertőzés, vérszegénység stb.
Moszkvában 1992-ben. az Orosz Föderáció Tisztelt Tudósa, MD irányítása alatt. Zmyzgovoy A.V. létrejött az "Ózonterápia Tudományos és Gyakorlati Központja", ahol az ózont számos betegség kezelésére használják. Folytatódik a hatékony, nem károsító, ózonos expozíciós módszerek fejlesztése. Ma az ózon népszerűnek számít és hatékony eszköz víz, levegő fertőtlenítése és élelmiszerek tisztítása. Ezenkívül az oxigén-ózon keverékeket különféle betegségek kezelésében, kozmetológiában és számos kezelési területen használják.
6. Tudsz ózont lélegezni? Az ózon káros gáz?
A nagy koncentrációjú ózon belélegzése valóban veszélyes, megégetheti a légzőszervek nyálkahártyáját.
Az ózon erős oxidálószer. Itt rejlenek pozitív és káros tulajdonságai. Minden a koncentrációtól függ, pl. a levegő ózontartalmától. A cselekvése olyan, mint a tűz... Kis mennyiségben támogat és gyógyít, nagy mennyiségben pusztít.
7. Mikor használnak alacsony és magas koncentrációjú ózont?
Viszonylag magas koncentrációt használnak fertőtlenítésre, míg az alacsonyabb koncentrációjú ózon nem károsítja a fehérjeszerkezeteket és elősegíti a gyógyulást.
8. Milyen hatással van az ózon a vírusokra?
Az ózon elnyomja (inaktiválja) a vírust a sejten kívül és belül egyaránt, részben tönkretéve annak héját. Szaporodási folyamata leáll, és a vírusoknak a szervezet sejtjeivel való kapcsolódási képessége megszakad.
9. Hogyan nyilvánul meg az ózon baktériumölő tulajdonsága mikroorganizmusok hatásának kitéve?
Ha ózonnak vannak kitéve mikroorganizmusokon, beleértve az élesztőt is, sejtmembránjuk lokálisan károsodik, ami elpusztul, vagy nem képesek szaporodni. Megfigyelték a mikroorganizmusok antibiotikumokkal szembeni érzékenységének növekedését.
Kísérletek kimutatták, hogy a gáznemű ózon szinte minden típusú baktériumot, vírust, penészgombát és élesztőszerű gombát és protozoát elpusztít. Az ózon 1-5 mg/l koncentrációban az Escherichia coli, streptococcusok, mukobaktériumok, filokokkuszok, Escherichia és Pseudomonas aeruginosa, Proteus, Klebsiella stb. 99,9%-ának elpusztulásához vezet 4-20 percen belül.
10. Hogyan működik az ózon az élettelen természetben?
Az ózon reakcióba lép a legtöbb szerves és szervetlen anyaggal. A reakciók során oxigén, víz, szén-oxidok és más elemek magasabb oxidjai képződnek. Mindezek a termékek nem szennyeznek környezetés nem vezetnek rákkeltő anyagok képződéséhez, ellentétben a klór- és fluorvegyületekkel.
11. Veszélyesek lehetnek-e a levegő ózonozása során a lakóterekben képződő vegyületek?
A háztartási ozonátor által létrehozott ózonkoncentrációk ártalmatlan vegyületek képződéséhez vezetnek a lakóterületeken. A helyiség ózonozása következtében megnövekszik a levegő oxigéntartalma, és megtisztul a vírusoktól és baktériumoktól.
12. Milyen vegyületek keletkeznek a beltéri levegő ózonozása során?
A minket körülvevő vegyületek többsége reakcióba lép az ózonnal és ártalmatlan vegyületeket képez.
Legtöbbjük szén-dioxidra, vízre és szabad oxigénre bomlik. Egyes esetekben inaktív (ártalmatlan) vegyületek (oxidok) keletkeznek. Vannak úgynevezett nem reaktív anyagok is - titán-, szilícium-, kalcium-oxidok stb. Nem reagálnak az ózonnal.
13. Szükséges-e ózonozni a levegőt a légkondicionált helyiségekben?
Miután a levegő áthalad a légkondicionálókon és a fűtőberendezéseken, a levegő oxigéntartalma csökken, és a levegő mérgező összetevőinek szintje sem. Ezenkívül a régi klímaberendezések maguk is szennyezés és fertőzés forrásai. "Zárt szoba szindróma" - fejfájás, fáradtság, gyakori légzési problémák. Az ilyen helyiségek ózonozása egyszerűen szükséges.
14. Fertőtleníthető a klíma?
Igen tudsz.
15. Hatékony-e a levegős ózonozás alkalmazása a füstös helyiségek és a javítás utáni helyiségek szagának (festék-, lakk-szag) megszüntetésére?
Igen, hatásos. A feldolgozást többször kell elvégezni, nedves tisztítással kombinálva.
16. Milyen koncentrációjú ózon káros a baktériumokra, gombákra az otthoni levegőben?
Az 1 000 000 000 levegőrészecskére vetített 50 ózonrészecske koncentráció jelentősen csökkenti a légszennyezést. Különösen erős hatás kiderül, hogy Escherichia coli, szalmonella, staphylococcus aureus, candida, aspergillus.
17. Voltak-e kutatások az ózonizált levegő emberre gyakorolt hatásairól?
Különösen egy kísérletet írnak le, amelyet 5 hónapon keresztül végeztek két embercsoporttal - kontroll és teszt.
A vizsgálati csoport helyiségének levegőjét 15 ózonrészecske/1 000 000 000 levegőrészecske koncentrációjú ózon töltötte meg. Minden alany jó egészségi állapotot, az ingerlékenység eltűnését állapította meg. Az orvosok a vér oxigéntartalmának növekedését, az immunrendszer erősödését, a nyomás normalizálódását és a stressz számos tünetének eltűnését észlelték.
18. Az ózon káros a testsejtekre?
A háztartási ozonizálók által létrehozott ózonkoncentráció elnyomja a vírusokat és mikroorganizmusokat, de nem károsítja a szervezet sejtjeit, mert. az ózon nem károsítja a bőrt. Az emberi test egészséges sejtjei természetes védekezéssel rendelkeznek az oxidáció káros hatásaival szemben (antioxidáns). Más szóval, az ózon hatása az élő szervezetekre nézve szelektív.
Ez nem zárja ki az óvintézkedések alkalmazását. Az ózonozás során a helyiségben tartózkodni nem kívánatos, az ózonozás után a helyiséget szellőztetni kell. Az ózonizátort gyermekek számára hozzáférhetetlen helyre kell helyezni, vagy nem lehet bekapcsolni.
19. Milyen teljesítményű az ozonátor?
Normál üzemmódban - 200 mg / óra, fokozottan - 400 mg / óra. Mekkora az ózon koncentrációja a helyiségben az ozonátor működése következtében? A koncentráció függ a helyiség térfogatától, az ozonátor helyétől, a levegő páratartalmától és hőmérsékletétől. Az ózon nem stabil gáz, és gyorsan lebomlik, ezért az ózon koncentrációja nagymértékben függ az időtől. Indikatív adatok 0,01 - 0,04 PPm.
20. Milyen ózonkoncentrációkat tekintünk a levegőben korlátozónak?
A 0,5-2,5 PPm (0,0001 mg/l) ózonkoncentráció biztonságosnak tekinthető.
21. Miért alkalmazzák a vizes ózonozást?
Az ózont fertőtlenítésre, a szennyeződések, a víz szagának és színének eltávolítására használják.
1. A víz klórozásával és fluorozásával ellentétben az ózonozás során semmi idegen anyag nem kerül a vízbe (az ózon gyorsan lebomlik). Ugyanakkor az ásványi összetétel és a pH változatlan marad.
2. Az ózon rendelkezik a legnagyobb fertőtlenítő tulajdonsággal a kórokozókkal szemben.
3. Pusztítsa el a vízben lévő szerves anyagokat, ezáltal megakadályozza további fejlődés mikroorganizmusok.
4. Káros vegyületek képződése nélkül a legtöbb vegyszer megsemmisül. Ide tartoznak a peszticidek, gyomirtó szerek, kőolajtermékek, detergensek, kén- és klórvegyületek, amelyek rákkeltő anyagok.
5. A fémek inaktív vegyületekké oxidálódnak, beleértve a vasat, mangánt, alumíniumot stb. Az oxidok kicsapódnak és könnyen szűrhetők.
6. A gyorsan lebomló ózon oxigénné alakul, javítja az ízt és gyógyászati tulajdonságai víz.
23. Mekkora az ózonozáson átesett víz savassági indexe?
A víz pH-ja enyhén lúgos = 7,5-9,0. Ez a víz ivásra ajánlott.
24. Mennyivel nő a víz oxigéntartalma ózonozás után?
A víz oxigéntartalma 12-szeresére nő.
25. Milyen gyorsan bomlik le az ózon levegőben, vízben?
10 perc után a levegőben. az ózonkoncentráció felére csökken, oxigén és víz keletkezik.
20-30 perc múlva vízben. Az ózon kettéhasad, hidroxilcsoportot és vizet képezve.
26. Hogyan befolyásolja a vízmelegítés a benne lévő oxigéntartalmat?
A víz oxigéntartalma melegítés után csökken.
27. Mi határozza meg az ózon koncentrációját a vízben?
Az ózonkoncentráció a szennyeződésektől, a hőmérséklettől, a víz savasságától, az anyagtól és a tartály geometriájától függ.
28. Miért az O 3 molekulát használják, és nem az O-t? 2 ?
Az ózon körülbelül 10-szer jobban oldódik vízben, mint az oxigén, és erősen konzervált. Minél alacsonyabb a víz hőmérséklete, annál hosszabb a tárolási idő.
29. Miért jó oxigénes vizet inni?
Az ózon használata növeli a szövetek és szervek glükózfogyasztását, növeli a vérplazma oxigénnel való telítettségét, csökkenti az oxigénhiány mértékét és javítja a mikrokeringést.
Az ózon pozitív hatással van a máj és a vesék anyagcseréjére. Támogatja a szívizom munkáját. Csökkenti a légzésszámot és növeli a légzési térfogatot.
30. Mire való a háztartási ozonátor?
A háztartási ozonátor a következőkre használható:
a levegő fertőtlenítése és szagtalanítása lakóhelyiségekben, fürdőszobákban és WC helyiségekben, öltözőkben, szekrényekben, hűtőszekrényekben stb.;
élelmiszer-feldolgozás (hús, hal, tojás, zöldségek és gyümölcsök);
vízminőség javítása (fertőtlenítés, oxigéndúsítás, klór és egyéb káros szennyeződések eltávolítása);
otthoni kozmetika (korpásodás, akné megszüntetése, gargarizálás, fogmosás, gombás betegségek megszüntetése, ózonos olaj készítése);
háziállatok és halak gondozása;
zománc szobanövényekés vetőmagkezelés;
fehérítés és színezés a vászonnak;
cipőfeldolgozás.
31. Milyen hatása van az ózon használatának az orvosi gyakorlatban?
Az ózon antibakteriális, vírusellenes hatással rendelkezik (inaktiválja a vírusokat és elpusztítja a spórákat).
Az ózon számos biokémiai folyamatot aktivál és normalizál.
Az ózonterápiával elért hatást a következők jellemzik:
a méregtelenítő folyamatok aktiválása, elnyomás történik
külső és belső méreganyagok aktivitása;
anyagcsere-folyamatok aktiválása (anyagcsere-folyamatok);
fokozott mikrokeringés (vérellátás
a vér reológiai tulajdonságainak javítása (a vér mozgékony lesz);
kifejezett fájdalomcsillapító hatása van.
32. Hogyan hat az ózon az emberi immunitásra?
Növeli a sejtes és humorális immunitást. Aktiválódik a fagocitózis, fokozódik az interferonok és más nem specifikus testrendszerek szintézise.
33. Hogyan hat az ózonozás az anyagcsere folyamatokra?
Az ózon használata növeli a szövetek és szervek glükózfogyasztását, növeli a vérplazma oxigénnel való telítettségét, csökkenti az oxigénhiány mértékét és javítja a mikrokeringést. Az ózon pozitív hatással van a máj és a vesék anyagcseréjére. Támogatja a szívizom munkáját. Csökkenti a légzésszámot és növeli a légzési térfogatot.
34. Ózon képződik a hegesztés és a fénymásoló működése közben. Ez az ózon káros?
Igen, káros, mivel ebben az esetben veszélyes szennyeződések képződnek. Az ózonizáló által termelt ózon tiszta, ezért ártalmatlan.
35. Van-e különbség az ipari, orvosi és háztartási ózonizátorok között?
Az ipari ózonizátorok magas koncentrációjú ózont adnak, ami veszélyes otthoni használatra.
Az orvosi és háztartási ozonizátorok teljesítményét tekintve közel állnak egymáshoz, de az orvosiakat hosszabb ideig tartó folyamatos működésre tervezték.
36. Melyek a fertőtlenítés összehasonlító jellemzői ultraibolya egységek és ózonizátorok használatakor?
Az ózon 2,5-6-szor hatékonyabb, mint az ultraibolya sugárzás, és 300-600-szor hatékonyabb a klórnál a baktériumok és vírusok elpusztító képessége szempontjából. Ugyanakkor, ellentétben a klórral, az ózon még a férgek cisztáit és a herpeszvírust és a tuberkulózist is elpusztítja.
Az ózon eltávolítja a szerves és kémiai anyagokat a vízből, vízzé, szén-dioxiddá bomlik, inaktív elemekből csapadékot képezve.
Az ózon könnyen oxidálja a vas- és mangánsókat, oldhatatlan anyagokat képezve, amelyeket ülepítéssel vagy szűréssel eltávolítanak. Ennek eredményeként az ózonos víz biztonságos, tiszta és kellemes ízű.
37. Lehet ózonnal fertőtleníteni az edényeket?
Igen! Jó fertőtleníteni a gyerekedényeket, befőttes edényeket stb. Ehhez helyezze az edényeket egy vízzel ellátott edénybe, a légcsatornát egy elválasztóval engedje le. Az eljárás 10-15 percig tart.
38. Milyen anyagokból készüljenek az ózonozó edények?
Üveg, kerámia, fa, műanyag, zománcozott (nincs forgács vagy repedés). Ne használjon fémet, beleértve az alumínium és réz edényeket. A gumi nem ellenáll az ózonnal való érintkezésnek.
Az amerikai Green World vállalat anionos ozonátora nemcsak megőrzi egészségét, hanem jelentősen javítja is. Lehetősége van egy nélkülözhetetlen eszköz használatára otthonában - egy anionos ózonizátor, amely egyesíti mind a légionizáló, mind az ózonizáló (multifunkcionális...
Az autó ozonátora megvilágítással és aromatizátorral van ellátva. Az ózonozás és az ionizációs mód egyszerre kapcsolható be. Ezek a módok külön-külön is engedélyezhetők. Ez az ózonizátor nélkülözhetetlen a hosszú utakon, amikor a vezető fáradtabb, romlik a látás és a memória. Az ózonizáló enyhíti az álmosságot, lendületet ad a beáramló...
Az ÓZON O3 (a görög ózonszagú szóból) az oxigén allotróp módosulata, amely mindhárom aggregációs állapotában létezhet. Az ózon instabil vegyület, szobahőmérsékleten is lassan bomlik le molekuláris oxigénné, de az ózon nem gyök.
Fizikai tulajdonságok
Molekulatömeg = 47,9982 g/mol. A gáznemű ózon sűrűsége 2,144 10-3 g/cm3 1 atm nyomáson és 29°C-on.
Az ózon különleges anyag. Rendkívül instabil, és a koncentráció növelésével könnyen aránytalanít az általános séma szerint: 2O3 -> 3O2. Gáznemű formában az ózon kékes árnyalatú, ami észrevehető, ha a levegő ózontartalma 15-20%.
Ózon at normál körülmények között- szúrós szagú gáz. Nagyon alacsony koncentrációban az ózon illata kellemes frissességként érzékelhető, de a koncentráció növelésével kellemetlenné válik. A fagyasztott ruha szaga az ózon szaga. Könnyű megszokni.
Fő mennyisége az úgynevezett "ózonövben" koncentrálódik 15-30 km magasságban. A Föld felszínén az ózon koncentrációja sokkal kisebb és az élőlények számára abszolút biztonságos; még az a vélemény is létezik, hogy teljes hiánya szintén negatívan befolyásolja az ember teljesítményét.
Körülbelül 10 MPC koncentrációnál az ózon nagyon jól érezhető, de néhány perc múlva az érzés szinte teljesen eltűnik. Ezt szem előtt kell tartani, amikor dolgozik vele.
Az ózon azonban a földi élet megőrzését is biztosítja, mert. Az ózonréteg megtartja a 300 nm-nél kisebb hullámhosszú nap UV-sugárzásának legkárosabb részét, amely a legkárosabb az élő szervezetekre és a növényekre, és a CO2-val együtt elnyeli a Föld infravörös sugárzását, megakadályozva annak lehűlését.
Az ózon jobban oldódik a vízben, mint az oxigén. A vízben az ózon sokkal gyorsabban bomlik le, mint a gázfázisban, és a szennyeződések, különösen a fémionok jelenléte rendkívül nagy hatással van a bomlási sebességre.
1. ábra. Az ózon bomlása a különféle típusok 20 °C hőmérsékletű víz (1 - bidesztillátum; 2 - desztillátum; 3 - csapvíz; 4 - szűrt tóvíz)
Az ózont a szilikagél és az alumínium-oxid gél jól adszorbeálja. Az ózon parciális nyomásán, például 20 Hgmm. Art., és 0 ° C-on a szilikagél körülbelül 0,19 tömeg% ózont nyel el. Alacsony hőmérsékleten az adszorpció észrevehetően gyengül. Adszorbeált állapotban az ózon nagyon stabil. Az ózon ionizációs potenciálja 12,8 eV.
Az ózon kémiai tulajdonságai
Két fő jellemzőjükben különböznek - instabilitás és oxidáló képesség. Kis koncentrációban levegővel keveredve viszonylag lassan bomlik le, de a hőmérséklet emelkedésével bomlása felgyorsul, és 100 °C feletti hőmérsékleten igen gyorssá válik.
Az NO2, Cl jelenléte a levegőben, valamint a fémoxidok - ezüst, réz, vas, mangán - katalitikus hatása felgyorsítja az ózon bomlását. Az ózon olyan erős oxidáló tulajdonságokkal rendelkezik, mert az egyik oxigénatom nagyon könnyen leválik a molekulájáról. Könnyen átjut oxigénbe.
Az ózon normál hőmérsékleten oxidálja a legtöbb fémet. Az ózon savas vizes oldatai meglehetősen stabilak, lúgos oldatokban az ózon gyorsan lebomlik. A változó vegyértékű fémek (Mn, Co, Fe stb.), számos oxid, peroxid és hidroxid hatékonyan roncsolják az ózont. A legtöbb fémfelületet oxidfilm borítja a fém legmagasabb vegyértékű állapotában (például PbO2, AgO vagy Ag2O3, HgO).
Az ózon minden fémet oxidál, kivéve az arany és a platina csoportba tartozó fémeket, reakcióba lép a legtöbb elemmel, lebontja a hidrogén-halogenideket (kivéve a HF-et), az alacsonyabb oxidokat magasabb oxidokká alakítja stb.
Nem oxidálja az aranyat, platinát, irídiumot, 75%Fe + 25%Cr ötvözetet. A fekete ólom-szulfid PbS fehér szulfát PbSO4, az arzén-anhidrid As2O3 arzén As2O5 stb.
Az ózon reakciója változó vegyértékű fémionokkal (Mn, Cr és Co) in utóbbi évek gyakorlati alkalmazását találja színezékek, PP-vitamin (izonikotinsav) stb. közbenső termékeinek szintézisében. A mangán- és krómsók keverékei oxidálható vegyületet (például metil-piridinek) tartalmazó savas oldatban az ózon hatására oxidálódnak. Ebben az esetben a Cr3+ ionok átmennek a Cr6+-ba, és csak a metilcsoportoknál oxidálják a metilpiridineket. Fémsók hiányában a túlnyomórészt aromás mag elpusztul.
Az ózon számos, a légkörben jelen lévő gázzal is reakcióba lép. A H2S hidrogén-szulfid ózonnal kombinálva szabad ként szabadul fel, az SO2 kénsav-anhidrid pedig kénsavas SO3-dá alakul; dinitrogén-oxid N2O - NO-vá, nitrogén-monoxid NO gyorsan NO2-vé oxidálódik, viszont az NO2 az ózonnal is reagál, és végül N2O5 keletkezik; ammónia NH3 - nitrogén ammónium sóvá NH4NO3.
Az ózon és a szervetlen anyagok egyik legfontosabb reakciója a kálium-jodid lebomlása. Ezt a reakciót széles körben használják az ózon mennyiségi meghatározására.
Egyes esetekben az ózon szilárd anyagokkal is reakcióba lép, ózonidokat képezve. Az alkálifémek, alkáliföldfémek ózonidjai: stroncium, bárium izolálásra kerültek, stabilizációjuk hőmérséklete a jelzett sorozatban emelkedik; A Ca(O3)2 238 K-en, a Ba(O3)2 273 K-en stabil. Az ózonidok szuperperoxiddá bomlanak, például NaO3 -> NaO2 + 1/2O2. Az ózon és szerves vegyületek reakciói során különféle ózonidok is keletkeznek.
Az ózon számos szerves anyagot, telített, telítetlen és ciklikus szénhidrogéneket oxidál. Számos munka jelent meg az ózon és különböző aromás szénhidrogének reakciótermékeinek összetételének vizsgálatáról: benzol, xilol, naftalin, fenantrén, antracén, benzantracén, difenil-amin, kinolin, akrilsav stb. Fehéríti az indigót és sok más szerves anyagot. színezékek, amelyek miatt még szövetfehérítésre is használják.
A kettős C=C kötéssel rendelkező ózon reakciósebessége 100 000-szer gyorsabb, mint az egyszeres ózon reakciósebessége. C-C csatlakozás. Ezért elsősorban a gumikat és a gumikat érinti az ózon. Az ózon reakcióba lép a kettős kötéssel, és közbenső komplexet képez:

Ez a reakció meglehetősen gyorsan megy végbe már 0 °C alatti hőmérsékleten. Telített vegyületek esetén az ózon a szokásos oxidációs reakció elindítója:

Érdekes az ózon kölcsönhatása néhány szerves festékkel, amelyek erősen fluoreszkálnak ózon jelenlétében a levegőben. Ilyen például az eikrozin, a riboflavin és a luminol (triaminoftálhidrazid), és különösen a rodamin-B és ehhez hasonlóan a rodamin-C.
Az ózon magas oxidációs tulajdonságai, a szerves anyagokat és a fémeket (különösen a vasat) oldhatatlan formává bontja, képes a vízben oldódó gáznemű vegyületeket lebontani, a vizes oldatokat oxigénnel telíteni, az ózon vízben való alacsony perzisztenciáját és az önpusztítást emberre veszélyes tulajdonságairól – mindez együttesen teszi az ózont a legvonzóbb anyaggá a háztartási víz készítéséhez és a különféle szennyvizek kezeléséhez.
Ózon szintézis
Az ózon oxigént tartalmazó gáznemű közegben képződik, ha olyan körülmények állnak fenn, amelyek között az oxigén atomokra disszociál. Ez az elektromos kisülés minden formája esetén lehetséges: izzás, ív, szikra, korona, felület, gát, elektróda nélküli stb. A disszociáció fő oka a molekuláris oxigén és az elektromos térben felgyorsított elektronok ütközése.
Az oxigén disszociációt a kisülésen kívül a 240 nm-nél kisebb hullámhosszú UV-sugárzás és a különféle nagyenergiájú részecskék okozzák: alfa-, béta-, gamma-részecskék, röntgensugarak stb. Az ózon a víz elektrolízisével is keletkezik.
Az ózonképződés szinte minden forrásában van egy reakciócsoport, amelynek eredményeként az ózon lebomlik. Zavarják az ózonképződést, de valóban léteznek, és ezeket figyelembe kell venni. Ez magában foglalja a reaktor térfogatában és falain történő hőbomlást, a gyökökkel és gerjesztett részecskékkel való reakcióit, az adalékanyagokkal és szennyeződésekkel való reakciókat, amelyek érintkezésbe kerülhetnek oxigénnel és ózonnal.
A teljes mechanizmus jelentős számú reakcióból áll. A valódi létesítmények, függetlenül attól, hogy milyen elven működnek, magas energiaköltségeket mutatnak az ózon előállításához. Az ózongenerátor hatásfoka attól függ, hogy a keletkező ózon egységnyi tömegére milyen - teljes vagy aktív - teljesítményt számítanak ki.
gát kisülés
Gátkisülés alatt olyan kisülést értünk, amely két dielektrikum vagy egy dielektrikum és egy fém között lép fel. Tekintettel arra, hogy az elektromos áramkört egy dielektrikum megszakítja, az áramellátást csak váltakozó áram biztosítja. A Siemens 1897-ben javasolta először a modernekhez közeli ozonátort.
Alacsony teljesítményen az ózonizáló nem hűthető, mivel a felszabaduló hőt az oxigén és az ózon áramlása elvezeti. BAN BEN ipari termelésekózont szintetizálnak ívozonizálókban (plazmatronok), izzó ózongenerátorokban (lézerekben) és felületi kisülésekben is.
Fotokémiai módszer
A Földön keletkező ózon nagy része a természetben keletkezik fotokémiai folyamatokkal. BAN BEN gyakorlati tevékenységek Emberben a fotokémiai szintézis módszerek kisebb szerepet játszanak, mint a szintézisek a gát kisülésében. Felhasználásuk fő területe közepes és alacsony koncentrációjú ózon előállítása. Ilyen ózonkoncentrációra van szükség például gumitermékek repedésállóságának vizsgálatakor a légköri ózon hatására. A gyakorlatban az ózon ezzel a módszerrel történő előállításához higany- és xenon excimer lámpákat használnak.
Elektrolitikus szintézis módszer
Az ózon elektrolitikus folyamatok során történő képződésének első említése 1907-ből származik. Képződésének mechanizmusa azonban mindeddig tisztázatlan.
Általában perklór- vagy kénsav vizes oldatait használják elektrolitként, az elektródák platinából készülnek. Az O18-cal jelölt savak használata azt mutatta, hogy az ózonképződés során nem adják le oxigénjüket. Ezért a bruttó rendszernek csak a víz bomlását kell figyelembe venni:
H2O + O2 -> O3 + 2H+ + e-
ionok vagy gyökök esetleges közbenső képződésével.
Az ózon képződése ionizáló sugárzás hatására
Az ózon számos folyamatban képződik, amelyet egy oxigénmolekula fény vagy elektromos tér általi gerjesztése kísér. Oxigénnel besugározva ionizáló sugárzás gerjesztett molekulák is előfordulhatnak, és ózonképződés figyelhető meg. Az ionizáló sugárzás hatására képződő ózont még nem használták fel az ózon szintézisére.
Ózonképződés a mikrohullámú térben
Amikor oxigénsugarat vezettek át a mikrohullámú mezőn, ózonképződést figyeltek meg. Ezt a folyamatot kevéssé tanulmányozták, bár a jelenségre épülő generátorokat gyakran alkalmazzák a laboratóriumi gyakorlatban.
Az ózon használata a mindennapi életben és hatása az emberre
Víz, levegő és egyéb anyagok ózonozása
Az ózonozott víz nem tartalmaz mérgező halometánokat - a víz klóros sterilizálásának tipikus szennyeződéseit. Az ózonosítási eljárást habfürdőben vagy keverőben hajtják végre, amelyben a szuszpenziókból tisztított vizet ozonizált levegővel vagy oxigénnel keverik össze. Az eljárás hátránya az O3 gyors elpusztulása a vízben (felezési idő 15-30 perc).
Az ózonozást is alkalmazzák Élelmiszeripar hűtőszekrények, raktárak sterilizálására, a kellemetlen szag megszüntetésére; az orvosi gyakorlatban - nyílt sebek fertőtlenítésére és egyes krónikus betegségek (trofikus fekélyek, gombás betegségek) kezelésére, vénás vér ózonozására, élettani megoldásokra.
A modern ózonizátorok, amelyekben az ózont levegőben vagy oxigénben történő elektromos kisüléssel nyerik, ózongenerátorokból és tápegységekből állnak, és szerves részét képezik az ózonozó berendezéseknek, amelyek az ózonizátorokon kívül kiegészítő eszközöket is tartalmaznak.
Jelenleg az ózon az úgynevezett ózontechnológiákban használt gáz: ivóvíz tisztítása és előkészítése, szennyvízkezelés (háztartási és ipari szennyvíz), gázhulladék stb.
Az ózonfelhasználási technológiától függően az ózongenerátor termelékenysége óránként egy gramm töredékétől több tíz kilogramm ózonig terjedhet. Speciális ózonizátorokat használnak orvosi műszerek és kis berendezések gázsterilizálására. A sterilizálás mesterségesen nedvesített ózon-oxigén környezetben történik, amely kitölti a sterilizáló kamrát. A sterilizálási ciklus a sterilizálókamra levegőjének párásított ózon-oxigén keverékkel való helyettesítésének szakaszából, a sterilizálási expozíció szakaszából és a kamrában lévő ózon-oxigén keverék mikrobiológiailag tisztított levegővel való helyettesítésének szakaszából áll.
A gyógyászatban az ózonterápiához használt ózonizátorok széles tartományban szabályozzák az ózon-oxigén keverék koncentrációját. Az ózon-oxigén keverék generált koncentrációjának garantált pontosságát az ózonizáló automatizálási rendszer szabályozza és automatikusan fenntartja.
Az ózon biológiai hatása
Az ózon biológiai hatása az alkalmazás módjától, dózisától és koncentrációjától függ. Számos hatása különböző koncentráció-tartományokban jelenik meg változó mértékben. Az ózonterápia terápiás hatásának alapja az ózon-oxigén keverékek alkalmazása. Az ózon magas redoxpotenciálja okozza szisztémás (oxigén homeosztázis helyreállítása) és lokális (kifejezetten fertőtlenítő) terápiás hatását.
Az ózont először A. Wolff használta antiszeptikus szerként 1915-ben fertőzött sebek kezelésére. Az elmúlt években az ózonterápiát az orvostudomány szinte minden területén sikerrel alkalmazták: sürgősségi és gennyes sebészetben, általános ill. fertőző terápia, nőgyógyászat, urológia, gasztroenterológia, bőrgyógyászat, kozmetológia stb. Az ózon felhasználása a szervezetre gyakorolt egyedülálló hatásának köszönhető, beleértve az ózont. immunmoduláló, gyulladáscsökkentő, baktericid, vírusölő, gombaölő stb.
Nem tagadható azonban, hogy az ózon orvosi felhasználásának módszerei számos biológiai mutató nyilvánvaló előnyei ellenére még mindig széles körű alkalmazás nem kapta meg. Irodalmi adatok szerint a magas ózonkoncentráció szinte minden mikroorganizmus-törzsre abszolút baktericid hatású. Ezért az ózont a klinikai gyakorlatban univerzális antiszeptikumként használják a különböző etiológiájú és lokalizációjú fertőző és gyulladásos gócok rehabilitációjában.
Az irodalomban vannak adatok az antiszeptikus készítmények ózonozás utáni fokozott hatékonyságáról az akut gennyes sebészeti betegségek kezelésében.
Következtetések az ózon háztartási felhasználásával kapcsolatban
Mindenekelőtt feltétel nélkül meg kell erősíteni az ózon gyógyítás gyakorlatában való felhasználásának tényét az orvostudomány számos területén, mint terápiás és fertőtlenítő szer, de széleskörű használatáról még nem lehet beszélni.
Az ózont a legkevésbé káros allergiás megnyilvánulásokkal rendelkező személy észleli. És még ha a szakirodalomban is találunk említést az egyéni O3 intoleranciáról, akkor ezek az esetek nem hasonlíthatók össze például klórtartalmú és más halogénezett antibakteriális gyógyszerekkel.
Az ózon háromatomos oxigén, és a leginkább környezetbarát. Ki ne ismerné a „frissesség” illatát – zivatar utáni forró nyári napokon?! Állandó jelenlétét a föld légkörében minden élő szervezet megtapasztalja.
Az áttekintés az internetről származó anyagokon alapul.
A tudósok először akkor lettek figyelmesek egy ismeretlen gáz létezésére, amikor elektrosztatikus gépekkel kezdtek kísérletezni. A 17. században történt. De csak a következő század végén kezdték el tanulmányozni az új gázt. 1785-ben Martin van Marum holland fizikus elektromos szikrákat oxigénen átvezetve ózont hozott létre. Az ózon név csak 1840-ben jelent meg; Christian Schönbein svájci kémikus találta fel, a görög ózonból származtatva, szagló. Ennek a gáznak a kémiai összetétele nem különbözött az oxigéntől, de sokkal agresszívebb volt. Tehát azonnal oxidálta a színtelen kálium-jodidot barna jód felszabadulásával; Shenbein ezt a reakciót használta az ózon meghatározására a kálium-jodid és keményítő oldatával impregnált papír kékségének mértéke alapján. Még a szobahőmérsékleten inaktív higany és ezüst is oxidálódik ózon jelenlétében.
Kiderült, hogy az ózonmolekulák az oxigénhez hasonlóan csak oxigénatomokból állnak, csak nem kettőből, hanem háromból. Az oxigén O2 és az ózon O3 az egyetlen példa arra, hogy egy kémiai elem két gáznemű (normál körülmények között) egyszerű anyag keletkezik. Az O3 molekulában az atomok szögben helyezkednek el, tehát ezek a molekulák polárisak. Az ózon a szabad oxigénatomok O2-molekuláihoz való „tapadása” eredményeként keletkezik, amelyek oxigénmolekulákból képződnek elektromos kisülések, ultraibolya sugarak, gamma-sugarak, gyors elektronok és más nagy energiájú részecskék hatására. Az ózon mindig szaga van a működő elektromos gépek közelében, amelyekben a kefék „szikráznak”, az ultraibolya sugárzást kibocsátó baktericid higany-kvarc lámpák közelében. Egyes kémiai reakciók során oxigénatomok is felszabadulnak. Az ózon kis mennyiségben képződik a savanyított víz elektrolízise során, a nedves fehérfoszfor lassú oxidációja során a levegőben, a magas oxigéntartalmú vegyületek (KMnO4, K2Cr2O7 stb.) bomlásakor, fluor hatására vízre. vagy tömény kénsav bárium-peroxidján. Az oxigénatomok mindig jelen vannak a lángban, így ha sűrített levegő áramot irányít az oxigénégő lángján, az ózon jellegzetes szagát fogja megtalálni a levegőben.
A 3O2 → 2O3 reakció erősen endoterm: 1 mól ózon előállításához 142 kJ-t kell elkölteni. A fordított reakció az energia felszabadulásával megy végbe, és nagyon könnyen végrehajtható. Ennek megfelelően az ózon instabil. Szennyeződések hiányában a gáznemű ózon 70°C hőmérsékleten lassan, 100°C felett pedig gyorsan bomlik. Katalizátorok jelenlétében az ózonbomlás sebessége jelentősen megnő. Lehetnek gázok (például nitrogén-monoxid, klór) és sok szilárd anyag (még az edény falai is). Ezért a tiszta ózont nehéz beszerezni, és a vele való munkavégzés veszélyes a robbanás lehetősége miatt.
Nem meglepő, hogy az ózon felfedezése után sok évtizedig még alapvető fizikai állandói sem voltak ismertek: hosszú ideig senkinek sem sikerült tiszta ózont előállítania. Ahogy D. I. Mengyelejev a Kémia alapjai című tankönyvében írta: „a gáznemű ózon előállításának minden módszerével oxigéntartalma mindig jelentéktelen, általában csak néhány tized százalék, ritkán 2%, és csak nagyon alacsony hőmérsékleten éri el 20%” Csak 1880-ban, a francia tudósok, J. Gotfeil és P. Chappui kapott ózont tiszta oxigénből mínusz 23 °C hőmérsékleten. Kiderült, hogy egy vastag rétegben az ózon gyönyörű kék színű. A lehűtött ózonozott oxigén lassú összenyomásakor a gáz sötétkék színűvé vált, majd a nyomás gyors felengedése után a hőmérséklet még jobban lecsökkent és sötétlila folyékony ózoncseppek keletkeztek. Ha a gázt nem hűtötték le vagy sűrítették gyorsan, akkor az ózon azonnal, sárga villanással oxigénné alakult.
Később egy kényelmes módszert fejlesztettek ki az ózon szintézisére. Ha a perklór-, foszfor- vagy kénsav tömény oldatát platina- vagy ólom(IV)-oxidból készült hűtött anóddal elektrolízisnek vetjük alá, akkor az anódon felszabaduló gáz akár 50% ózont is tartalmazhat. Az ózon fizikai állandóit is finomították. Sokkal könnyebben cseppfolyósodik, mint az oxigén -112°C-on (oxigén -183°C-on). –192,7°C-on az ózon megszilárdul. A szilárd ózon kék-fekete színű.
Az ózonnal végzett kísérletek veszélyesek. A gáznemű ózon akkor képes felrobbanni, ha koncentrációja a levegőben meghaladja a 9%-ot. A folyékony és szilárd ózon még könnyebben felrobban, különösen oxidáló anyagokkal érintkezve. Az ózon alacsony hőmérsékleten fluorozott szénhidrogénekben (freonokban) készült oldatok formájában tárolható. Ezek az oldatok kék színűek.
Az ózon kémiai tulajdonságai.
Az ózont rendkívül magas reakcióképesség jellemzi. Az ózon az egyik legerősebb oxidálószer, és ebből a szempontból csak a fluornál és az oxigén-fluoridnál gyengébb OF2. Az ózon, mint oxidálószer hatóanyaga az atomi oxigén, amely az ózonmolekula bomlása során keletkezik. Ezért az oxidálószerként működő ózonmolekula általában csak egy oxigénatomot „használ”, míg a másik kettő szabad oxigén formájában szabadul fel, például 2KI + O3 + H2O → I2 + 2KOH + O2. Sok más vegyület is hasonló módon oxidálódik. Vannak azonban kivételek, amikor az ózonmolekula mindhárom oxigénatomját felhasználja az oxidációhoz, például 3SO2 + O3 → 3SO3; Na2S + O3 → Na2SO3.
Nagyon fontos különbség az ózon és az oxigén között, hogy az ózon már szobahőmérsékleten is oxidáló tulajdonságokat mutat. Például a PbS és a Pb(OH)2 normál körülmények között nem reagál oxigénnel, míg ózon jelenlétében a szulfid PbSO4-dá, a hidroxid pedig PbO2-dá alakul. Ha koncentrált ammóniaoldatot öntünk egy ózonos edénybe, fehér füst jelenik meg - ez ózonnal oxidált ammónia, amely ammónium-nitrit NH4NO2 képződését okozza. Az ózonra különösen jellemző az a képesség, hogy AgO és Ag2O3 képződésével „feketíti” az ezüst tárgyakat.
Az ózonmolekula stabilabbá válik, ha egy elektronhoz kapcsolódunk, és negatív ionná alakulunk O3–. Az ilyen anionokat tartalmazó "ózonátsók" vagy ozonidok régóta ismertek – a lítium kivételével minden alkálifém alkotja őket, és az ozonidok stabilitása nátriumról céziumra nő. Az alkáliföldfémek néhány ózonidja is ismert, például a Ca(O3)2. Ha egy gáznemű ózonáramot egy szilárd, száraz lúg felületére irányítanak, narancsvörös kéreg képződik, amely ózonidokat tartalmaz, például 4KOH + 4O3 → 4KO3 + O2 + 2H2O. Ugyanakkor a szilárd lúg hatékonyan megköti a vizet, ami megakadályozza az ózonid azonnali hidrolízisét. Vízfelesleggel azonban az ózonidok gyorsan lebomlanak: 4KO3 + 2H2O → 4KOH + 5O2. A tárolás során is bomlás következik be: 2KO3 → 2KO2 + O2. Az ózonidok jól oldódnak folyékony ammóniában, ami lehetővé tette tiszta formájuk izolálását és tulajdonságaik tanulmányozását.
A szerves anyagok, amelyekkel az ózon érintkezésbe kerül, általában elpusztítja. Tehát az ózon, a klórral ellentétben, képes megosztani a benzolgyűrűt. Ha ózonnal dolgozik, nem használhat gumicsöveket és tömlőket - azonnal „kiszivárognak”. Az ózon reakcióba lép a szerves vegyületekkel, és nagy mennyiségű energia szabadul fel. Például az éter, az alkohol, a terpentinnel, metánnal és sok más anyaggal megnedvesített vatta ozonizált levegővel érintkezve spontán meggyullad, és az ózon etilénnel való keverése erős robbanáshoz vezet.
Az ózon használata.
Az ózon nem mindig "égeti el" a szerves anyagokat; számos esetben lehetséges speciális reakciókat végrehajtani erősen híg ózonnal. Például az olajsav ózonozása során (nagy mennyiségben megtalálható a növényi olajokban) HOOC(CH2)7COOH azelainsav keletkezik, amelyet kiváló minőségű kenőolajok, szintetikus szálak és műanyagok lágyítóinak előállítására használnak. Hasonló módon adipinsavat kapnak, amelyet a nylon szintézisében használnak. 1855-ben Schönbein felfedezte a C=C kettős kötéseket tartalmazó telítetlen vegyületek reakcióját az ózonnal, de H. Staudinger német kémikus csak 1925-ben állapította meg ennek a reakciónak a mechanizmusát. Az ózonmolekula a kettős kötéshez csatlakozva ózonidot képez, ezúttal szerves, és az egyik C=C kötést egy oxigénatom, a másikat pedig az –О–О– csoport helyettesíti. Bár néhány szerves ózonidot tiszta formában izoláltak (például etilén-ozonidot), ezt a reakciót általában híg oldatban hajtják végre, mivel az ózonidok szabad állapotban nagyon instabil robbanóanyagok. A telítetlen vegyületek ózonosítási reakciója nagy tiszteletnek örvend a szerves vegyészek körében; ezzel a reakcióval kapcsolatos problémákat gyakran még az iskolai olimpiákon is felkínálnak. A helyzet az, hogy amikor az ózonidot víz lebontja, két aldehid- vagy ketonmolekula képződik, amelyek könnyen azonosíthatók és tovább erősítik az eredeti telítetlen vegyület szerkezetét. Így a 20. század elején a vegyészek számos fontos, C=C kötést tartalmazó szerves vegyület szerkezetét állapították meg, köztük a természeteseket is.
Az ózon fontos felhasználási területe az ivóvíz fertőtlenítése. Általában a víz klórozott. A vízben azonban a klór hatására néhány szennyeződés nagyon kellemetlen szagú vegyületekké alakul. Ezért régóta javasolták a klór ózonnal való helyettesítését. Az ózonozott víz nem kap idegen szagot vagy ízt; amikor sok szerves vegyület teljesen oxidálódik ózonnal, csak szén-dioxid és víz keletkezik. Tisztítsa meg ózonnal és szennyvízzel. Az ózon oxidációjának termékei még olyan szennyező anyagok esetében is, mint a fenolok, cianidok, felületaktív anyagok, szulfitok, klóraminok ártalmatlan, szín- és szagtalan vegyületek. Az ózonfelesleg gyorsan lebomlik oxigén képződésével. A víz ózonozása azonban drágább, mint a klórozás; ráadásul az ózon nem szállítható, azt a helyszínen kell előállítani.
Ózon a légkörben.
A Föld légkörében nem sok ózon található – 4 milliárd tonna, i.e. átlagosan csak 1 mg/m3. Az ózon koncentrációja a Föld felszínétől való távolság növekedésével növekszik, és a sztratoszférában, 20-25 km-es magasságban éri el a maximumát – ez az „ózonréteg”. Ha az atmoszférából származó összes ózont a Föld felszíne közelében, normál nyomáson összegyűjtjük, mindössze 2-3 mm vastag réteget kapunk. És ilyen kis mennyiségű ózon a levegőben valóban életet biztosít a Földön. Az ózon "védőképernyőt" hoz létre, amely nem engedi, hogy a nap durva ultraibolya sugarai elérjék a Föld felszínét, amelyek minden élőlényre károsak.
Az elmúlt évtizedekben nagy figyelmet fordítottak az úgynevezett „ózonlyukak” kialakulására – olyan területekre, ahol jelentősen csökkent a sztratoszférikus ózontartalom. Egy ilyen "szivárgó" pajzson keresztül a Nap keményebb ultraibolya sugárzása eléri a Föld felszínét. Ezért a tudósok már régóta figyelemmel kísérik az ózont a légkörben. 1930-ban az angol geofizikus, S. Chapman négy reakcióból álló sémát javasolt a sztratoszférában lévő állandó ózonkoncentráció magyarázatára (ezeket a reakciókat Chapman-ciklusnak nevezik, amelyben M minden olyan atomot vagy molekulát jelent, amely elvezeti a felesleges energiát):
O2 → 2O
O + O + M → O2 + M
O + O3 → 2O2
O3 → O2 + O.
Ennek a ciklusnak az első és negyedik reakciója fotokémiai, a napsugárzás hatása alatt áll. Az oxigénmolekula atomokra bomlásához 242 nm-nél kisebb hullámhosszú sugárzásra van szükség, míg az ózon lebomlik, amikor a fény abszorbeálódik 240-320 nm tartományban (utóbbi reakció éppen megvéd minket a kemény ultraibolya sugárzástól, mivel az oxigén nem abszorbeál ebben a spektrumtartományban) . A fennmaradó két reakció termikus, azaz. menjen a fény hatása nélkül. Nagyon fontos, hogy az ózon eltűnéséhez vezető harmadik reakciónak aktiválási energiája legyen; ez azt jelenti, hogy egy ilyen reakció sebessége katalizátorok hatására növelhető. Mint kiderült, az ózon bomlásának fő katalizátora a nitrogén-monoxid. A felső légkörben nitrogénből és oxigénből képződik a legerősebb napsugárzás hatására. Az ózonoszférába kerülve két reakcióciklusba lép O3 + NO → NO2 + O2, NO2 + O → NO + O2, melynek eredményeként a légkörben lévő tartalma nem változik, és az álló ózonkoncentráció csökken. Vannak más ciklusok is, amelyek az ózontartalom csökkenéséhez vezetnek a sztratoszférában, például a klór részvételével:
Cl + O3 → ClO + O2
ClO + O → Cl + O2.
Az ózont por és gázok is tönkreteszik, amelyek nagy mennyiségben kerülnek a légkörbe a vulkánkitörések során. A közelmúltban felmerült, hogy az ózon hatékonyan pusztítja el a földkéregből felszabaduló hidrogént is. Az ózon képződésének és bomlási reakcióinak összessége ahhoz a tényhez vezet, hogy egy ózonmolekula átlagos élettartama a sztratoszférában körülbelül három óra.
Feltételezhető, hogy a természetes mellett mesterséges tényezők is befolyásolják az ózonréteget. Jól ismert példa erre a freonok, amelyek klóratomok forrásai. A freonok olyan szénhidrogének, amelyekben a hidrogénatomokat fluor- és klóratomok helyettesítik. Hűtésre és aeroszolos dobozok töltésére használják. Végül a freonok a levegőbe kerülnek, és a légáramlatokkal lassan egyre magasabbra emelkednek, végül elérik az ózonréteget. A napsugárzás hatására lebomló freonok maguk is elkezdik katalitikusan lebontani az ózont. Egyelőre nem tudni pontosan, hogy a freonok milyen mértékben okolhatók az „ózonlyukakért”, ennek ellenére már régóta tettek intézkedéseket használatuk korlátozására.
A számítások szerint 60-70 év alatt 25%-kal csökkenhet az ózonkoncentráció a sztratoszférában. Ugyanakkor a felszíni rétegben - a troposzférában - megnő az ózon koncentrációja, ami szintén rossz, mivel az ózon és átalakulásának termékei a levegőben mérgezőek. A troposzférában az ózon fő forrása a sztratoszférikus ózon légtömegekkel történő átvitele az alsóbb rétegekbe. Évente körülbelül 1,6 milliárd tonna kerül az ózon talajrétegébe. Az ózonmolekula élettartama a légkör alsó részében sokkal hosszabb - több mint 100 nap, mivel a felszíni rétegben kisebb az ózont tönkretevő ultraibolya napsugárzás intenzitása. A troposzférában általában nagyon kevés az ózon: tiszta, friss levegőn koncentrációja átlagosan csak 0,016 µg/l. A levegő ózonkoncentrációja nemcsak a tengerszint feletti magasságtól, hanem a terepviszonyoktól is függ. Így mindig több ózon van az óceánok felett, mint a szárazföldön, mivel ott lassabban bomlik le az ózon. A Szocsiban végzett mérések kimutatták, hogy a tenger partjainál a levegő 20%-kal több ózont tartalmaz, mint a parttól 2 km-re lévő erdőben.
A modern ember sokkal több ózont lélegzik be, mint őseik. Ennek fő oka a metán és a nitrogén-oxidok mennyiségének növekedése a levegőben. Így a légkör metántartalma a 19. század közepétől, a földgáz használatának kezdetétől folyamatosan nő. A nitrogén-oxidokkal szennyezett légkörben a metán oxigént és vízgőzt magában foglaló átalakulások összetett láncolatába lép be, melynek eredménye a CH4 + 4O2 → HCHO + H2O + 2O3 egyenlettel fejezhető ki. Más szénhidrogének is működhetnek metánként, például azok, amelyek az autók kipufogógázaiban találhatók a benzin tökéletlen égése során. Ennek eredményeként az elmúlt évtizedekben a nagyvárosok levegőjében az ózon koncentrációja megtízszereződött.
Mindig is azt hitték, hogy zivatar idején az ózon koncentrációja a levegőben drámaian megnő, mivel a villámlás hozzájárul az oxigén ózonná történő átalakulásához. Valójában a növekedés elenyésző, és nem zivatar idején, hanem több órával előtte következik be. Zivatar idején és utána több órán keresztül az ózon koncentrációja csökken. Ez azzal magyarázható, hogy zivatar előtt a légtömegek erős vertikális keveredése következik be, így a felső rétegekből további mennyiségű ózon érkezik. Ezenkívül zivatar előtt megnő az elektromos térerősség, és a koronakisülés kialakulásának feltételei megteremtődnek a különböző tárgyak, például az ágak csúcsain. Hozzájárul az ózonképződéshez is. Aztán a zivatarfelhő kialakulásával erős felszálló légáramlatok keletkeznek alatta, amelyek közvetlenül a felhő alatt csökkentik az ózontartalmat.
Érdekes kérdés a tűlevelű erdők levegőjének ózontartalma. Például G. Remy Szervetlen kémia kurzusában az olvasható, hogy „a tűlevelű erdők ózonizált levegője” kitaláció. így van? Természetesen egyetlen növény sem bocsát ki ózont. De a növények, különösen a tűlevelűek, sok illékony szerves vegyületet bocsátanak ki a levegőbe, beleértve a terpén osztályba tartozó telítetlen szénhidrogéneket (a terpentinben sok van). Tehát egy forró napon egy fenyőfa óránként 16 mikrogramm terpént bocsát ki a tűlevelek minden grammjára számítva. A terpéneket nemcsak a tűlevelűek, hanem néhány lombhullató fák is megkülönböztetik, köztük a nyár és az eukaliptusz. Egyes trópusi fák pedig óránként 45 mikrogramm terpéneket képesek felszabadítani 1 g száraz levéltömegre számítva. Ennek eredményeként egy hektár tűlevelű erdő akár 4 kg szerves anyagot is kibocsáthat naponta, és körülbelül 2 kg lombos erdőt. A Föld erdős területe több millió hektár, és ezek mindegyike évente több százezer tonna különféle szénhidrogént, köztük terpéneket bocsát ki. És a szénhidrogének, amint azt a metán példája mutatta, a napsugárzás hatására és más szennyeződések jelenlétében hozzájárulnak az ózon képződéséhez. Kísérletek kimutatták, hogy megfelelő körülmények között a terpének valóban nagyon aktívan részt vesznek az ózonképződéssel járó légköri fotokémiai reakciók ciklusában. Tehát az ózon egy tűlevelű erdőben egyáltalán nem találmány, hanem kísérleti tény.
Ózon és egészség.
Micsoda öröm egy zivatar után sétálni! A levegő tiszta és friss, élénkítő sugarai minden erőfeszítés nélkül a tüdőbe áramlanak. „Ózonszagú” – mondják ilyenkor gyakran. “Nagyon jót tesz az egészségnek.” így van?
Valamikor az ózont minden bizonnyal jótékony hatásúnak tartották az egészségre. De ha koncentrációja meghalad egy bizonyos küszöböt, sok kellemetlen következménnyel járhat. Az ózon a koncentrációtól és a belélegzés idejétől függően elváltozásokat okoz a tüdőben, a szem és az orr nyálkahártyájának irritációját, fejfájást, szédülést, vérnyomáscsökkenést okoz; az ózon csökkenti a szervezet ellenálló képességét a légúti bakteriális fertőzésekkel szemben. Maximálisan megengedett koncentrációja a levegőben mindössze 0,1 µg/l, ami azt jelenti, hogy az ózon sokkal veszélyesebb, mint a klór! Ha több órát tölt bent 0,4 μg/l ózonkoncentráció mellett, mellkasi fájdalmak, köhögés, álmatlanság jelentkezhet, a látásélesség csökken. Ha hosszú ideig lélegez be ózont 2 μg / l-nél nagyobb koncentrációban, a következmények súlyosabbak lehetnek - egészen a kábultságig és a szívműködés csökkenéséhez. 8-9 µg/l ózontartalom mellett néhány óra múlva tüdőödéma lép fel, ami halállal is jár. De ilyen elhanyagolható mennyiségű anyagot általában nehéz hagyományos kémiai módszerekkel elemezni. Szerencsére az ember még nagyon alacsony koncentrációban is érzi az ózon jelenlétét - körülbelül 1 μg / l, amelynél a keményítő-jódpapír nem kékül el. Egyes emberek számára az ózon szaga kis koncentrációban a klór szagára, mások számára a kén-dioxidra, másoknak a fokhagyma szagára emlékeztet.
Nem csak maga az ózon mérgező. A levegőben való részvétellel például peroxiacetil-nitrát (PAN) CH3-CO-OONO2 képződik - olyan anyag, amely erős irritáló hatású, beleértve a könnyezést is, ami nehezíti a légzést, nagyobb koncentrációban pedig szívbénulást okoz. A PAN a nyáron szennyezett levegőben kialakuló úgynevezett fotokémiai szmog egyik összetevője (ez a szó az angol füst - füst és köd - köd szóból ered). A szmogban az ózon koncentrációja elérheti a 2 μg/l-t, ami 20-szor magasabb a megengedettnél. Azt is figyelembe kell venni, hogy az ózon és a nitrogén-oxidok együttes hatása a levegőben tízszer erősebb, mint az egyes anyagok külön-külön. Nem meglepő, hogy az ilyen szmog következményei a nagyvárosokban katasztrofálisak lehetnek, különösen, ha a város feletti levegőt nem fújja be "huzat", és pangó zóna alakul ki. Tehát 1952-ben Londonban több mint 4000 ember halt meg a szmog miatt néhány napon belül. 1963-ban New Yorkban a szmog 350 ember halálát okozta. Hasonló történetek voltak Tokióban és más nagyvárosokban. Nem csak az emberek szenvednek a légköri ózontól. Amerikai kutatók kimutatták például, hogy azokon a területeken, ahol magas a levegő ózontartalma, az autógumik és más gumitermékek élettartama jelentősen lecsökken.
Hogyan csökkenthető a talajréteg ózontartalma? A metán légkörbe történő kibocsátásának csökkentése aligha reális. Marad egy másik lehetőség - a nitrogén-oxidok kibocsátásának csökkentése, amely nélkül az ózonhoz vezető reakcióciklus nem megy. Ez az út sem könnyű, hiszen nem csak az autók, hanem (főleg) a hőerőművek is bocsátanak ki nitrogén-oxidokat.
Ózonforrások nem csak az utcákon vannak. Röntgenszobákban, fizikoterápiás helyiségekben (forrása higany-kvarc lámpák), fénymásolók (másolók), lézernyomtatók működése során keletkezik (itt a kialakulásának oka nagyfeszültségű kisülés). Az ózon elkerülhetetlen társ a perhidrol, argoníves hegesztés előállításához. Az ózon káros hatásainak csökkentése érdekében a motorháztetőt ultraibolya lámpákkal kell felszerelni, és a helyiséget jó szellőztetni kell.
Pedig aligha helyes az ózont feltétel nélkül egészségkárosítónak tekinteni. Minden a koncentrációjától függ. Tanulmányok kimutatták, hogy a friss levegő nagyon gyengén világít a sötétben; a ragyogás oka az ózon részvételével zajló oxidációs reakciók. Izzást figyeltek meg akkor is, amikor vizet ráztak egy lombikban, amelybe előzetesen ózonizált oxigént töltöttek. Ez a ragyogás mindig kis mennyiségű szerves szennyeződés jelenlétével jár a levegőben vagy a vízben. Ha friss levegőt keverünk egy kilélegzett személlyel, a ragyogás intenzitása tízszeresére nőtt! És ez nem meglepő: a kilélegzett levegőben etilén, benzol, acetaldehid, formaldehid, aceton és hangyasav mikroszennyeződéseket találtak. Az ózon "kiemeli" őket. Ugyanakkor az „elfáradt”, i.e. Teljesen ózonmentes, bár nagyon tiszta, a levegő nem okoz fényt, és az ember úgy érzi, hogy "állott". Az ilyen levegő a desztillált vízhez hasonlítható: nagyon tiszta, gyakorlatilag nem tartalmaz szennyeződéseket, fogyasztása káros. Tehát az ózon teljes hiánya a levegőben nyilvánvalóan az ember számára is kedvezőtlen, mivel növeli a mikroorganizmusok tartalmát, káros anyagok és kellemetlen szagok felhalmozódásához vezet, amit az ózon elpusztít. Így világossá válik a helyiségek rendszeres és hosszú távú szellőztetésének szükségessége, még akkor is, ha nincsenek benne emberek: végül is a helyiségbe bejutott ózon nem marad el benne sokáig - részben lebomlik. , és nagyrészt leülepszik (adszorbeálódik) a falakon és más felületeken. Nehéz megmondani, hogy mennyi ózonnak kell lennie a szobában. Minimális koncentrációban azonban az ózon valószínűleg szükséges és előnyös.
Ilja Leenson